系统性硬化症并发肺癌的临床特点
2019-12-24周佳鑫张上珠李梦涛王孟昭曾小峰
钟 慧,周佳鑫,张上珠,徐 燕,侯 勇,李梦涛,徐 东,王孟昭,曾小峰
系统性硬化症(systemic sclerosis,SSc)是一种免疫介导的以微血管病变和纤维化为主要特征的多系统疾病。其患病率国外报道50~300/百万人,预后差[1]。随着血管紧张素转化酶抑制剂在硬皮病肾危象中的应用,肺间质纤维化和肺动脉高压已替代硬皮病肾危象成为SSc患者的主要死亡原因[2],非SSc造成的死亡原因中肿瘤的比例(13%)正在逐渐上升[3];恶性肿瘤位于非SSc相关死亡第2位(31.3%),仅次于感染;而在所有恶性肿瘤中,以肺癌最常见(46.7%),需要引起临床医生的关注。基于此,希望通过分析SSc并发肺癌患者的临床特点,提高临床医师对此种状况的认识,从而能够早期发现并治疗。
1 资料与方法
1.1 一般资料
选取1992年2月至2018年10月在北京协和医院住院、资料完整的SSc并发肺癌患者。SSc符合美国风湿病学会1980年制定的系统性硬化症分类标准。其中局限皮肤型SSc(limited cutaneous SSc, lcSSc)指皮肤增厚硬化局限于肘(膝)关节的远端肢体,但可累及面部、颈部。弥漫皮肤型SSc(diffuse cutaneous SSc, dcSSc)除面部、肢体远端皮肤增厚外,还可累及肢体近端和躯干皮肤。肺癌由病理或临床诊断,2016年12月31日之前确诊根据美国癌症联合会(AJCC)第7版[4]分期,2017年1月1日之后确诊根据AJCC第8版[5]分期。
1.2 方法
收集SSc并发肺癌患者的临床和实验室资料,对其临床表现、实验室检查、影像学检查、病理学检查及治疗进行分析。通过倾向性评分匹配,按照1∶4比例选取年龄、性别相匹配的同时期SSc未并发肺癌的患者作为对照组。统计分析基于SPSS 24.0版。
2 结果
2.1 一般情况
26年间共检索到18例SSc并发肺癌患者,资料完整共17例,选取同时期性别、年龄相匹配的无肺癌SSc患者68例作为对照。并发肺癌患者中女性15例(88.2%),男性2例(11.8%);SSc平均发病年龄(38.7±12.9)岁;1例男性(5.9%)有吸烟史;7例(41.2%)有肿瘤家族史,显著高于未并发肺癌的SSc患者(4例,6.2%,P=0.001)(表1)。在并发肺癌的SSc患者中,有6例一级亲属患恶性肿瘤,其中包括肺癌3例、肝癌1例、白血病1例、胃癌1例;1例患者的2名二级亲属患恶性肿瘤,包括肺癌、结肠癌。
2.2 SSc特点
17例患者中除雷诺症状外,其他首发症状以皮肤变硬最常见(76.5%),其余分别为肌痛伴肌无力1例、双手关节肿痛1例、咳嗽1例、进食哽咽1例。在并发肺癌的SSc患者中,局限皮肤型为主11例(64.7%);16例(94.1%)存在肺间质纤维化(ILD),均在肺癌诊断前出现并诊断。16例中,共13例可统计ILD诊断时间至肺癌诊断时间,中位7.5(1~28)年;5 例(38.5%)肺癌在 ILD 前 6 年发生。5例在诊断ILD 7~10年发生,3例在诊断ILD 10年以上诊断肺癌,其中1例在诊断ILD后28年诊断肺癌。其他脏器受累,肺癌 SSc 患者中肺动脉高压更常见(35.5%vs.10.3%,P=0.029),肌炎的比例更低(0%vs. 29.7%,P=0.032),而雷诺现象、指端溃疡、食管受累、毛细血管扩张、关节炎方面2组比较无明显差异。SSc肺癌患者与SSc未并发肺癌患者抗Scl-70抗体阳性率差异无统计学意义(64.7%vs.51.6%,χ2=0.922,P=0.337)(表1)。9例接受过激素治疗,5例接受过环磷酰胺治疗,其中3例有用药时间相关资料,分别使用口服环磷酰胺16个月、18个月、6年,累积量12.8、28.6、135 g。
2.3 肺癌特点
肺癌确诊年龄(53.4±10.7)岁。17例患者均在诊断SSc后出现肺癌。肺癌中位发生时间在SSc发病后10(2~39)年。16例(94.1%)在SSc发病6年以上发生肺癌。肺癌起病症状:8例为出现新发咳嗽咳痰,2例为新发活动耐量下降,2例单侧胸痛,2例咯血,3例常规复查发现肺部结节。肺癌起病症状至肺癌确诊时间从7天到5年不等,1月内确诊3例,1~6月确诊8例,6~12月确诊4例,12月以上确诊2例。肺癌发生部位:14例患者有肿瘤部位相关资料,9例(64.3%)肺癌发生在肺下叶,3例发生在肺上叶,1例左舌叶,1例肺门(表2)。病理类型以腺癌多见(13例,76.5%),鳞癌1例,小细胞肺癌1例,2例病理类型不详(1例为PET/CT及胸部CT诊断,1例胸水找到瘤细胞但未能确定病理类型)。在肺腺癌患者中仅有7例检测过表皮生长因子受体(EGFR)基因突变或间变淋巴瘤受体酪氨酸激酶(ALK)基因重排,其中6例基因突变均阴性,1例阳性。17例中14例有肿瘤标志物相关资料,其中13例患者至少有1种肿瘤标志物阳性,包括CEA、Cyfra211、NES、proGRP、SCCAg、CA125、CA153、CA199、CA242、CA724、TPA、AFP。7例检测了CEA(3例阳性),12例检测了Cyfra211、NSE(均5例阳性),8例检测了SSCAg(2例阳性),7例检测了CA125(3例阳性),4例检测了proGRP(1例阳性),5例检测了CA153(3例阳性),5例检测了CA199(1例阳性),6例检测例 CA242(2例阳性),5例检测了CA724(1例阳性),10例检测了TPA(6例阳性),3例检测了AFP(0例阳性)。6例肺癌分期为ⅢA期或ⅢA期之前。
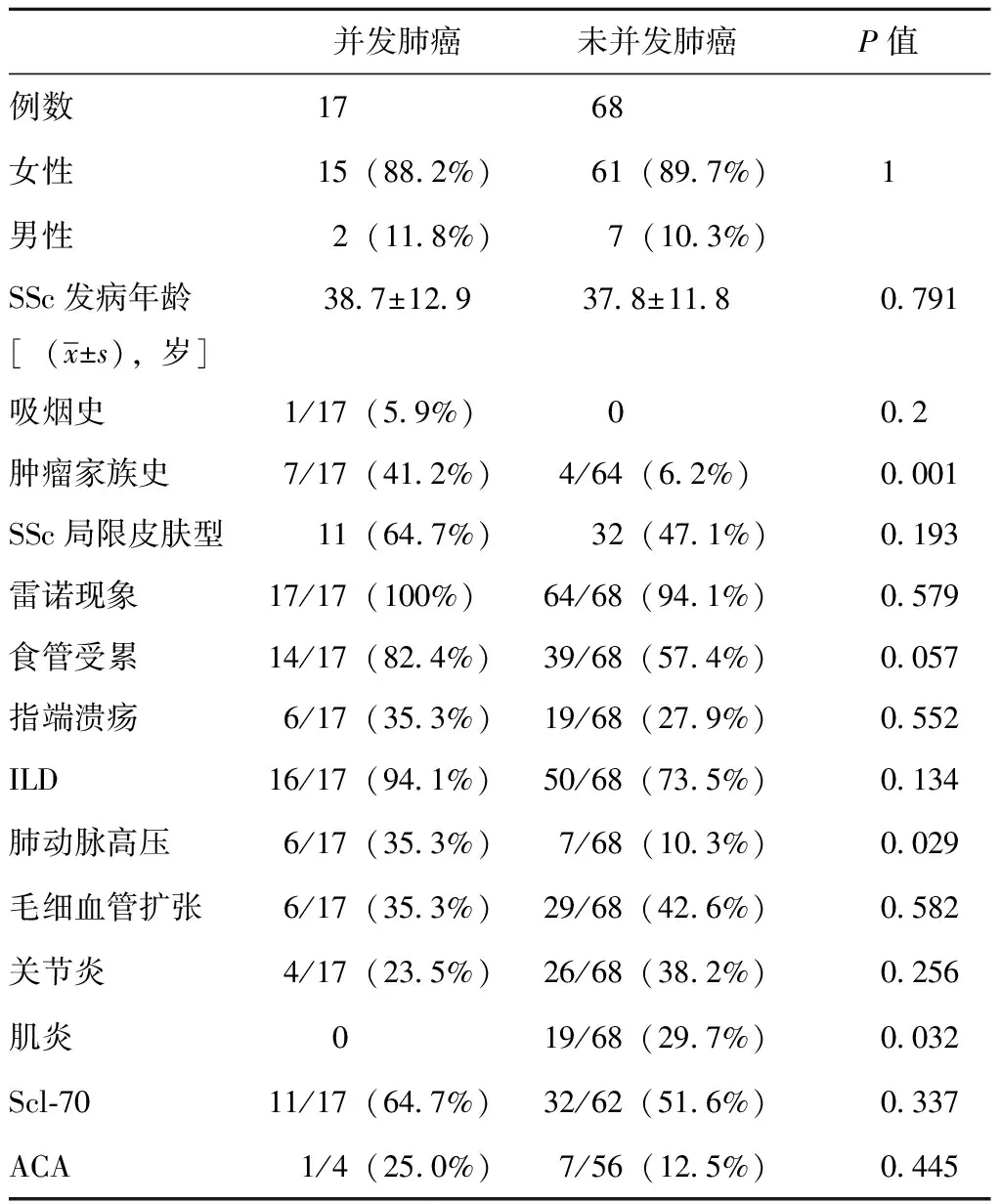
表1 SSc患者并发肺癌与未并发肺癌比较Table 1 Comparation of SSC patients with and withoutlung caner
3 讨论
系统性硬化症并发肿瘤并不少见,既往研究发现SSc患者较普通人群患肺癌风险显著升高,达4.20倍,尤其是男性可高达5.0倍[6],肺癌是SSc最常并发的肿瘤[7],发病率约为2.6%,占SSc并发恶性肿瘤的一半左右。本院之前的研究也显示肺癌是SSc中最常见的恶性肿瘤(23%)[8],需要引起临床医生的重视。本研究显示SSc患者肺癌的平均诊断年龄53岁,明显早于文献报道的普通人群肺癌的患病年龄(66~69岁)[9-10]。因此对于SSc长病程患者,即使年龄不足60岁,也需警惕肺癌的发生。关于SSc亚型与肺癌发生的关系尚存在争议,Igusa等[11]发现局限型患者更容易患肺癌,但Hill等[12]发现弥漫型更常合并肺癌。本研究中并未发现亚型与肺癌发生的相关性。
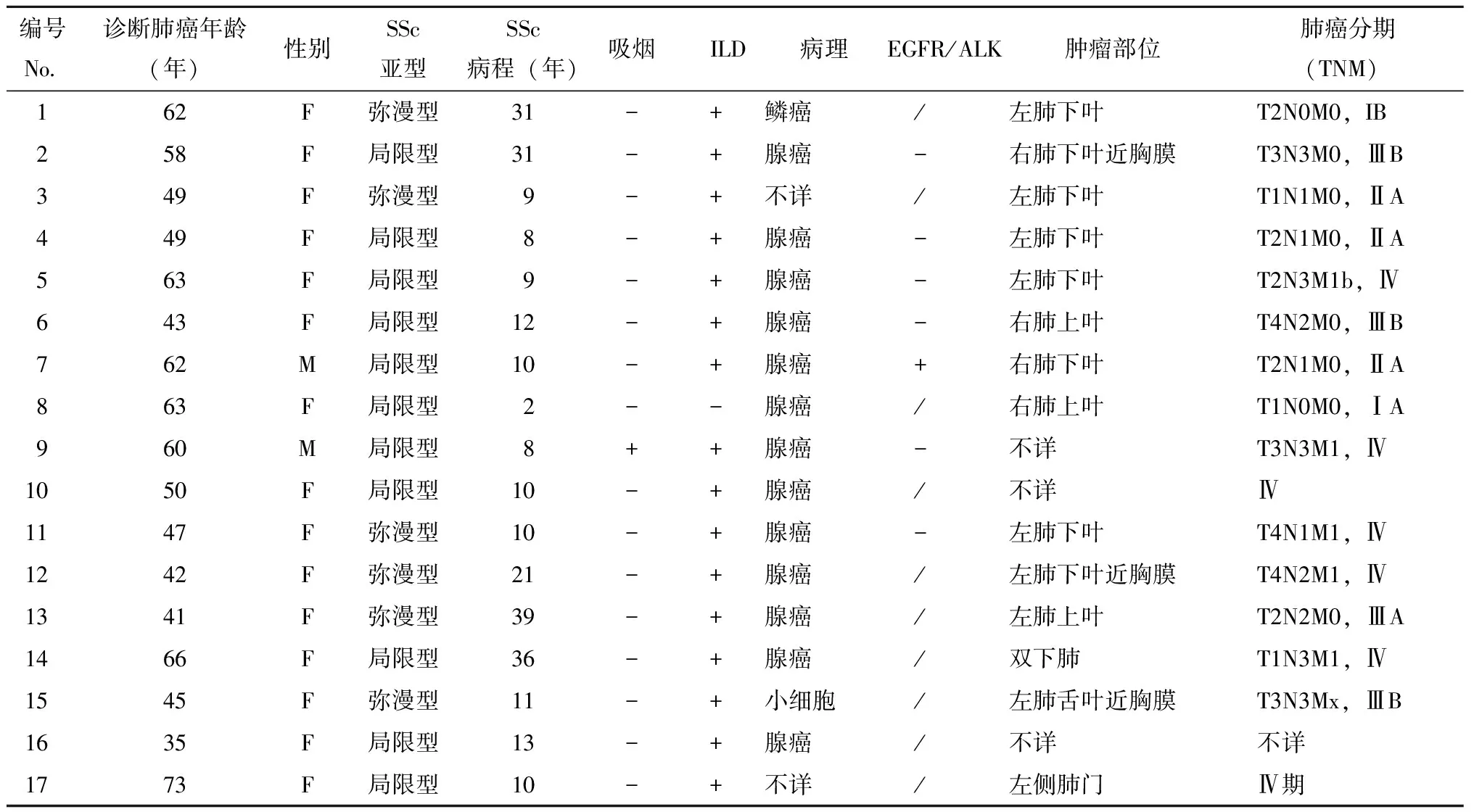
表2 SSc并发肺癌临床特点Table 2 Characteristics of SSc patients with lung cancer
F:female,女性;M:male,男性;/表示未查;+表示阳性或吸烟;-表示阴性或不吸烟
众所周知,吸烟与肺癌相关,是肺癌的独立危险因素[13-14],且其组织学类型受吸烟影响[15]。在吸烟人群中,肺癌组织学类型以鳞癌为主,而非吸烟人群以腺癌为主。有报道SSc并发鳞癌患者吸烟比例较高(30%)[16]。本研究中女性占了绝大多数,吸烟人数也很少,只有1例,无法进行统计分析,但是作为ILD和肺癌两种疾病的不利因素,对吸烟患者应被劝导戒烟。
有研究发现,肺癌患者一级亲属患肺癌的风险高于普通人群[17-18]。本研究显示,肺癌患者亲属中患有肿瘤的比例显著高于没有肺癌的患者。在SSc肺癌患者有肿瘤病史的一级、二级亲属中,均以肺癌常见。因此,对于有肿瘤家族史,尤其是有肺癌家族史的SSc患者更应引起临床医生的重视,临床医生在接诊时均应详细询问其肿瘤家族史。
ILD是SSc最常见的脏器受累表现,目前ILD与肺癌发生的关系并不明确。文献报道在ILD基础上,异常的免疫过程可能与肿瘤发生的某些过程相关:终末支气管上皮有增殖潜能,因而有恶变的潜能[19];活性氧引起的DNA损伤可能触发肿瘤发生[20];在ILD区域,致癌物原清除减少,异常的上皮更容易受致癌物影响[21]。此外,有个案报道SSc-ILD患者行肺移植后发生肺腺癌,提示还存在除ILD以外的危险因素[22]。本研究中94.1%的肺癌患者在肺癌前存在ILD且肺癌多见于下叶,与其ILD的发病部位相似,提示ILD有可能与肺癌的发生有关。但进一步的分析并未发现ILD与肺癌相关,这可能与本院ILD患病率高、肺癌患者数偏少有一定的关系,进一步的研究有赖于大规模的临床队列。目前美国国家综合癌症网络指南[23]及国内指南[24]仍提倡胸部CT作为首选的肺癌筛查手段。本研究也有3例是在每年的随诊过程中发现了肺部结节从而早期确诊。但遗憾的是,SSc-ILD的发生和进展主要在SSc起病前6年,但肺癌大多数发生在ILD诊断6年以后,在这段时间,因为ILD已逐渐趋于稳定,为减少长期多次影像学检查造成的放射线损伤,对ILD的影像学监测时间已延长,不利于早期发现肺癌。此时,寻找影像学以外的证据预测肺癌的发生就显得非常重要了。首先是症状,本研究发现五分之四的患者出现了肺部症状的加重或新发肺部症状而诊断。因此,SSc-ILD的患者出现肺部症状加重或新发肺部症状时,除考虑ILD加重、感染等因素外,也需警惕肺癌的发生,尤其是对于ILD病程长的患者。其次是生物标记物。本研究发现14例进行了肺癌相关肿瘤标记物检测的患者中,13例都出现至少一种标记物的升高,监测肿瘤标记物的变化可能对于早期发现肺癌的发生有一定的提示意义。此外,国外也有报道某些自身抗体可能与SSc并发肿瘤的风险增加有关,如抗Scl-70抗体[11]、抗RNA多聚酶Ⅲ抗体[25]及抗PM/Scl抗体[26],但其与肺癌的发生是否有关目前仍缺乏证据[11]。本研究未发现抗体与肺癌的相关性。此外,本研究发现SSc肺癌患者肺动脉高压发生率增加,推测其可能的原因:虽然ILD发生率两组之间无差异,但ILD严重患者由于肺结构改变会导致肺高压出现或加重,肺癌患者组ILD可能更严重,从而造成肺动脉高压发生率增加。这需要进一步读片以明确。
免疫抑制剂的应用与肿瘤之间的关系复杂。因SSc 中ILD比例非常高,作为有循征医学证据的环磷酰胺(CTX)在SSc-ILD患者中的应用非常广泛。 长期大剂量应用CTX可使膀胱癌、皮肤癌发生概率分别增加1.5~4.0倍[27],血液系统肿瘤发生的风险也有增加[28],但并未发现与肺癌发生相关。另一方面,CTX等免疫抑制剂减轻了全身炎症、疾病活动,从而也可降低肿瘤发生的风险[29],其也同时用于肿瘤的治疗。无论如何,由于肿瘤的发生与CTX使用持续时间、剂量以及给药方式(静脉较口服肿瘤发生风险低)相关[30-31],作为一种双刃剑,对于CTX的使用应注意剂量的控制,对长期大量使用CTX的患者应当注意监测肿瘤。
早期发现肺癌从而手术切除对于其预后至关重要。很遗憾,本研究中仅6例SSc肺癌分期为ⅢA期或ⅢA期之前,并接受了手术治疗。有报道EGRF突变阳性[18]、ALK重排[32]在不吸烟、女性、腺癌中常见,但本组7例检测了肺癌驱动基因的患者中,仅1例阳性,因数据太少无法分析SSc肺癌患者在驱动基因阳性率方面较普通肺癌患者是否存在差异,但从比例来说较低。这可能提示SSc患者肺癌的发生与普通人群存在一定的差异,其预后可能较差。
综上所述,系统性硬化症患者并发肺癌并不少见,尤其是在有肿瘤家族史的患者中。重视患者的肺部新发症状,定期随诊复查有利于早期发现,改善预后。
