程序化肿瘤发生的研究进展△
2019-12-23张百红岳红云
张百红,岳红云
解放军联勤保障部队第九四〇医院1肿瘤科,2眼科,兰州 730050
人类正常细胞发生着“时钟样”的基因突变和代谢突变,这些“基因钟”和“代谢钟”的存在提示肿瘤的发生是程序化启动的过程而非随机突变[1-2]。在人类漫长的进化过程中,肿瘤在特定人群的特定代系周期性发生,如死亡是程序化的结局,肿瘤则是程序化的开始。宇宙可能起源于一个密度无限大的点突然和剧烈的大爆炸,而这个点是多维宇宙中时间开始时的黑洞[3]。肿瘤发生的黑洞则是生命开始时的原癌基因。本文收集文献探讨肿瘤发生的程序化模式。
1 细胞包含肿瘤发生的遗传信息
生命似乎起源于40亿年前的海洋,RNA则可能是细胞起源的主体。缓慢的随机突变和自然选择形成了人体最复杂的细胞,而在最初的人体细胞中包含着肿瘤最初的启动遗传信息。正常的细胞基因组中包含着细胞原癌基因,其表达产物与细胞的正常生长、增殖和分化过程有关,甚至还可招募中性粒细胞发挥抗肿瘤免疫作用[4]。原癌基因代代相传,但本身并不形成肿瘤,这些基因有的是人类细胞的必需基因,对于维持生命至关重要[5]。人类基因组在进化过程中从周围环境获得必需的基因,即基因水平转移,这种基因水平转移会在多种生物机体间发生[6]。很多人类基因组来自移动DNA或跳跃基因,移动DNA很少引起基因疾病。但是,细胞内逆转座子长散布核元件-1(long interspersed nucleotide element 1,LINE-1)插入可能引起结肠腺瘤性息肉病基因(adenomatous polyposis coli,APC)和磷酸酯酶与张力蛋白同源物(phosphatase and tensin homolog,PTEN)失活,从而促进肿瘤发生[7]。
2 线粒体DNA 整合至细胞核DNA产生肿瘤相关基因
线粒体来源于20亿年前的真核细胞与细菌之间的内共生体。在生物的不断进化过程中,适当的线粒体DNA(mitochondrial DNA,mtDNA)成分插入整合至核DNA(nuclear DNA,nDNA)对生物进化有意义,但不良的插入整合可能导致肿瘤的发生。nDNA以及mtDNA可以在细胞内游走,mtDNA一旦获得游离于线粒体外的机会,可能会通过细胞核膜随机整合到nDNA中。如果整合刚好发生在肿瘤相关基因上,可能会导致肿瘤发生[8]。Hopkins等[9]研究发现线粒体基因突变和核基因突变密切相关,甚至共同发生一些特异突变。
线粒体是重要的信号转导细胞器,也控制着机体的免疫。最新证据显示线粒体是免疫功能的“心脏”。mtDNA作为损伤相关模式分子启动细胞凋亡,线粒体外膜是各种信号分子的转导通路,而线粒体的形成、融合和分裂则影响着免疫细胞的激活。重要的是,柠檬酸循环的中间代谢物如琥珀酸、延胡索酸和枸橼酸直接参与先天性和适应性免疫细胞的形成过程[10]。肿瘤的发生依赖于正常的线粒体代谢,或者说,线粒体控制着肿瘤发生的各个环节[11]。另外,piwi核苷酸可以识别外来“基因”并使其永久沉默。表观遗传记忆改变者不能识别“外来基因”,病毒等外来基因可融入人体基因组并多代相传,增加了肿瘤相关基因的产生[12-13]。piwi核苷酸与mtDNA一样,共同影响nDNA并产生原癌基因。
3 微生物群调控程序化进程
微生物群存在于宿主上皮屏障,由共生细菌和其他微生物组成,可以影响机体上皮稳态、代谢调节、造血、炎症、免疫和其他多种生理功能,对于有机体的生存和健康至关重要[14]。肠道微生物群促进肿瘤的发生主要通过代谢能力和对免疫和炎症的影响[15]。微生物群可能引起15%~20%的肿瘤发生,基因组测序研究提示多个肿瘤的形成与微生物群失调有关。微生物群可能改变机体的肿瘤易感性,并通过不同机制促进肿瘤发生,包括调节炎性反应、诱导DNA损伤和改变代谢等[16]。另外,微生物群的组成和活性直接影响肿瘤的各风险因素,包括生活方式、饮食和炎性反应。
大气中微量的氢气和一氧化碳可以为微生物群的生存提供需要的能量[17]。饮食可能是肠道微生物群构成和功能的最重要决定者,使其维持着机体稳态或疾病易感性[18]。母亲的微生物群促进了子代先天性免疫的形成,调控肿瘤发生的程序化进程[19]。
4 胚胎期基因组不稳定启动肿瘤驱动基因
胚胎期的每个细胞包含同样的遗传信息,但某些细胞可分化为心肌细胞,另一些细胞分化为脑细胞,但也有细胞形成了肿瘤细胞,这说明了肿瘤的发生可以追溯到最初的人类细胞(图1),只是胚胎期的基因组不稳定可能产生了肿瘤驱动基因。体细胞突变贯穿生命的全过程,而发生于胚胎早期的体细胞突变会复制到成人体细胞中,可能引起包括肿瘤在内的多种疾病。Ju等[20]运用全基因组测序法对241例成人血细胞进行测序,鉴定出163个早期胚胎突变。Kaufman等[21]首次通过活细胞影像技术观察到肿瘤从单个细胞发展的过程,并提示组织细胞只有重新回到胚胎状态才可能发展成肿瘤。
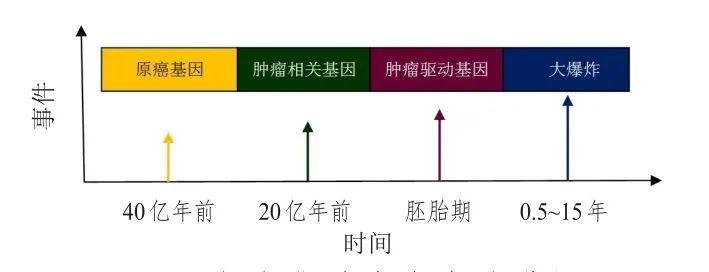
图1 程序化肿瘤发生的进展
基因组不稳定和细胞转化是肿瘤形成过程中的两个关键事件。基因组不稳定可能激活肿瘤驱动基因和启动子区域肿瘤相关基因,人类基因组中20 000个基因只有约200个基因可作为肿瘤驱动基因,而其中的3个驱动基因激活就可能诱发肿瘤[22]。一项研究分析了360例乳腺癌患者的全基因组,在9个启动子的非编码RNA序列中鉴定出驱动肿瘤发生的突变基因,它通过调节基因表达影响肿瘤发生[23]。虽然不同肿瘤可能有共同的驱动基因,但最近的临床研究认为在原癌基因信号通路和肿瘤形成中仍然存在组织部位和细胞类型的差异[24]。研究发现,支链氨基酸代谢酶1(branched chain amino acid transaminase 1,BCAT1)和BCAT2的缺失促进了非小细胞肺癌的发生,但与胰腺导管腺癌的形成无关,提示代谢需求可能决定了肿瘤的组织起源[25]。
5 肿瘤发生呈“大爆炸”模式
犹如宇宙的最初形成是大爆炸的结果,肿瘤也可能是单细胞“大爆炸”而形成(图2)[26]。Sottoriva等[27]提出了一个“大爆炸”模型,认为肿瘤早期快速膨胀生长,产生多个非选择的异质亚克隆。研究者通过对15例结肠癌患者的基因组图谱分析证实肿瘤内的高度异质性,但无选择的痕迹,肿瘤内异质性来源于早期亚克隆的改变并非后来的克隆扩增。Notta等[28]通过全基因组测序等方法发现胰腺癌的形成既不是进化也不是突变,而是同时发生的。单核基因组测序揭示乳腺癌发生的最初突然大量获得异常拷贝数,而非持续缓慢的累积突变,挑战了传统的肿瘤进化理论[29]。

图2 肿瘤发生的可能模式
6 人类肿瘤呈周期性的群体发生
Olshansky[30]对人类预期寿命和最高死亡年龄的人口分析显示,人类寿命存在极限。就像死亡是程序化的结局,肿瘤的发生则是程序化的开始。40亿年前细胞中的原癌基因因为线粒体DNA和其他移动DNA的整合产生了肿瘤相关基因,后者在代代相传中受微生物群调控,正好在某一代系受胚胎期基因组不稳定的影响启动了某一细胞的驱动基因,这个单细胞大爆炸形成了肿瘤。染色体不稳定进一步驱动了肿瘤进化过程中表型适应并引起肿瘤内异质性[31]。
7 小结
肿瘤本身可能是进化的表现,犹如生物钟控制机体生理、代谢和行为的24 h节奏,“基因钟”控制肿瘤的程序化发生。然而,表观遗传不仅调节增强子活性,还涉及学习记忆和衰老等生物学过程,表观遗传改变也可能影响肿瘤的程序化发生[32]。无法判断当前人类肿瘤的发生是高峰或低谷,因为人类的文明史还无法计算出肿瘤发生的周期性规律,但相信在人类进化的漫长过程中,肿瘤一定是在特定人群的一定代系中呈周期性发生。随着人类进入整合基因组时代[33],可能会建立精准预测肿瘤发生的模式。
