重庆地区耐多药结核分枝杆菌三种二线注射类药物耐药相关基因特征分析
2019-12-23余锋平陈立书
胡 彦,刘 洁,冯 鑫,沈 静,余锋平,陈立书
耐药结核病尤其是耐多药结核病(multidrug-resistant tuberculosis, MDR-TB)是严重危害公众健康的疾病。我国是全球30个MDR-TB高负担国家之一,2017年估算我国新发结核病患者88.9万例,耐多药/利福平耐药结核病(MDR/RR-TB)患者7.3万例,新患者和复治患者MDR/RR-TB的发生率分别为7.1%和24%[1]。重庆地区MDR-TB发生率为23.0%[2],是结核病和耐药结核病的高发区。
二线注射类药物是组成MDR-TB治疗方案的重要药物之一,在进行短程化疗方案之前,注射类药物的耐药性应常规检测[3-4]。传统药敏耗时长,应用快速可靠的分子检测技术成为必然趋势。由于不同地区菌株研究人群、流行病学和药物实际使用情况等不同,菌株耐药相关基因突变位点存在地域差异。此外,北京基因型菌株是中国的主要流行株,有更高的耐药基因突变频率,在耐药结核病的传播中起着重要作用[5-7],因此明确重庆地区注射类药物耐药表型与基因突变的相关性,并对不同基因型的耐药突变位点进行分析,将为本地区合理应用分子生物学技术进行注射类药物耐药性检测及合理制定MDR-TB化疗方案提供依据。
1 材料与方法
1.1 材 料
1.1.1菌株来源 收集2015年1月至2017年6月重庆市39个区(县)结核病防治机构967例痰涂片抗酸杆菌阳性的MDR-TB可疑患者临床分离株,经菌种鉴定及比例法药敏试验,确定为MDR-TB菌株229株(23.7%),分离自229例MDR-TB患者。男173例,女56例;年龄17~79岁,平均(45.0±15.9)岁;初治患者84例,复治患者145例。结核分枝杆菌标准菌株 H37Rv(ATCC27294)来源于中国疾病预防控制中心,国家结核病参比实验室。
1.1.2主要仪器和试剂 PCR仪购自杭州博日公司,Middle brook 7H9培养基购自美国BD公司,Alamar blue显色液购自美国Bio-Rad公司,卡那霉素(Km)、阿米卡星(Am)和卷曲霉素(Cm)药粉购自美国Sigma公司。
1.2 方 法
1.2.1药敏试验 使用7H9液体培养基(7H9∶OADC=9∶1),通过微孔板Alamar blue显色法测定注射类药物的MIC值。Km、Cm浓度梯度设置:0.08、0.16、0.31、0.63、1.25、2.5、5、10、20、40、80 μg/mL;Am浓度梯度设置:0.63、0.125、0.25、0.5、1、2、4、8、16、32、64 μg/mL。刮取改良L-J(Lowenstein-Jenden)培养基上肉眼可见后1至2周的新鲜菌落,进行磨菌、比浊,制备1个麦氏单位浓度的菌悬液,50倍稀释后取100 μL接种到不同浓度梯度的7H9液体培养基中。37 ℃培养7 d后,加入70 μL显色剂(Alamar blue∶5% Tween 80=2∶5),24 h后观察颜色变化判断MIC读数。MIC界定标准:蓝色完全没有发生改变的为最小药物浓度。耐药临界浓度参照文献[8-9]设置,Km、Cm为2.5 μg/mL,Am为1.0 μg/mL。
1.2.2耐药基因扩增和测序 结核分枝杆菌标准菌株H37Rv的rrs、eis、tlyA基因序列在NCBI主页(http://www.ncbi.nlm.nih.gov)的DNA序列数据库(GenBank )中査取获得,使用Primer 6.0软件进行引物序列设计,由北京擎科生物技术有限公司合成,引物信息见表1。PCR反应体系为50 μL,包括2×Taq PCR Master Mix 25 μL、引物各1 μL,DNA模板3 μL,去离子水20 μL。PCR 扩增条件:94 ℃变性5 min;94 ℃ 1 min,58 ℃退火1 min,72 ℃ 1 min,35个循环;再72 ℃延伸10 min。PCR产物送北京擎科公司进行测序。测序结果通过BioEdit (Version 7.1.3.0)软件与标准菌株H37Rv的基因序列进行比对分析。
1.2.3荧光PCR-熔解曲线基因分型 Rv2952基因用于鉴定北京与非北京基因型。参照文献[10-13],引物和探针序列由北京擎科生物技术有限公司合成,采用10 μL反应体系:10×反应缓冲液1 μL、脱氧核糖核苷三磷酸(dNTP) 0.4 μL、上游引物0.05 μL(0.02 μmol/L)、下游引物1 μL(0.4 μmol/L)、探针0.2 μL(0.2 μmol/L)、酶 0.2 μL、DNA 0.5 μL、双蒸水6.65 μL。反应条件:预变性95 ℃ 2 min; 变性95 ℃ 10 s,退火58 ℃ 10 s,延伸72 ℃ 10 s,共40个循环,最终延伸72 ℃ 5 min。熔解曲线分析条件为:95 ℃变性5 min,40~80 ℃熔解曲线分析,每升高1 ℃采集1次荧光,检测FAM和ROX 2个通道。
表1 PCR扩增及测序反应用的引物序列
Tab.1 PCR primer sequences used for amplification and sequencing

引物序列(5′-3′)产物长度/bpTm(℃)rrs-FGCGCAACCCTTGTCTCAT-GTTG46460rrs-RGGGGCGTTTTCGTGGT-GCTCCeis-FGCGTAACGTCACG-GCGAAATTC56758eis-RGTCAGCTCATGCAAGGTGtlyA-FGCATCGCACGTCGTCTTT94758tlyA-RGGTCTCGGTGGCTTCGTC
1.2.4相关定义及结果解释 耐多药结核病(MDR-TB)是指至少同时对异烟肼和利福平耐药的结核分枝杆菌引起的结核病。Km、Cm高、中、低水平耐药,分别为MIC≥80 μg/mL、MIC=40 μg/mL、MIC=2.5~20 μg/mL。Am高、中、低水平耐药,分别为MIC≥64 μg/mL、MIC=32 μg/mL、MIC=1~16 μg/mL[8]。
1.2.5统计学方法 采用SPSS 19.0软件进行统计学分析,样本率的比较用卡方检验或Fisher确切概率法(样本量<40或理论频数<1时),检验水准α=0.05。
2 结 果
2.1MDR-TB菌株三种二线注射类药物体外药敏试验结果 229株MDR菌株中,35株(15.3%,35/229)对至少一种二线注射类药物耐药。34株(14.8%,34/229)对Km耐药,27株(11.8%,27/229)对Am耐药(同时耐Km),19株(8.3%,19/229)对Cm耐药(其中,18株对Km和Am耐药,1株对Km敏感)。
2.23种二线注射类药物MIC分布与耐药相关基因分子特征 35株注射类耐药表型菌株中,28株(80.0%)发生基因突变,包括rrs、eis启动子区和tlyA3个基因的5种突变类型。其中,21株(60%,21/35)发生rrs基因A1401G突变,突变频率最高。该21株A1401G突变株中,18株对Km高水平耐药,3株Km中度水平耐药,差异有明显统计学意义(χ2=21.429,P<0.01);Am在21株A1401G突变株中,18株为高水平耐药,2株中度水平耐药,1株Am敏感,与Am高水平耐药相比,后两者与其差异有明显统计学意义(χ2=24.436,P<0.01;χ2=27.776,P<0.011)。Cm在21株A1401G突变株中的MIC值范围从0.31 μg/ml到80 μg/ml不等(高水平、低水平耐药及敏感株分别为1株、12株和8株)。35株耐药表型菌株中,1株发生rrs基因G1484T突变,对Km、Am均显示为高水平耐药,Cm显示为低水平耐药。在4株eis启动子区G(-10)A突变株中,Km均为低水平耐药;Am 1株为低水平耐药,3株敏感;Cm 4株均为敏感。1株发生eis启动子区C(-14)T突变,对Km、Am均显示为低水平耐药,对Cm敏感。1株发生tlyA基因137位碱基插入改变,对Cm低水平耐药而对Km、Am均敏感。见表2。
2.33种二线注射类药物耐药表型与基因突变之间的关系 在3种注射类药物耐药和敏感表型间,经卡方检验或Fisher确切概率法检验,Km耐药和敏感表型间的rrs、eis基因启动子区突变率差异有明显统计学意义,而Am、Cm耐药和敏感表型间,仅rrs基因突变率差异有统计学意义,如表3所示。
2.4不同基因型菌株二线注射类药物耐药情况 229株MDR菌株中,北京基因型菌株190株(83.0%,190/229),非北京基因型菌株39株(17.0%,39/229),虽然北京型各注射类药物耐药率高于非北京型,但差异均无统计学意义。见表4。
表2 MDR-TB 菌株rrs、eis和tlyA基因分子特征与最低抑菌浓度分布
Tab.2 MICs for second-line injectable drugs and mutant profiles of the genesrrs,eis, andtlyAamong MDR-TB isolates

耐药表型(株数)rrs基因突变eis启动子区突变tlyA基因突变突变株数[n(%)]MIC (μg/mL)KmAmCmA1401G21(60.0)40.0~>80.01.0~>64.00.31~>80.0二线注射-耐药G1484T1(2.9)>80.0>64.05.0 (35)G(-10)A4(11.4)5.0~10.00.5~2.00.63~1.25C(-14)T1(2.9)10.0 2.0 1.25 137位插入G1(2.9)2.5 0.5 5.0 Total28(80.0)2.5~>80.00.5~>64.00.31~>80.0A1449G4(2.1)1.25~2.50.25~0.50.63~2.5二线注射-敏感 Glu132Ala1(0.5)2.50.250.63 (194)396位插入A1(0.5)1.250.1251.25 Total6(3.1)1.25~2.50.125~0.50.63~2.5
表3 MDR结核分枝杆菌注射类药物耐药与基因突变的关系
Tab.3 Relationship between gene mutations and injectable drug resistance in MDR strains
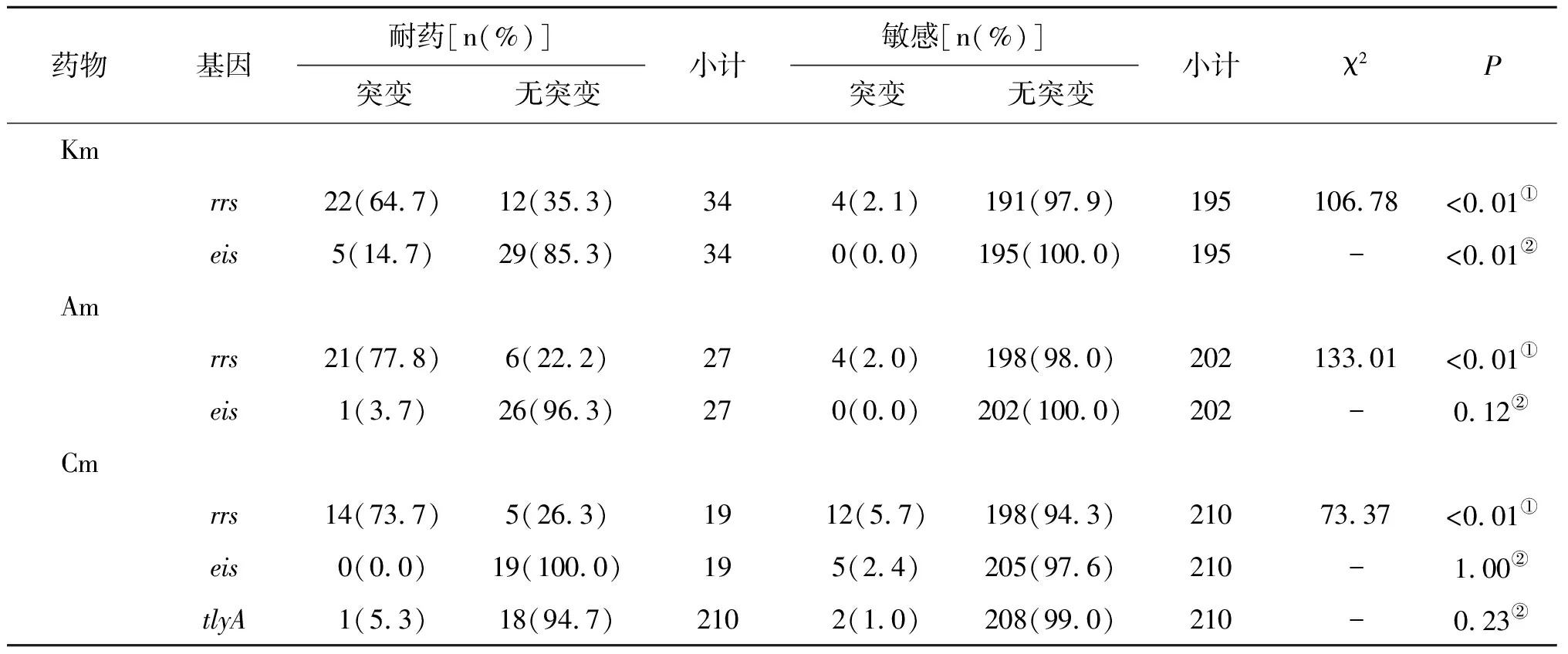
药物基因耐药[n(%)]突变无突变小计敏感[n(%)]突变无突变小计χ2PKmrrs22(64.7)12(35.3)344(2.1)191(97.9)195106.78<0.01①eis5(14.7)29(85.3)340(0.0)195(100.0)195-<0.01②Amrrs21(77.8)6(22.2)274(2.0)198(98.0)202133.01<0.01①eis1(3.7)26(96.3)270(0.0)202(100.0)202 -0.12②Cmrrs14(73.7)5(26.3)1912(5.7)198(94.3)21073.37<0.01①eis0(0.0)19(100.0)195(2.4)205(97.6)210 -1.00②tlyA1(5.3)18(94.7)2102(1.0)208(99.0)210 -0.23②
注: ①校正卡方检验,②Fisher确切概率法
表4 不同基因型二线注射类药物耐药情况
Tab.4 Second-line injectable drugs resistance among Beijing and non-Beijing genotypes
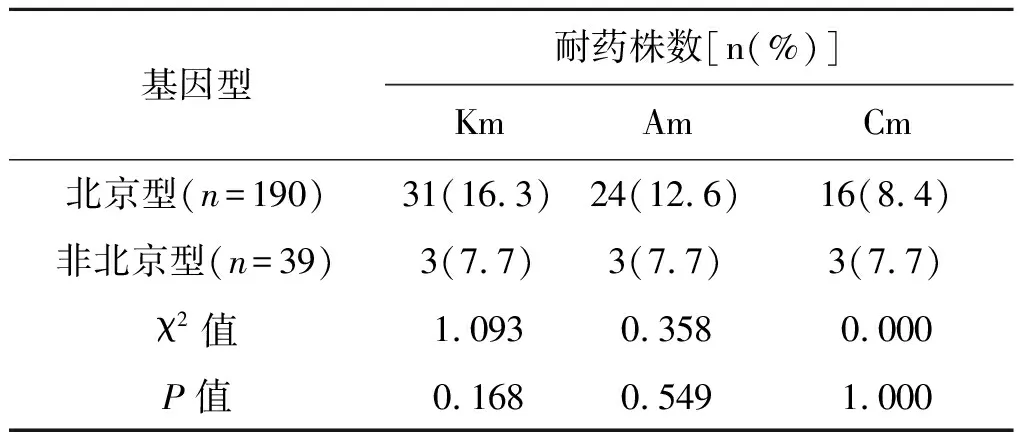
基因型耐药株数[n(%)]KmAmCm北京型(n=190)31(16.3)24(12.6)16(8.4)非北京型(n=39)3(7.7)3(7.7)3(7.7)χ2值1.0930.358 0.000 P值0.1680.5491.000
2.5不同基因型菌株二线注射类药物耐药基因突变情况 在35株注射类药物耐药菌株中,北京型和非北京型分别为31株(88.6%)和4株(11.4%)。在31株北京基因型菌株中,24株(77.4%,24/31)存在rrs、eis和tlyA基因突变。4株非北京型菌株均发生rrs、tlyA基因突变。各耐药基因在北京与非北京型间的突变情况差异无统计学意义。见表5。
表5 35株二线注射类药物耐药株不同基因型间基因突变情况[n(%)]
Tab.5 Distribution of different mutations of 35 resistant isolates among Beijing and non-Beijing genotypes

基因型rrseistlyAA1401GG1484TG(-10)AC(-14)T137位插入G无突变北京型(n=31)18(58.1)1(3.2)4(12.9)1(3.2)0(0.0)7(22.6)非北京型(n=4)3(75.0)0(0.0)0(0.0)0(0.0)1(25.0)0(0.0)P值①0.6351.000 1.000 1.000 0.1140.562
注:①Fisher确切概率法
3 讨 论
二线注射类药物是组成MDR-TB治疗方案的重要药物,其中,Km、Am属于氨基糖苷类,Cm属于多肽类药物。已有研究表明,氨基糖苷类Km以及它的衍生物Am是通过修饰16S rRNA的核糖体小体结构抑制蛋白质合成,氨基糖苷类药物耐药的产生与16S rRNA编码基因rrs突变相关[14-16]。本研究35株三种二线注射类药物耐药株中,21株(60%)发生rrs基因A1401G突变,突变频率最高,与文献[14-16]报道的一致。在21株A1401G突变株中,Cm呈现不同的MIC变化水平,Km、Am高水平耐药株均明显多于中低水平耐药株,rrs基因A1401G突变与Km、Am高水平耐药相关。此外,rrs基因A1401G突变是Km、Am和Cm发生交叉耐药的分子基础[14-17]。本研究重庆地区Km、Am和Cm耐药菌株rrs基因突变率分别为64.7%、77.8%、73.7%,与敏感株有明显统计学差异,故以rrs基因作为诊断标记物,应用于本地区二线注射类药物的耐药性检测是可行的。
eis基因启动子区突变提高了Eis蛋白表达水平,使氨基糖苷类药物乙酰化显著上升,加剧了耐药性的产生[18]。本研究eis启动子区突变率为14.3%(5/35),分别低于泰国、法国及浙江和江苏五区县的17.2%、44.0%及26.4%[14,16,19]。4株eis启动子区G(-10)A突变及1株C(-14)T突变株均为Km低水平耐药,与文献[18]报道的一致。泰国则报道eis启动子区突变表现为Km高水平耐药,可能为其他未知的耐药机制与eis启动子区突变同时发生[14]。eis基因启动子区突变仅在Km耐药与敏感表型间存在统计学差异,与Am、Cm耐药关联不大。由于eis基因启动子区其较低的突变率,可与rrs基因联合对Km耐药性进行检测。
虽然Cm属于多肽类药物,但其耐药机制与氨基糖苷类药物相似,除与编码16S rRNA的rrs基因发生突变有关外,编码2′-O-甲基转移酶的tlyA基因突变是Cm耐药性产生的重要原因,其突变导致rRNA无法被甲基化,核糖体功能受到影响而引起Cm耐药[20]。本研究仅1株Cm耐药株发生tlyA基因137位碱基插入改变,tlyA基因突变在Cm耐药和敏感表型间无显著差异,tlyA基因突变与Cm耐药的关系还需进一步证实。虽然有若干文献[14,17,20-21]报道tlyA基因突变涉及Cm耐药,但由于其较低的突变频率及突变类型的多样性,用于分子快速检测,tlyA基因并不是一个合适的靶标。
北京基因型菌株在重庆地区MDR-TB菌株中占83.0%,为本地区主要的流行株,与来自全国的数据一致[5]。各二线注射类药物的耐药性及耐药基因突变情况在北京与非北京基因型间均无统计学差异,说明本地区二线注射类药物耐药与北京基因型并无相关性。
此外,需要引起注意的是有13株(5.7%,13/229)PCR测序与表型药敏结果不一致。在35株注射类药物耐药株中7株(20.0%,7/35)未发现任何rrs、eis启动子区和tlyA基因突变,提示细胞壁渗透性降低、药物外排泵等其他耐药机制的存在,也可能与异质性耐药有关,即标本中敏感菌和耐药菌并存,低比率的耐药菌无法用分子药敏方法检出[22]。关于4株rrs基因突变及2株tlyA基因突变但表型敏感的菌株,其MIC水平多处于关键浓度值及其以下附近,可能与结果判读、菌体活性、药物浓度等操作因素或其他引起不准确因素有关。所以,分子药敏试验方法并不能完全取代表型药敏方法,两者可互为补充以提高对药物敏感性结果的正确判读,为MDR-TB患者化疗方案的制定提供可靠依据。
利益冲突:无
