VITEK MALDI-TOF MS技术在临床分离诺卡菌快速鉴定中的简易流程优化
2019-12-23杨春霞
王 鹏,隗 明,杨春霞,谷 丽
诺卡菌广泛存在于环境当中,在河流,土壤,灰尘,腐败物和动物粪便均可作为腐生菌被发现[1]。目前,有相当一部分比例的诺卡菌种可以引起人类感染,尤其以免疫低下的病人为主[2-3]。肺诺卡菌病是人感染诺卡菌最常见的致病类型[1]。自从磺胺被引入到临床治疗诺卡菌感染以来,诺卡菌的致死率急剧下降,如脑脓肿、肺部感染及皮肤和软组织感染治愈率分别达到50%、90%,和100%[4]。然而近年来诺卡菌病发生率为年0.47~2.02/10万[3, 5-6]和死亡率(31%~40%)、以及诺卡菌磺胺耐药率(2%~43%)[7]逐步增加,因此诺卡菌感染成为一个不容忽视的问题。
对于大多数临床微生物实验室而言,诺卡菌的药敏试验不能常规开展,临床医生只能根据治疗经验用药。然而据国外大多数文献报道,不同种的诺卡菌具有不同的药敏模式[8-11]。所以在实验室进行诺卡菌菌种的鉴定,对临床医生准确用药具有非常重要的意义。
如今,经典的生物化学鉴定方法不仅费时费力,而且随着诺卡菌菌种库的不断扩大,分辨不同种的能力也受到了很大程度限制;16S rRNA测序方法虽然是菌种鉴定的金标准,但此方法工作量大且技术复杂,目前大多数临床微生物实验室不具备常规开展测序工作的资源和能力[12],而且目前针对于诺卡菌鉴定的荧光定量PCR尚无商业化产品。基于以上几点原因,在临床微生物实验室常规开展诺卡菌的菌种鉴定存在较大挑战。近年来,MALDI-TOF MS由于其快速、准确、灵敏、自动化及高通量等特点,在微生物鉴定中的应用发展迅猛。根据国外文献报道,德国布鲁克公司的基质辅助激光解析电离飞行时间质谱(Bruker MALDI-TOF MS)在诺卡菌菌种鉴定中的应用已占据一席之地[13-15]。而法国梅里埃公司的VITEK MALDI-TOF MS在该菌种鉴定上起步较晚,尚需进一步对临床分离诺卡菌进行菌种鉴定能力的评估[16]。虽然两家公司MALDI-TOF MS技术对于诺卡菌的菌种鉴定均已起步,但是其复杂的蛋白提取过程,以及昂贵的试剂耗材,都是阻碍其在微生物实验室广泛开展的不利因素。在本研究中,我们在诺卡菌鉴定通用流程基础上,通过探索诺卡菌VITEK MALDI-TOF MS鉴定的影响因素和关键步骤,发展了一个快速、准确并且廉价、操作简易的诺卡菌菌种鉴定方法,为其在临床微生物实验室常规开展提供了重要基础保障。
1 材料和方法
1.1标本来源及实验流程 收集北京朝阳医院自2011年1月至2018年6月期间临床分离的革兰染色阳性分枝状串珠样,并且弱抗酸染色阳性的疑似诺卡菌46株,将其分纯培养后分别进行16S rRNA和gyrB两个基因片段测序,而后与GenBank中的模式菌比对,将最佳匹配结果作为参考标准;将不同菌龄(早期菌落和典型菌落)菌株分别用两种不同的样本处理方法进行VITEK MALDI-TOF MS鉴定,结果与参考标准对比,实验流程如图1所示。
早期菌落为仅一区有明显生长,不同菌种间略有差异,通常在48 h以内;典型菌落为三区均有生长,且第三区有单一菌落形态,培养时长在48 h以上。

*根据CLSI MM18对于16S rRNA基因序列鉴定细菌的标准:待测菌序列与模式菌对比,相似度≥99.0%且与其他种相似度之差大于0.8%,才能鉴定到种,相似度≥99.0%与其他种相似度之差差值小于0.8%,只能鉴定到属或多个种;相似度<99.0%,可能为新种[17]。图1 VITEK MALDI-TOF MS对诺卡菌的鉴定性能研究及关键步骤探索流程图Fig.1 Flow diagram of Nocardia identification ability and key steps exploration by Vitek MALDI-TOF MS
16S rRNA引物序列:
正向5′-GCTTAACACATGCAAGTCG-3′,
反向 5′-GAATTCCAGTCTCCCCTG-3′;
gyrB引物序列:
正向5′-CTTCGCCAACACCATCAACAC-3′,
反向5′-TGATGATCGACTGGACCTCG-3′。
使用Lasergene 7.1(DNASTAR,Inc.,Madison,WI)中的SeqMan程序拼接序列。使用BLAST v.2.2.10,将每株诺卡菌的部分16S rRNA和gyrB序列与GenBank数据库中的模式菌株序列进行比较,以序列最大的相似性鉴定至菌种水平。
1.3VITEK MALDI-TOF MS质谱鉴定 将待测菌分别接种到两块哥伦比亚血平板(天津金章)中,37 ℃恒温恒湿温箱孵育,早期菌落和典型菌落分别进行如下操作,流程如图2所示。

(A)提蛋白,(B) 直接涂布法,(C) 菌悬液涂布法图2 诺卡菌鉴定流程Fig.2 Procedures of Nocardia identification by Vitek MALDI-TOF MS
提蛋白MS鉴定流程:在安全柜中用1 μL接种环取一环待测菌加入含500 μL70%乙醇(ThermoFisherScientific,美国,质谱纯)的磨菌瓶中(bioMérieux,法国)(Eppendorf管中内有0.5 mm玻璃珠),水平震荡仪震荡5 min直到细菌均匀在酒精中,室温放置10 min,将菌悬液转入1.5 mL Eppendorf管中,10 625 g离心2 min,弃上清,向沉淀中加入10 μL 70%甲酸(bioMérieux,法国)吹吸沉淀室温放置5 min,加入10 μL乙腈(ThermoFisherScientific,美国,质谱纯)混匀,10 625 g离心2 min,取1 μL上清双孔位涂于靶板,待完全干燥加入1 μL CHCA基质(bioMérieux,法国),完全干燥后进行VITEK MS分析。
直接涂布法MS鉴定流程:将易分散早期菌落直接双孔位涂布于靶板上,加入1.5 μL CHCA基质,完全干燥后进行VITEK MS分析;
菌悬液涂布法MS鉴定流程:将不易分散的菌落用提蛋白MS鉴定流程中的方法分散后,将菌悬液涂布在靶板上,待完全干燥后做MS分析。
结果判读:若双孔位鉴定结果一致,直接报告鉴定结果(种、复合群);若双孔位结果不一致时,则重复鉴定3次,选取鉴定率>60%且至少出现3次的结果;如果无鉴定结果,则待测菌株无法鉴定。
2 结 果
2.116S rRNA和gyrB测序结果 将16S rRNA和gyrB序列与GenBank数据库中的模式菌株序列进行比较,46株菌均为诺卡菌属,其中分离率最高的是盖尔森基兴诺卡菌(N.cyriacigeorgica)22株,占比47.8%,其次分别为鼻疽诺卡菌(N.farcinica)7株(15.2%),脓肿诺卡菌(N.abscessus)5株(10.9%),北京诺卡菌(N.beijingensis)4株(8.7%),华莱士诺卡菌(N.wallacei)3株(6.5%),豚鼠耳炎诺卡菌(N.otitidiscaviarum)3株(6.5%),新星诺卡菌(N.nova)和亚洲诺卡菌(N.asiatica)各1株(2.2%)。
2.2VITEK MALDI-TOF MS诺卡菌鉴定结果 使用早期菌落做MS鉴定,成功鉴定到种43株(表1),鉴定率均为99.9%,多于使用典型菌落鉴定到种的39株,区别在于cy01、cy02、cy34和cy35共4株菌,典型菌落鉴定均无结果,分别对应2株北京诺卡菌和2株华莱士诺卡菌;编号cy45测序结果为新星诺卡菌,不同菌龄结果无差别,只能鉴定到复合群水平,与同为新星诺卡菌复合群的非洲诺卡菌鉴定率各占50%;编号cy46是一株亚洲诺卡菌, MS无鉴定结果。
提蛋白与菌落直接涂布两种不同的前处理方法对早期菌落进行MS鉴定时,结果完全一致,都能够将46株菌中的43株菌成功鉴定到种,占所有分离菌的93.5%,包括全部鼻疽诺卡菌(7株)、盖尔森基兴诺卡菌(22株)、华莱士诺卡菌(3株)、脓肿诺卡菌(5株)和豚鼠耳炎诺卡菌(3株),4株北京诺卡菌中的3株也成功鉴定到种,且每一株鉴定率均高达99.9%;编号cy03的北京诺卡菌双孔位鉴定重复多次,鉴定率均≤50%,北京诺卡菌与脓肿诺卡菌二选一或者加上巴西诺卡菌三选一。
表1 不同前处理方法和不同时期菌落VITEK MALDI-TOF MS对诺卡菌的鉴定结果
Tab.1 Identification of Nocardia by VITEK MALDI-TOF MS with different pretreatment methods and in different growth stages
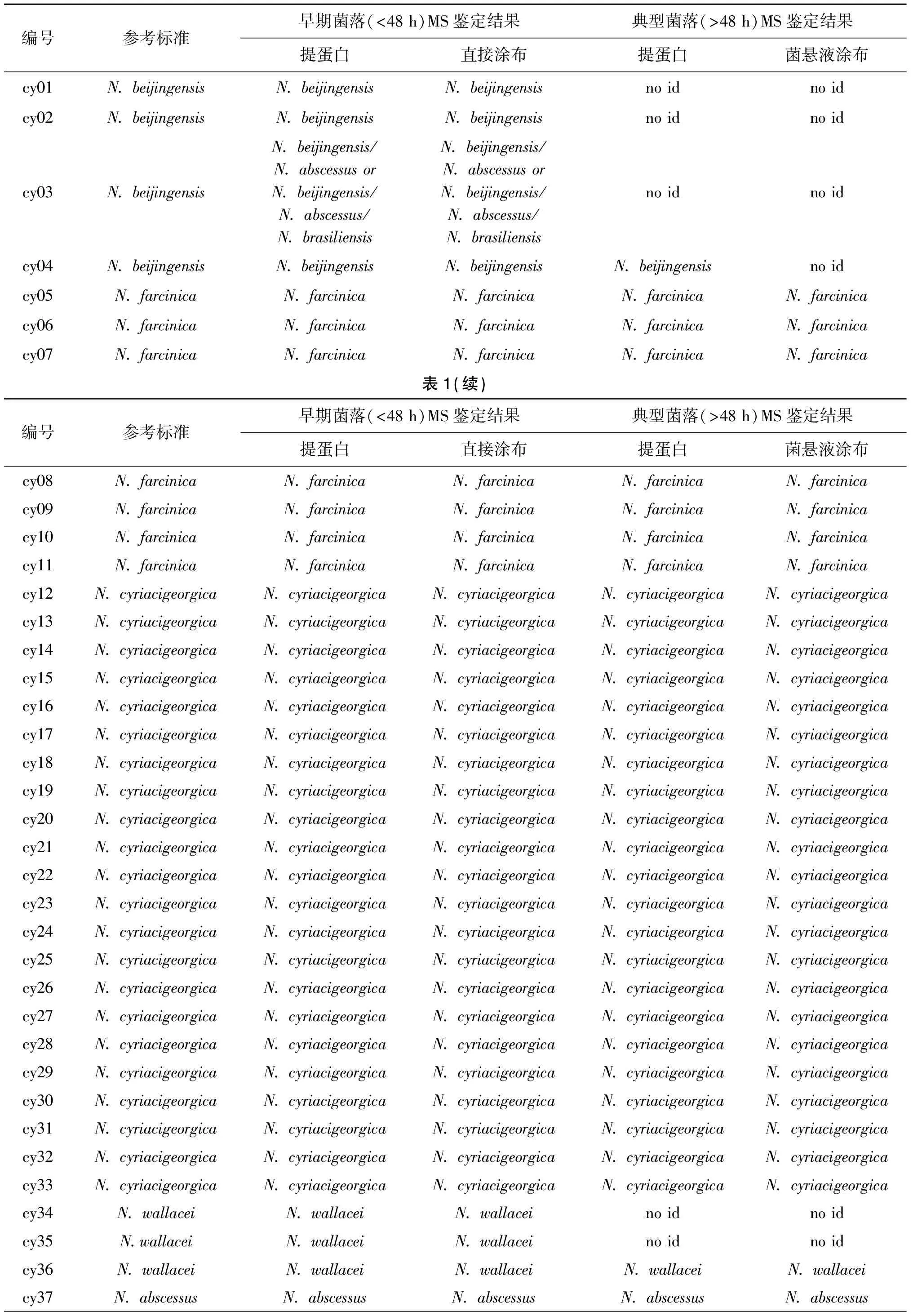
编号参考标准早期菌落(<48 h)MS鉴定结果典型菌落(>48 h)MS鉴定结果提蛋白直接涂布提蛋白菌悬液涂布cy01N. beijingensisN. beijingensisN. beijingensisno idno idcy02N. beijingensisN. beijingensisN. beijingensisno idno idcy03N. beijingensisN. beijingensis/ N. abscessus or N. beijingensis/ N. abscessus/ N. brasiliensisN. beijingensis/ N. abscessus or N. beijingensis/ N. abscessus/ N. brasiliensisno idno idcy04N. beijingensisN. beijingensisN. beijingensisN. beijingensisno idcy05N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinicacy06N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinicacy07N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinica表1(续)编号参考标准早期菌落(<48 h)MS鉴定结果典型菌落(>48 h)MS鉴定结果提蛋白直接涂布提蛋白菌悬液涂布cy08N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinicacy09N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinicacy10N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinicacy11N. farcinicaN. farcinicaN. farcinicaN. farcinicaN. farcinicacy12N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy13N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy14N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy15N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy16N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy17N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy18N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy19N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy20N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy21N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy22N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy23N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy24N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy25N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy26N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy27N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy28N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy29N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy30N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy31N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy32N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy33N. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicaN. cyriacigeorgicacy34N. wallaceiN. wallaceiN. wallaceino idno idcy35N.wallaceiN. wallaceiN. wallaceino idno idcy36N. wallaceiN. wallaceiN. wallaceiN. wallaceiN. wallaceicy37N. abscessusN. abscessusN. abscessusN. abscessusN. abscessus

cy38N. abscessusN. abscessusN. abscessusN. abscessusN. abscessuscy39N. abscessusN. abscessusN. abscessusN. abscessusN. abscessuscy40N. abscessusN. abscessusN. abscessusN. abscessusN. abscessuscy41N. abscessusN. abscessusN. abscessusN. abscessusN. abscessuscy42N. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumcy43N. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumcy44N. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumN. otitidiscaviarumcy45N. novaN. nova/ N. africanaN. nova/ N. africanaN. nova/ N. africanaN. nova/ N. africanacy46N. asiaticano idno idno idno id
N.cyriacigeorgica, 盖尔森基兴诺卡菌;N.farcinica, 鼻疽诺卡菌;N.abscessus, 脓肿诺卡菌;N.beijingensis, 北京诺卡菌;N.wallacei, 华莱士诺卡菌;N.otitidiscaviarum, 豚鼠耳炎诺卡菌;N.nova, 新星诺卡菌;N.asiatica, 亚洲诺卡菌;N.brasiliensis, 巴西诺卡菌;no id, 无鉴定结果
3 讨 论
与临床致病相关的诺卡菌菌种水平鉴定虽然具有挑战性,但不同诺卡菌种有不同的药敏模式[8-11],鉴定至菌种水平显得尤为重要。为探索Vitek MALDI-TOF MS鉴定诺卡菌方法是否可靠,我们收集了46株临床分离株验证其鉴定性能。首先我们将典型的细菌菌落(分纯培养3 d后)按照梅里埃公司提供的标准化操作程序(SOP)要求,使用甲酸和乙腈提取蛋白后进行MS分析,得到84.8%(36/43)的菌种水平鉴定率。通过与参考标准方法比较我们发现该方法对于北京诺卡菌和华莱士诺卡菌鉴定性能较差。大多数诺卡菌都是干燥不易分散的,尤其北京诺卡菌和华莱士诺卡菌还有噬琼脂现象,这更增加了制备菌悬液提取蛋白的难度。在分纯培养的过程中我们发现,培养早期的菌落容易从培养基上刮下,所以我们采用标准的甲酸、乙腈提取蛋白制备方法采用“年轻”(培养时间<48 h)菌落制备样品进行鉴定。相较于典型菌落(培养时间>48 h),菌种水平鉴定率从84.8%提高到93.5%(43/46)。该结果标明,菌龄小于48 h的鉴定结果显著优于菌龄大于48 h的菌种鉴定结果。所以菌龄是诺卡菌鉴定中的关键因素之一,其与Khot等和McTaggart 等的研究结果一致[13,18],具体的机制还需进一步深入研究。
和大多数诺卡菌不同,鼻疽诺卡菌湿润易分散,直接用接种环就能将其均匀涂布在靶板上,和其他常见菌一样,直接加CHCA基质,6株鼻疽诺卡菌全部鉴定到种。受鼻疽诺卡菌启发,我们将不同菌龄的诺卡菌采用非提蛋白-即直接将菌或菌悬液涂于靶板做MS鉴定,结果如表1所示:<48 h直接涂布鉴定结果与提蛋白鉴定结果完全一致;>48 h菌悬液涂板鉴定和提蛋白鉴定结果相比,仅有一株北京诺卡菌无鉴定结果,该结果是否提蛋白并不是诺卡菌鉴定的关键步骤,所以诺卡菌VITEK MALDI-TOF MS鉴定中提取蛋白过程可以省略。基于采用早期菌落和省略提取蛋白过程,使诺卡菌鉴定通用流程发展成为一个更加简单、经济、快速的鉴定流程。选取早期菌落直接涂布法,省去了机械分散破碎的过程,节约了甲酸、乙腈提取蛋白的成本,更重要的是减少培养时间,更早地为临床提供病原学结果。
该研究结果显示,采用本文鉴定流程,诺卡菌菌种鉴定率为93.5%,与先前的报道略有提高。有报道称,在商业数据库的基础上结合其内部相关数据,可以获得更高的鉴定率[19]。目前,我们使用的VITEK MALDI-TOF MS V3.0的鉴定库包含15种诺卡菌,亚洲诺卡菌不在其中,后期随着我们分离的诺卡菌菌种和数量的增多,建立本中心的诺卡菌数据库具有重要意义。相较于测序方法,VITEK MALDI-TOF MS操作方法简单,数据分析采用自动化方案(所测峰图与数据库中标准菌株峰图比对),菌种鉴定所需时间短(20~30 min);但数据库中仅有常见致病菌种数据,所以对于不常见诺卡菌致病菌种,还需要借助于测序方法进行鉴定。
目前VITEK MALDI-TOF MS采用提取蛋白鉴定流程还广泛应用于结核分枝杆菌、其他需氧放线菌以及丝状真菌等不易分散的干燥菌落,均采用标准鉴定流程[20-22],是否可以忽略提取蛋白步骤尚无相关报道,有待进一步验证。
VITEK MALDI-TOF MS技术在诺卡菌快速鉴定中具有重要的应用价值。当然,未来只有进一步优化相关样品处理方法,完善鉴定数据库,才能使VITEK MALDI-TOF MS技术更广泛的应用于临床微生物实验室,更好地服务于医生进行疾病诊断。
致谢:感谢北京朝阳医院感染和临床微生物科全体同事对诺卡菌分离做出的贡献。
利益冲突:无
