MDCK悬浮细胞制备及流感病毒敏感性研究
2019-12-23李自良王家敏赵彩红王美皓张雪梅靳冬武马忠仁乔自林
李自良,王家敏,赵彩红,王美皓,李 莉,张雪梅,李 倬,靳冬武,马忠仁,乔自林
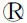
1 材料与方法
1.1 材 料
1.1.1细胞 贴壁培养型MDCK细胞:从ATCC引进,引进后由甘肃省动物细胞技术创新中心按《中国药典》2010版的要求建立主细胞库(MDCK-M-60,P60)和工作细胞库(MDCK-W-63,P63);用含10%FBS(V/V)的DMEM培养基培养。
悬浮培养型MDCK细胞:本课题组自主驯化、冻存,并命名为MDCK-XF02细胞;用MDCK-SFM-(CFM-402)无血清培养基培养。
1.1.2病毒 疫苗生产用流感病毒:A/California/7/2009 X-179A(H1N1);A/Texas/50/2012 X-223A(H3N2);B/Phuket/3073/2013(B/P);B/Brisbane/60/2008( BX-35);疫苗生产用禽流感病毒:H5亚型Re-5、H5亚型Re-6、H5亚型Re-10。
1.1.3培养基与血清 DEME(high-glucous)培养基:购自兰州百灵生物技术有限公司;血清(FBS):购自兰州民海生物工程有限公司;MDCK-SFM-(CFM-402)无血清培养基:购自兰州百灵生物技术有限公司。
1.1.4主要试剂与仪器 TrypLE 胰蛋白酶替代物(1X),货号:12563-029,购自Gibco公司。0.2%台盼蓝,购自Sigma公司;二甲基亚砜(Thermo Scientific);TPCK-胰蛋白酶,购自Sigma公司。
CKX-41型生微倒置显微镜(Olympus)、3111型CO2培养箱(ThermoFisher)、IC1000细胞计数仪(Countstar),ZCZY-AS8型震荡培养箱(上海知楚仪器)、BioFlo 320型5L生物反应器(Eppendorf)。
1.2 方 法
1.2.1MDCK细胞低血清适应培养和驯化 用含10%FBS(V/V,下同)的DMEM培养基复苏贴壁培养型MDCK细胞(MDCK-W-63),待细胞长满单层后,用0.25%胰蛋白酶(m/m)消化分散细胞,连续传代培养。贴壁培养型MDCK细胞每传代培养两代培养基中FBS浓度降低1%,至最终培养基中的FBS浓度为1%。
1.2.2MDCK细胞无血清悬浮培养和驯化 从血清浓度降到1%适应传代培养两代后,消化液由胰蛋白酶换为TrypLE胰蛋白酶替代物,并逐步减少DMEM的量(含1%FBS),逐步增加无血清培养基的量,培养基中的DMEM的量(含1%FBS)组分比例降低为20%再继续传代培养两代。之后传代培养时开始扩大细胞培养,细胞总数达2.0×108cells以上时,消化离心后用无血清培养基调整细胞密度为3.0×106cells/mL,取50 mL细胞悬液用150 mL锥形瓶在37 ℃、5%CO2和110 r/min摇床悬浮培养,每天离心更换无血清培养基1次。待悬浮培养MDCK细胞的活细胞密度达6.0×106cells/mL以上时离心后按2.0×106cells/mL密度分瓶培养,以此连续传代,每分瓶培养1次记为一次传代培养。
1.2.3MDCK-XF02细胞的冻存、复苏与活率检测 常规方法冻存、复苏并检测细胞活率[14]。
1.2.4MDCK-XF02细胞生长曲线绘制、生长动力学分析及连续传代稳定性验证 MDCK-XF02细胞复苏培养3代后,以不同密度接种,置摇床(37 ℃、5% CO2、110 r/min)悬浮培养,每个接种密度平行3组,每12 h取样计数,绘制细胞生长曲线。并比较不同密度接种培养MDCK-XF02细胞的最大増殖密度、倍增时间[15]、比生长速率[16]。并以最佳接种密度接种连续传代培养10代,平行3组,每24 h取样计数,绘制细胞生长曲线。
倍增时间=T/A,A=log2(Y/X)
X为初始接种细胞数,Y为细胞最大増殖密度前一天的细胞数,T为培养时间。
比生长速率=(lnXn/Xn-1)/(tn-tn-1)
X为活细胞密度,t为培养时间,n和n-1为2个取样计数时间点。
1.2.55L生物反应器放大培养 将传代培养至不同代次的MDCK-XF02细胞按最佳接种密度接种于5 L生物反应器,设定培养参数,温度37 ℃,转速120 r/min,pH 7.2,Do(Dissolved oxygen) 40%,通气量0.002-1 VVM(Air Volume/culture volume)/min。每24 h取样计数,绘制细胞生长曲线。比较最大増殖密度、倍增时间、比生长速率。
1.2.6MDCK-XF02细胞增殖流感和禽流感病毒敏感性研究 MDCK-XF02细胞生长至密度(8.0~10.0)×106cells/mL时,用无血清培养基稀释至密度为(4.0~5.0)×106cells/mL,按病毒感染复数(MOI)0.01接种四种型别的流感病毒和三种型别的禽流感病毒并添加2.5 μg/mL TPCK胰蛋白酶,每种病毒平行3组,置于34 ℃、5% CO2、110 r/min培养。病毒接种24 h、36 h、48 h、60 h测定血凝效价(HA)和半数细胞感染量(CCID50),拍照观察细胞形态和病变程度,并绘制不同时间HA、CCID50图。

2 结 果
2.1MDCK细胞低血清适应培养和驯化 贴壁培养型MDCK细胞(MDCK-W-63)逐步降低培养基中胎牛血清浓度,(从P64代传代培养至P83代,共计连续低血清适应培养20代。因降低FBS浓度使细胞生长速度变慢,传代比例也相应降低。其中P64-P69代以1∶6的比例传代培养;P70-P75代以1∶5的比例传代培养;P76-P83代以1∶4的比例传代培养。)至P83代时已适应了1%FBS培养,按1∶4比例传代培养时,48 h仍可生长成单层细胞,细胞形态与10%FBS培养时相似,但细胞长成单层时相互挤压或重叠现象不如10%FBS培养时明显。如图1A和1B所示。

图1 驯化前后MDCK细胞形态对比(A:10%FBS,B:1%FBS,C:MDCK-XF02)Fig.1 Morphological comparison of MDCK cells before and after domestication
2.2MDCK细胞无血清悬浮培养和驯化 血清浓度降到1%适应传代培养两代后(P82、P83代),从P84代传代培养至P98代,共计连续无血清悬浮驯化培养15代。至P96代传代时开始扩大细胞培养量,至P98时细胞总数达2.0×108个以上,消化离心后全用无血清培养基调整细胞密度为3.0×106cells/mL。至P99代时细胞适应无血清培养,在无血清培养基中悬浮培养活力高、结团少、均一性好,经6次换液后基本适应了悬浮条件下培养,细胞生长速度变快,第9次换液后培养24 h,细胞密度达6.3×106cells/mL。悬浮培养的MDCK细胞(P99代)第一次传代后以2.0×106cells/mL接种培养生长速度逐步加快,如图2所示。
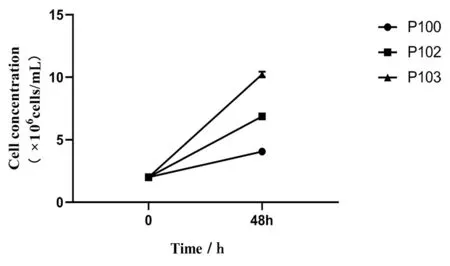
图2 悬浮培养型MDCK细胞(P100-P103代)生长密度Fig.2 Growth density of suspension cultured MDCK cells (P100-P103 generation)
2.3MDCK-XF02细胞的冻存、复苏和活力检测结果 悬浮培养的MDCK细胞无血清传代培养至P103代时冻存300支,冻存密度为5.4×107cells/mL,细胞活力为92.15%,将驯化的悬浮培养型MDCK细胞株命名为:MDCK-XF02。冻存的MDCK-XF02细胞复苏活力达91.22%,复苏后细胞形态呈圆形,细胞边缘整齐,大小较均一,如图1C所示。
2.4MDCK-XF02细胞生长曲线绘制、生长动力学分析及传代稳定性验证 MDCK-XF02细胞复苏培养3代后,以0.5×106cells/mL、1.0×106cells/mL、1.5×106cells/mL、2.0×106cells/mL、3.0×106cells/mL的密度接种培养,细胞生长均快,生长曲线成近“S”型,如图3所示。细胞经过12 h的潜伏期,此后迅速进入对数生长期,不同密度接种平台期维持时间不同,之后细胞密度迅速下降,进入衰亡期。
比生长速率如图3所示,分别为(0.034±0.011)h-1、(0.025±0.022)h-1、(0.022±0.02)h-1、(0.019±0.020)h-1、(0.016±0.025)h-1。不同接种密度培养MDCK-XF02细胞均在36 h时达到最大比生长速率,最大比生长速率分别为(0.056±0.007)h-1、(0.056±0.019)h-1、(0.056±0.009)h-1、(0.047±0.007)h-1、(0.055±0.008)h-1。随后比生长速率迅速下降,在60 h时3.0×106cells/mL的密度接种培养的MDCK-XF02细胞比生长速率已降低为(-0.002±0.005)h-1。
最大增殖密度如图4所示,不同密度接种培养MDCK-XF02细胞的最大增殖密度分别为(13.40±0.70)×106cells/mL、(13.17±1.36)×106cells/mL、(13.67±0.76)×106cells/mL、(14.03±1.19)×106cells/mL、(13.93±0.55)×106cells/mL。比较发现不同密度接种培养MDCK-XF02细胞的最大增殖密度差异无统计学意义(P>0.05)。
倍增时间如图4所示,分别为(18.96±0.35)h、(20.04±0.56)h、(20.25±1.30)h、(22.29±0.30)h、(21.40±0.83)h。不同密度接种培养MDCK-XF02细胞的倍增时间随着接种密度的增大逐渐增加,接种密度高低会直接影响细胞的生长周期,接种密度过高导致细胞快速达到最大增值密度,大量细胞代谢副产物极剧增加,迅速进入衰亡期。接种密度过低会导致培养时间增加,大大增加了生产成本和污染风险。选择合适倍增时间不仅有利于细胞最佳的生长状态也有利于生产实际结合,降低生产成本。

图3 不同接种密度培养MDCK-XF02细胞生长曲线和比生长速率Fig.3 Growth curve and specific growth rate of MDCK-XF02 cells inoculated with different densities

图4 不同接种密度培养MDCK-XF02细胞最大增殖密度和倍增时间Fig.4 Maximum proliferation density and doubling time of MDCK-XF02 cells cultured in different densities
传代稳定性如图5所示,以(1.0~2.0)×106cells/mL细胞密度接种后生长48 h细胞密度均能达到(11.08±0.24)×106cells/mL,在连续传代培养的过程中细胞形态和生长状况接近一致,P110-P120代MDCK-XF02细胞的比生长速率差异均无统计学意义(P>0.05)。

图5 MDCK-XF02细胞传代稳定性Fig.5 MDCK-XF02 cell passage stability
综合以上对MDCK-XF02细胞株不同接种密度培养生长曲线绘制及生长动力学分析发现,以(1.0~2.0)×106cells/mL细胞密度接种培养效果最佳,不仅有利于细胞最佳的生长状态也有利于生产实际结合,降低生产成本;连续传代培养结果说明,在无血清悬浮培养基中MDCK-XF02细胞能连续传代培养且生长动力学较稳定;从病毒扩增和疫苗生产方面来说,以(1.0~2.0)×106cells/mL细胞密度接种有利于更好的控制细胞代谢产物和稳定的培养环境,从而使得单位细胞病毒产率达到最大。当然,对单位细胞病毒产率的影响因素还有许多,但就从细胞接种密度的选择上,MDCK-XF02细胞株以(1.0~2.0)×106cells/mL细胞密度接种最佳。
2.55L反应器放大培养 MDCK-XF02细胞传代至P110、P120、p130代按2.0×106cells/mL接种于5L生物反应器,细胞生长状态良好,大小均一。细胞生长曲线如图6所示,从图中可以看出生长曲线近呈“S”型,培养至72 h时细胞密度达到最大值:比生长速率分别为(0.027±0.012)h-1、(0.028±0.013)h-1、(0.028±0.013)h-1差异无统计学意义(P>0.05),如图6。倍增时间、最大増殖密度结果见表1;结果显示,线性放大过程中,MDCK-XF02细胞生长动力学较稳定。
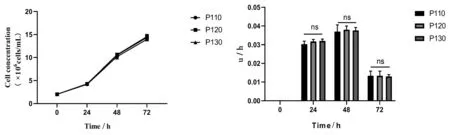
图6 5L生物反应器培养不同代次MDCK-XF02细胞生长曲线和比生长速率Fig.6 Growth curve and specific growth rate of different generations of MDCK-XF02 cells cultured in 5L bioreactor
表1 5L生物反应器培养不同代次MDCK-XF02细胞倍增时间和最大增殖密度
Tab.1 doubling time and maximum proliferation density of different generations of MDCK-XF02 cells cultured in 5L bioreactor
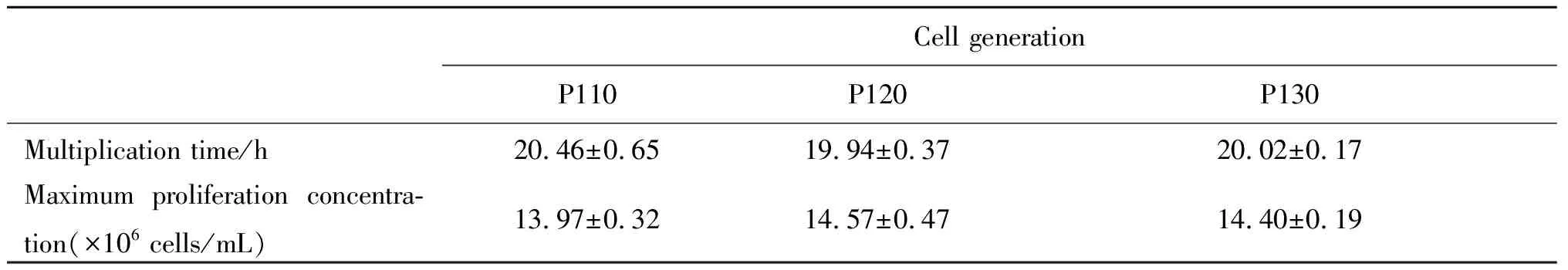
Cell generationP110P120P130Multiplication time/h20.46±0.6519.94±0.3720.02±0.17Maximum proliferation concentra-tion(×106 cells/mL)13.97±0.3214.57±0.4714.40±0.19
2.6MDCK-XF02细胞增殖流感和禽流感病毒敏感性研究 MDCK细胞目前应用最广泛的流感研究细胞系之一,然而,MDCK细胞对不同流感和禽流感病毒株的敏感性并不相同,病毒的增殖效率也受到限制。值得关注的是,MDCK-XF02细胞增殖流感和禽流感病毒动力学显示,在感染后36~48 h达到最大滴度,允许在早期收获,从而从一定程度上减轻了下游纯化工艺的难度。流感病毒B/P在36 h达到最大病毒颗粒释放量的特异性生产动力学。我们的研究结果表明,MDCK-XF02细胞系是一个非常有应用价值的工业化生产流感和禽流感疫苗的细胞株。
2.6.1流感病毒敏感性 不同时间HA、CCID50见图7,MDCK-XF02细胞接种H1N1和H3N2均能很好的生长,培养24 h HA效价(log2HA/25 μL)为4~5、CCID50为(2.27~2.59)lgCCID50/mL,60 h时 HA效价(log2HA/25 μL)为6~7、CCID50为(4.35~4.68)lgCCID50/mL;接种流感病毒B/P和BX-35增殖更快,36 h HA效价(log2HA/25 μL)均为8、CCID50分别为7.31lgCCID50/mL、5.53lgCCID50/mL,60 h时HA效价(log2HA/25 μL)达到9~10,CCID50分别为6.14lgCCID50/mL、6.38lgCCID50/mL。
如图8所示,接毒后24 h细胞出现皱缩,结团现象,36 h时细胞大量结团,生长停滞。48~60 h细胞开始崩解、出现大量细胞碎片。接种不同型别的流感病毒其病变过程相似,但病变程度强弱有差异。
2.6.2禽流感病毒敏感性 悬浮培养型MDCK-XF02细胞接种重组禽流感病毒H5亚型Re-5、H5亚型Re-6、H5亚型Re-10均能很好的生长,培养24 h HA效价(log2HA/25 μL)为4~5、CCID50为(4.11~4.37)lgCCID50/mL,60 h时HA效价(log2HA/25 μL)为7~9、CCID50达到(6.21~6.96)lgCCID50/mL;不同时间HA、CCID50见图9。

图7 MDCK-XF02细胞株增殖流感感病毒的HA和CCID50Fig.7 MDCK-XF02 cell line proliferating influenza virus HA and CCID50

图8 病毒致MDCK-XF02细胞病变(A: 0 h, B: 12 h, C: 24 h, D: 36 h, E: 48 h, F: 60 h)Fig.8 Cytopathic effect of MDCK-XF02 (A: 0 h, B: 12 h, C: 24 h, D: 36 h, E: 48 h, F: 60 h)

图9 MDCK-XF02细胞株增殖禽流感病毒的HA和CCID50Fig.9 MDCK-XF02 cell line proliferating avian influenza virus HA and CCID50
3 讨 论
MDCK细胞为贴壁培养型细胞,需要添加血清才能正常生长。无血清悬浮培养工艺的难点是将原始的含血清贴壁培养型细胞系驯化为无血清悬浮培养型细胞株;本研究首先对ATCC引进的贴壁培养型MDCK细胞系通过低血清适应培养和驯化至最终培养基中的FBS浓度由10%降为1%,后用无血清培养基悬浮培养和驯化,最终成功得到了一株新型的无血清悬浮培养型MDCK-XF02细胞株,进一步从摇瓶扩大至生物反应器培养。并用MDCK-XF02细胞株作为底物接种四种型别的流感病毒和3种型别的禽流感病毒,初步研究了该细胞株对流感和禽流感病毒的增值特性。从摇瓶悬浮培养扩大至5L生物反应器培养过程中MDCK-XF02细胞的生长曲线绘制及生长动力学分析发现,接种密度高低会直接影响细胞的生长周期,以(1.0~2.0)×106cells/mL细胞密度接种培养效果最佳。MDCK-XF02细胞株作为底物接种流感病毒和禽流感病毒的初步应用中发现,该细胞株能够增殖流感和禽流感病毒且增殖效果好。
细胞培养是目前公认的最经济、快速和安全的病毒增殖方法。近年来,生物反应器大规模细胞技术的快速发展,与传统转瓶和细胞工厂培养相比表现出了明显优势,用生物反应器培养细胞和增殖病毒已成为疫苗生产工艺的首选。无论是微载体培养、片状载体培养,还是低血清悬浮培养,因培养基中含有动物来源的血清成份对疫苗接种者有副反应和其它安全风险,所以,无血清悬浮培养是疫苗生产最青睐的工艺,而且还可以线性放大,应用价值巨大,对流感疫苗和禽流感疫苗的工业生产意义重大[17]。
利益冲突:无
