扁舵鲣鱼低聚肽化学组成及其对人体肝癌细胞的抑制作用
2019-12-23龙慧静
吉 薇,刘 扬,龙慧静
(1.广东第二师范学院生物与食品工程学院,广东 广州 510303;2.广东兴亿海洋生物工程股份有限公司,广东 广州 510670;3.肇庆兴亿海洋生物工程有限公司,广东 肇庆 526238)
【研究意义】扁舵鲣鱼,学名称鲣鱼,又称小金枪鱼,俗称炸弹鱼,属鲈形总目、金枪鱼亚目、金枪鱼科、舵鲣亚科、鲣属。鲣鱼体长达60 cm左右,与金枪鱼最为相似,是世界金枪鱼捕捞中最主要的目标鱼种,也是金枪鱼中最廉价的鱼种。鲣鱼广泛分布于各大洋的暖热海域, 2000—2014年中西太平洋的鲣鱼总产量为2.4793×107t,占世界总产量的63.9%[1]。我国南海和东海鲣鱼资源也十分丰富。目前鲣鱼除少数用作加工罐头与鲜食外,大多没有得到很好利用,资源利用率与附加值低[2]。开展鲣鱼低聚肽的抗肿瘤功能研究将对鲣鱼的深度开发与利用具有重大意义。【前人研究进展】Doyen等[3]从雪蟹副产物的酶解产物中分离出11种低聚肽,体外细胞试验结果表明,其中4种低聚肽对A549(肺癌细胞)、BT549(乳腺癌细胞)、HCT15(肠癌细胞)和PC3(膀胱癌细胞)有抑制作用;Kuochiang等[4]从金枪鱼褐色肉副产物的酶解产物中分离出2种肽(11肽和12肽),细胞试验结果表明,这两种肽对MCF-7(乳腺癌细胞)具有显著的抑制作用。前人对鲣鱼的研究主要集中在其营养成分分析[5]、罐头加工技术[6-7]、罐头加工副产物利用技术等方面[8-9]。【本研究切入点】海洋生物长期生长在高压、高盐、缺氧等特殊环境条件下,形成了许多独特的化学成分,展现了各种生物活性,被人们广泛认为是开发功能食品和药物的宝贵资源。食源性海洋生物活性肽不仅具有一定的生物活性,而且具有分子量较小、易被人体吸收、生物利用率高、没有过敏源等优点,作为功能性食品配料具有巨大的潜力。海洋动物蛋白源活性肽具有降血压、抗菌、抗氧化、抗炎、增强机体免疫调节功能、抗凝血等多种生物活性,已受到人们广泛关注[10-13]。前人报道了鳕鱼与金枪鱼蛋白酶法制备的活性肽均具有抗肿瘤活性。扁舵鲣鱼属于金枪鱼科,蛋白质是其最主要的成分,但以鲣鱼为原料酶法制备的低聚肽抗肿瘤作用尚未有报道。【拟解决的关键问题】本研究首先采用生物酶解技术对扁舵鲣鱼蛋白进行水解制备低聚肽,对其氨基酸组成及矿物质进行分析,并测定其分子量分布,然后采用细胞培养实验研究其对3种人体肝肿瘤细胞(HepG2、BEL-7402和SMMC-7721)的抑制作用,旨在为扁舵鲣鱼低聚肽开发抗肿瘤辅疗食品提供技术依据,研究结果对于促进扁舵鲣鱼资源的深度开发与利用具有重要意义。
1 材料与方法
1.1 试验材料
扁舵鲣鱼(Auxis thazard),体长50~60 cm,2017年12月购买于广东省茂名市博贺港,置于-20℃超低温冰箱备用;HepG2、BEL-7402与SMMC-7721 3种人体肝肿瘤细胞株由中山大学肿瘤中心提供。
试验主要试剂:顺铂注射液购买于江苏豪森药业集团有限公司;动物蛋白水解酶(14.5万U/g)、风味酶(14万U/g)购买于南宁庞博生物工程有限公司;DMEM培养液、胎牛血清均为赛默飞世尔公司产品;噻唑蓝(MTT)购于安倍医疗器械贸易(上海)有限公司;DMSO购买于天津市富宇精细化工有限公司;青霉素、链霉素、0.25%Trypsin-EDTA 、磷酸缓冲液(PBS)由北京鼎国昌盛生物技术有限公司提供。
试验主要仪器设备:原子吸收光谱仪(Thermo M,德国Thermo公司)、紫外分光光度计(UV-2450型,日本岛津公司)、喷雾干燥器(OMLG-25,上海欧蒙实业有限公司)、立式压力蒸汽灭菌器(HHT4-LX-C50L型,北京中西远大科技有限公司)、管式离心机(GQ75B,上海章泉有限公司)、全自动凯氏定氮仪(FOSS 2300,瑞士FOSS公司)、台式高速大容量冷冻离心机(艾德本中国有限公司)、荧光倒置显微镜(CKX41,日本奥林巴斯公司)、CO2培养箱(CCL-170B-8,新加坡ESCO公司)、台式低速离心机(TDZ5-WS,湖南沪康离心机有限公司)、高效液相色谱仪(LC-20AT,美国Waters公司)、全波长酶标仪(Multiskan GO,Thermo Fisher Scientific公司)、电子分析天平(BS224S,德国Sartouius公司)。
1.2 试验方法
1.2.1 扁舵鲣鱼低聚肽的制备 扁舵鲣鱼去头、去骨与内脏,清洗、匀浆,然后在50 ℃条件下,添加动物蛋白水解酶0.5%和风味酶0.1%,调节pH至7.5,酶解3 h,在90~100 ℃条件下加热10 min进行灭酶,在4 000 r/min条件下离心15 min,上清液通过管式离心机(15 000 r/min)脱油,在脱油后的酶解液中添加珍珠岩进行脱色脱苦,珍珠岩添加量为3 g/100 L,静置0.5~1.0 h,澄清液通过陶瓷膜(孔径200 nm)过滤,然后使用截留分子量为5 000 u的超滤膜进行分离,过滤液经旋转蒸发仪浓缩后,进行喷雾干燥,喷雾干燥进口温度为175℃,出口温度为210℃,得到的低聚肽粉置于4℃的干燥器内保存备用[14]。
1.2.2 扁舵鲣鱼低聚肽分子量分布的测定 委托江南大学分析测试中心采用HPLC方法对扁舵鲣鱼低聚肽分子量分布进行测定分析,具体方法参考GB/T 22492-2008。
1.2.3 扁舵鲣鱼低聚肽营养成分与微量成分的测定 游离氨基酸参考GB/T 5009.124-2003测定;半胱氨酸、色氨酸含量按照GB/T 15400-1994测定;钙含量参考GB/T 5009.92-2003测定;钾与钠含量按照GB/T 5009.91-2003测定;硒含量按照GB 5009.93-2010测定;锌含量按照GB/T 5009.14-2003测定;能量按照GB/Z 21922-2008测定;蛋白质含量采用自动微量凯氏定氮法测定,具体参照GB 5009.5-2010;粗脂肪含量采用索氏抽提法测定,具体参照GB/T 5009.6-2003;碳水化合物含量参照GB/Z 21922-2008测定;低聚肽含量采用高效液相色谱法测定,具体参照GB/T 22729-2008/6.3;灰分含量采用高温灰化法测定,具体参照GB 5009.4-2010;铅含量参照GB 5009.12-2010测定;无机砷参照GB/T 5009.11-2003测定;甲基汞含量参照GB/T 5009.17-2003测定。
1.2.4 肝癌细胞的培养 HepG2、BEL-7402与SMMC-7721肝癌细胞培养于37℃、5%二氧化碳的环境中。于培养瓶中加入DMEM完全培养液,待细胞长至80%~90%汇合时,弃去原培养液,PBS漂洗后,弃 PBS,加入 0.25%胰蛋白酶(含EDTA)消化细胞,加适量 DMEM完全培养液终止消化,800~1 000 r/min 离心 5~10 min 后弃上清,加入适量 DMEM完全培养液,吹打细胞,轻轻混匀,按适当比例接种到培养瓶。对传代细胞观察3 d。期间每天检查细胞1次,细胞未见异常,培养液未见异常,该株细胞纳入实验。
1.2.5 扁舵鲣鱼低聚肽对肝癌细胞的抑制作用 扁舵鲣鱼低聚肽对人体3种肝癌细胞的抑制作用委托广东省实验动物医学中心测定。扁舵鲣鱼低聚肽对肝癌细胞抑制作用研究的样品添加情况如表1所示。采用DMEM完全培养液分别培养HepG2、BEL-7402与SMMC-7721细胞,当细胞达到其对数生长期末细胞趋于融合时,用0.25%胰蛋白酶(含EDTA)消化细胞,HepG2、BEL-7402与SMMC-7721细胞分别用DMEM完全培养液制成3×104、3×104、4×104个/mL的细胞悬液,3种肝癌细胞接入量每孔分别为3 000、3 000、4 000个;将细胞悬液接种于96孔培养板中,每组设3孔,每孔100 μL,置37℃、5% CO2培养箱中培养24 h,弃去原培养液,分别加入不同浓度的样品、不同浓度的样品+顺铂注射液、顺铂注射液和培养液,每孔200 μL(表1),置CO2培养箱中培养48 h后在显微镜(100 ×)下观察细胞形态;弃去孔内液体,每孔加入5 mg/mL MTT溶液20 μL,继续培养4 h后去上清液,每孔加入DMSO 150 μL,振荡,甲瓒溶解均匀后,用酶标仪测定每孔的吸光度,测定波长为570 nm。供试品对3种人体肝肿瘤细胞的抑制率按下列公式进行计算。

1.4 数据分析
试验各处理重复3次,数据使用SPSS19.0和 Excel 2013进行显著性分析和数据处理,用Origin8.5进行绘图。
2 结果与分析
2.1 扁舵鲣鱼低聚肽分子量分布
生物活性肽的活性大小与其分子量紧密相关,分子量低于5 000 u的肽,尤其是二肽与三肽具有高的生物活性[15]。从表2可知,扁舵鲣鱼低聚肽分子量集中在1 000 u以下的组分,占比89.79%。其中分子量1 000~500 u的组分占比22.22%,分子量500~180 u的组分占比45.77%,分子量小于180 u的组分占例21.80%。分子量500~180 u的组分占比最大,其数均分子量和重均分子量分别为245 u和267 u。结果表明,扁舵鲣鱼低聚肽主要是小分子肽,分子量180~1 000 u的肽占比67.99%,二肽与三肽占总肽的45.77%。

表1 96孔培养板各处理加样情况Table 1 The scheme of adding samples to 96-well plates

表2 扁舵鲣鱼低聚肽分子量分布Table 2 Molecular weight distribution of Auxis thazard oligopeptide
2.2 扁舵鲣鱼低聚肽氨基酸组成与含量
生物活性肽的活性大小不仅与其分子量有关,而且与其氨基酸组成也有紧密关系[16]。表3显示,扁舵鲣鱼低聚肽中,氨基酸含量高达95.91%,人体所需的8种/9种必需氨基酸组成均衡,尤其是谷物中缺乏的赖氨酸含量高,达到每100 g 含10.61 g赖氨酸,因此扁舵鲣鱼低聚肽是人体良好的蛋白质来源。组成扁舵鲣鱼低聚肽的氨基酸中,与免疫调节活性及抗氧化活性紧密相关的谷氨酸、赖氨酸、天冬氨酸、亮氨酸、精氨酸含量都高,5种氨基酸占总氨基酸的52.41%[17]。
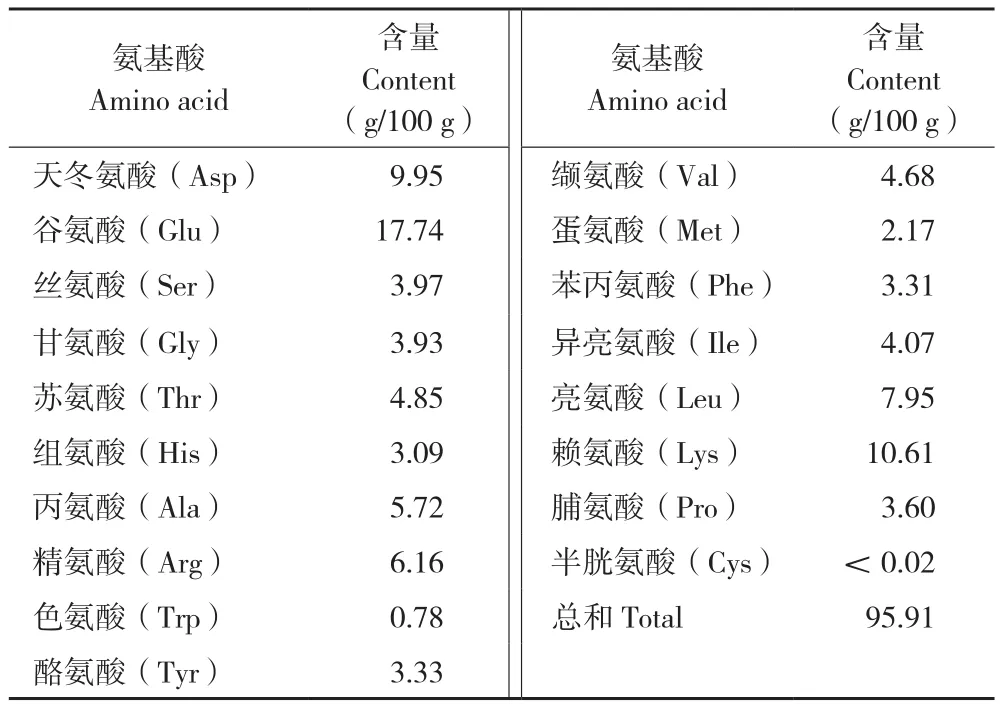
表3 扁舵鲣鱼低聚肽粉中氨基酸的含量Table 3 Contents of amino acids in Auxis thazard oligopeptide
2.3 扁舵鲣鱼低聚肽营养成分与微量成分的含量
扁舵鲣鱼低聚肽基本营养成分如表4所示,主要成分为蛋白质,占总干重的88.90%,每100 g能量为1 567 kJ/100 g,含低聚肽量71.96 g、灰分4.8 g,是一种典型的高蛋白、低脂肪食品配料。扁舵鲣鱼低聚肽矿物质含量丰富,尤其是硒与锌2种微量元素含量高。《中国居民膳食营养素参考摄入量》中规定成人硒推荐摄入量每天为50 μg,而国际营养科学会推荐富硒食品每 100 g中含硒 0.04~0.15 mg[18]。每 100 g扁舵鲣鱼低聚肽中含硒2.84 mg,可以作为人体摄入硒元素的良好来源。《中国居民膳食营养素参考摄入量》中规定成人锌的每天生理需要量男性平均为1.0 mg,女性为0.7 mg[19]。每100 g扁舵鲣鱼低聚肽中锌含量为10.1 mg,是人体摄入锌的良好来源。其他有害元素(铅、砷、汞、镉)均小于0.1%,符合国家相关食品标准。

表4 扁舵鲣鱼低聚肽(每100 g)中的营养成分和微量元素含量Table 4 Contents of nutrients and trace elements in Auxis thazard oligopeptide (per 100 g)
2.4 扁舵鲣鱼低聚肽对3种人体肝癌细胞的抑制作用
前人研究表明,HepG2、BEL-7402和SMMC-7721这3种肝癌细胞是研究肝癌细胞抑制作用的最常用类型[20-21]。为了考察扁舵鲣鱼对HepG2、BEL-7402与SMMC-7721肝癌细胞的抑制作用,运用96孔板对肝癌细胞进行培养,将试验分为9个处理,阴性对照,阳性对照(添加10 μg/mL顺铂注射液),顺铂给药处理(添加0.5 μg/mL),扁舵鲣鱼低聚肽高、中、低剂量处理以及与顺铂联合给药的高、中、低剂量处理,培养48 h,采用荧光倒置显微镜观察 3种肝癌细胞的形态,采用MTT法检测每孔吸光度,计算肿瘤抑制率,结果分别如图1、图2、图3所示。 从图1(A)可以看出,与阴性对照比较,其余各处理细胞数都有不同程度减少,其中阳性对照、扁舵鲣鱼低聚肽高剂量处理、扁舵鲣鱼低聚肽高剂量与顺铂联合给药处理细胞数最少,说明这3个处理添加物对HepG2细胞的抑制效果显著;从图1(B)可以看出,与阴性对照比较,阳性对照、扁舵鲣鱼低聚肽高剂量处理、扁舵鲣鱼低聚肽高剂量与顺铂联合给药处理细胞抑制率极显著增高, 除扁舵鲣鱼低聚肽低剂量处理外,其余各处理细胞抑制率也显著增高。上述结果表明,扁舵鲣鱼低聚肽对HepG2具有显著抑制作用(IC50为10.243 mg/mL),其抑制效应具有剂量关系;扁舵鲣鱼低聚肽联合顺铂给药处理虽然IC50(6.815 mg/mL)有所下降,但没有展现出明显的增敏效应。图2(A)与图1(A)、图2(B)与图1(B)展现了相似的规律,说明扁舵鲣鱼低聚肽对BEL-7402细胞也具有显著的抑制作用(IC506.042 mg/mL),且具有剂量关系,其抑制效果较阳性对照差,但高剂量处理较顺铂注射液处理好,联合顺铂给药也没有展现出增敏效应。图3(A)与图1(A)、图2(A)也展现了类似规律,说明扁舵鲣鱼低聚肽对SMMC-7721细胞也具有显著抑制作用(IC508.432 mg/mL),并且具有剂量关系,其抑制效果较阳性对照差,但均较顺铂注射液处理好,联合顺铂给药也没有展现出增敏效应。
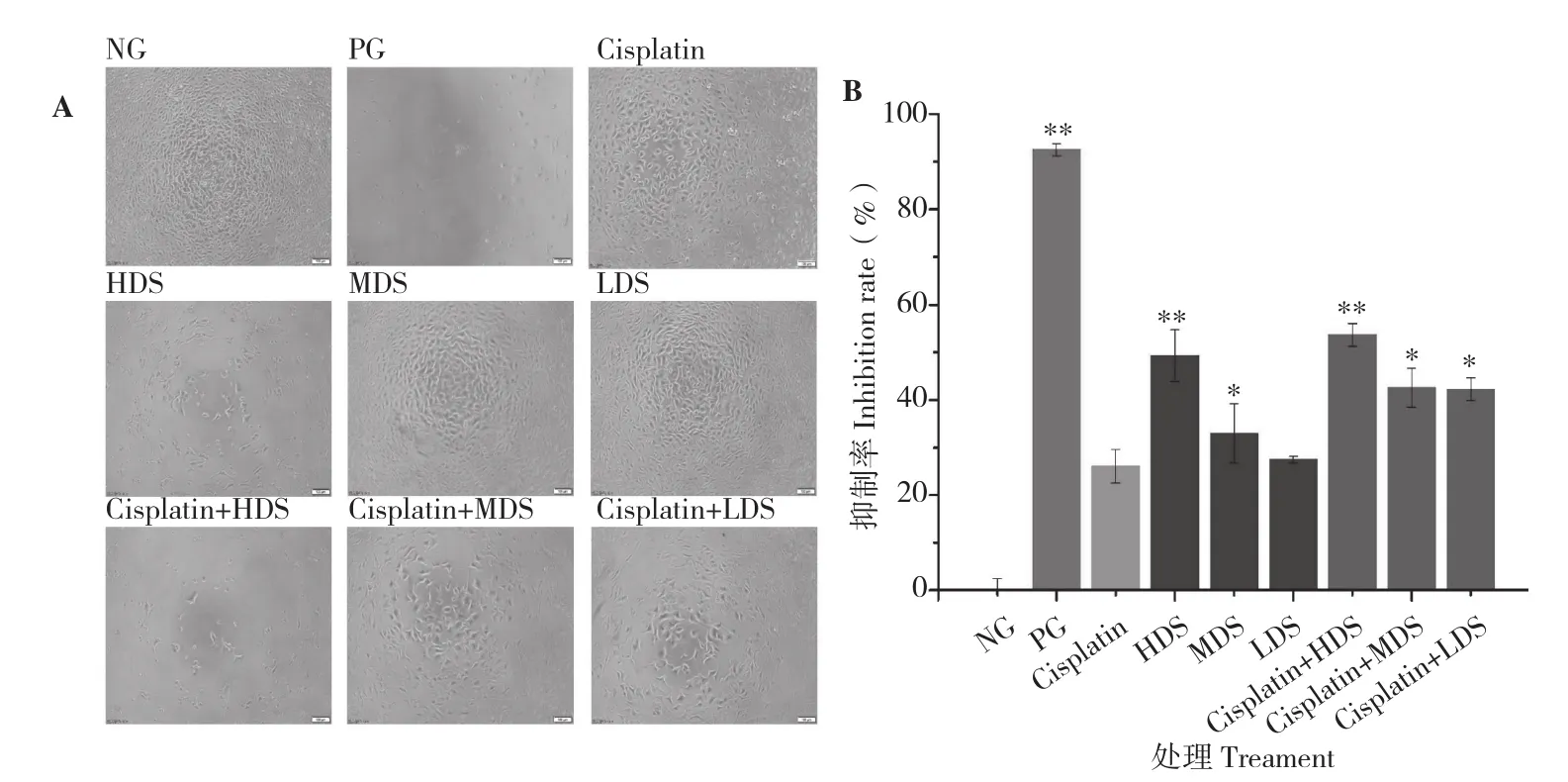
图1 扁舵鲣鱼低聚肽对人肝癌细胞HepG2生长的抑制作用Fig.1 Inhibitory effect of Auxis thazard oligopeptide on the growth of human hepatocellular carcinoma cell HepG2

图2 扁舵鲣鱼低聚肽对人肝癌细胞BEL-7402生长的抑制作用Fig.2 Inhibitory effect of Auxis thazard oligopeptide on the growth of human hepatocellular carcinoma cell BEL-7402
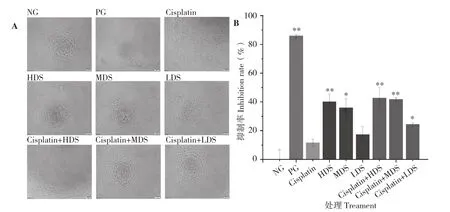
图3 扁舵鲣鱼低聚肽对人肝癌细胞SMMC-7721生长的抑制作用Fig.3 Inhibitory effect of Auxis thazard oligopeptide on the growth of human hepatocellular carcinoma cell SMMC-7721
3 讨论
国内外研究发现,生物活性肽的活性高低不仅与其氨基酸组成和排列顺序相关,而且与分子量大小关系密切,不同分子量的肽展现出不同的生物活性,具有较高活性的肽主要集中在3 000 u以下[22-24]。Abdul等[15]从鳗鱼蛋白水解物中提取多肽,研究表明,抗癌活性和抗氧化活性较高时,肽的分子量范围在3 000~5 000 u之间。Stuknyte等[25]从牛乳乳酸菌发酵液中分离出不同组分的多肽,其中小于3 000 u的分子量组分能显著降低Caco-2细胞中NF-kB因子的活性,免疫调节功能较强。低聚肽一般由2~20个氨基酸组成,具有抗癌活性的肽国内外报道文献较多,但对于抗肿瘤肽的活性与其氨基酸组成之间的关系鲜见报道。活性肽参与抗氧化、增强免疫、抗扩散、抗微管蛋白和细胞毒活性等各种生理功能,这些活性可能赋予其具有抗癌的潜力[26]。Udenigwe等[16]报道,组氨酸、半胱氨酸、脯氨酸、蛋氨酸和芳香氨基酸具有良好的清除自由基能力。张英等[17]报道,亮氨酸、谷氨酸、精氨酸和蛋氨酸具有较强的清除O2-和OH-活力的能力,是调节免疫活性的功能性氨基酸。
海洋动物蛋白水解物或肽的抗癌活性随原料来源、酶解条件、供试肿瘤细胞不同而异。Picot等[27]报道,分子量小于7 000 u的蓝鳕、三头鳕与鲑鱼酶解产物对MCF-7/6和MDA-MB-231细胞均具有显著的抑制作用;Aleman等[28]报道,珍宝乌贼皮胶原的酶解产物对MCF-7和U87细胞具有抑制作用,其IC50分别为0.13、0.10 mg/mL;Naqash等[29]报道,日本无患子和飞鱼的酶解产物对HepG2细胞均具有显著的抑制效果,其抑制率分别为48.5 mg/mL和21.6 mg/mL。扁舵鲣鱼低聚肽分子量集中在3 000 u以下,对HepG2、BEL-7402与SMMC-7721肝癌细胞均具有抑制作用,说明其抗肝癌具有广谱性,展现了抗肝癌的巨大潜力,对3种肝癌细胞的IC50值分别为10.243、6.042、8.432 mg/mL,均较文献[29]报道的IC50值小。
目前测定海洋动物蛋白肽抗癌活性的方法主要有体外和体内两种,体外方法主要采用细胞培养试验,具有简单、快速等优点,但与体内结果差异较大。体内主要通过动物实验来评价,结果可靠,但费用高、时间周期长。目前文献报道抗癌肽的活性大多采用细胞培养试验进行测定,采用的样品大多都是肽混合物,对于其抗癌作用机制研究甚少。本研究通过细胞培养试验证实了扁舵鲣鱼低聚肽对3种肝癌细胞均有显著抑制作用,但其体内抗癌活性以及抗癌肽结构的阐明与作用机制尚需进一步研究。
4 结论
扁舵鲣鱼蛋白采用复合酶水解与膜分离技术相结合制备的低聚肽主要是小分子肽,其中分子量1 000 u以下的占67.99%,分子量180~500 u的二肽与三肽占45.77%;人体所需的8种/9种必需氨基酸组成均衡,与免疫调节活性及抗氧化活性紧密相关的5种氨基酸含量丰富、占52.41%;硒和锌含量高。细胞培养试验结果表明,扁舵鲣鱼低聚肽对3种人体肝肿瘤细胞(HepG2、BEL-7402与SMMC-7721)均具有显著抑制作用,并具有剂量效应。本研究结果为扁舵鲣鱼低聚肽开发抗肿瘤辅疗食品提供了技术依据,对于促进扁舵鲣鱼资源的深度开发与利用具有重要意义,但其体内抗癌活性与作用机制尚需进一步研究。
