纳米金刚石材料的研究进展
2019-12-23姚凯丽乔鹏飞谭小俊舒国阳韩杰才朱嘉琦
姚凯丽,代 兵,乔鹏飞,谭小俊,舒国阳,杨 磊,刘 康,韩杰才,朱嘉琦
(哈尔滨工业大学, 哈尔滨 150001)
1 引 言
金刚石拥有最大杨氏模量、硬度,极高的化学惰性,其热导率在自然界中也位居前列,可达2000 W/(m·K);金刚石还拥有较宽的光学透过波段以及较宽的禁带,是第三代宽禁带半导体的代表材料[1-2]。金刚石的诸多优异性能使其成为切削加工、高频通信、航空航天等尖端技术领域不可或缺的材料。纳米金刚石作为金刚石材料的一个重要类别,除具有金刚石材料本身的优异属性之外,还具备由表面效应和小尺寸效应带来的纳米尺度下的特殊性质,如较大的比表面积、较高的场发射性质、较好的表面修饰性能以及生物相容性等[3]。纳米金刚石材料按照其形貌特点可分为纳米金刚石颗粒、薄膜以及近年来兴起的金刚石纳米片和金刚石纳米线材料,各类纳米金刚石材料表面形貌如图1所示。通常将晶粒尺寸小于100 nm的金刚石材料定义为纳米金刚石材料,尺寸在2~10 nm的金刚石定义为超纳米晶金刚石[4]。具有特殊形态的纳米金刚石材料有助于特殊性能的发挥,具有不同的应用优势。本文首先介绍纳米金刚石颗粒、薄膜、金刚石纳米片及纳米线的制备方法,其次阐述不同结构纳米金刚石的特殊性质,主要包括光电特性、力学特性等,最后介绍各种纳米金刚石材料热门的应用领域,包括光学窗口、生物医疗、量子通信、场发射电极、探测器电极、超级电容器电极等。

图1 纳米金刚石颗粒透射图(a)[5],纳米金刚石薄膜(b)[6]、纳米线(c)[7]、纳米片(d)[8]的表面形貌图Fig.1 TEM image of nano-diamond particles(a)[5], SEM images of nano-diamond film(b)[6], diamond nanowires(c)[7] and diamond nanoplates(d)[8]
2 纳米金刚石材料的制备方法
2.1 纳米金刚石颗粒的制备
纳米金刚石颗粒是一种热导率高、比表面积大、生物相容性好的重要功能材料,其在精密加工、润滑材料制备、生物医疗等领域具有极高的应用价值[9-10]。目前主要的合成方法包括高温高压法、爆轰法、破碎法、激光冲击法;其他制备方法,如催化还原法、等离子体电解法、化学气相沉积法等也有一些研究。
2.1.1 高温高压法
高温高压法主要是一种将石墨粉在准静水压及高温作用下转变为金刚石颗粒的方法。该方法通常使用过渡金属,如Fe、Ni等作为触媒,加速石墨相到金刚石相的转变;或者采用三亚甲基三硝胺、三硝基甲苯等物质通过爆炸产生压强去冲击石墨粉,使其转化为金刚石颗粒。高温高压法可以可控制备不同晶粒尺寸、不同形貌及质量的金刚石颗粒,是发展最久、使用最普遍的金刚石颗粒制备方法[11]。上世纪六十年代,Bundy等人首次使用该方法制备了立方金刚石颗粒[12]。该方法最初主要用来制备微米级、工业用磨料级金刚石颗粒,直到二十一世纪初,Dubrovinskaia等利用该方法合成了尺寸小于10 nm的纳米金刚石聚晶[13]。但是该方法反应条件苛刻,所需压强(超过104个大气压)和温度(超过1200 ℃)过高,且器材繁琐、生产成本过高、安全系数低。
2.1.2 爆轰法
爆轰法是一种通过炸药爆炸瞬间产生的高温(高于3000 ℃)、高压(大于20 GPa),将炸药中的碳元素直接合成为纳米金刚石颗粒的方法[14-15]。该方法合成的纳米金刚石颗粒杂质较多,需要经过筛选、提纯去除非碳物质,再用强酸清洗去除产物中的非晶碳杂质,然后用清水冲洗纳米金刚石颗粒,最后进行烘干才可以得到较纯净的纳米金刚石颗粒。爆轰法得到的纳米金刚石尺寸较小,一般集中在2~10 nm,纯度为95%左右[10]。俄罗斯科学院普通物理研究所、美国阿贡国家实验室、海军研究实验室等较早地开展了爆轰法合成纳米金刚石颗粒的研究。现在我国爆轰法制备的纳米金刚石颗粒产品质量已接近国际先进水平。爆轰法制备纳米金刚石颗粒的设备较简单,但反应条件剧烈、产物纯化步骤繁琐。利用爆轰法得到的纳米金刚石颗粒大部分是团聚的,形式包括软团聚和硬团聚。在纳米金刚石颗粒之间存在着范德华力,由于纳米金刚石尺寸较小质量较轻,导致颗粒之间的范德华力大于其本身重量,颗粒之间相互吸引从而形成团聚,这种团聚被称为软团聚,键能作用力小,可通过机械粉碎分散。而在纳米金刚石形成过程或在酸洗、烘干等过程中,由于吸附在纳米金刚石表面的官能团相互反应而在纳米金刚石颗粒表面形成化学键,由化学键形成的团聚被称为硬团聚,作用力较大,暂无有效分散方法[16]。
2.1.3 破碎法
破碎法又称为高能球磨法,是一种通过研磨、振动等方式将块体金刚石破碎成纳米金刚石颗粒的方法[17]。常用的设备是球磨机,通过使用不同的球磨介质、控制磨料比以及其他实验参数即可获得不同尺寸的纳米金刚石颗粒。该方法操作简单、条件温和、常用于金刚石颗粒的工业化生产。但该方法合成的纳米金刚石颗粒尺寸差异较大,且容易团聚,需要进行特殊处理,如利用超声,来分散球磨后的纳米金刚石颗粒;并且由于金刚石材料具有极高的硬度及耐磨性,导致设备零件及球磨介质极易受到损坏,不仅削弱了纳米金刚石颗粒的分散效果,还会导致分散后的颗粒中杂质含量过高。
2.1.4 激光冲击法
激光冲击法是一种利用高功率激光冲击石墨等碳材料合成纳米金刚石颗粒的方法[18]。激光具有极高的能量密度,可以使受冲击的材料在极短的时间内温度急剧上升,从而发生相变。该方法于上世纪八十年代兴起,逐渐被用于合成纳米金刚石颗粒。该方法中,碳源的选择比较宽泛,气态、液态或固态的含碳材料均可作为碳源材料。常用的激光器有ArF准分子激光器、KrF准分子激光器、二氧化碳(CO2)激光器[19-21]。1990年,Buerki等利用CO2准分子激光辐照乙稀气体成功制备纳米金刚石颗粒[22]。近年来,我国王金斌等利用该方法以固态碳材料为碳源制备出了纳米金刚石颗粒[23],除此之外国内以激光冲击法制备纳米金刚石颗粒的代表单位还有天津大学[24]、江苏大学[25]等。

表1 纳米金刚石颗粒制备方法对比Table 1 Comparation of the preparation methods for nano-diamond particles
2.1.5 其他方法
近年来,关于纳米金刚石颗粒新的制备方法不断涌现,比如催化还原法、等离子体电解法、化学气相沉积法等。首先,催化还原法,顾名思义是利用催化剂加速化学反应发生来制备金刚石颗粒。山东大学钱逸泰院士课题组以四氯化碳为碳源,以镍钴合金做催化剂,以钠为还原剂,以高压反应釜为容器,合成了纳米金刚石团聚体[26];大连理工大学李廷举教授课题组以炭黑为碳源,以纳米铁做催化剂,合成了纳米金刚石粉[27]。华南理工大学陈砺教授课题组尝试了利用等离子体电解技术,在多种醇混合溶液中制备纳米金刚石颗粒,但该方法得到的金刚石颗粒晶形不完整,且产率较低[28]。化学气相沉积法是常用的制备金刚石薄膜的方法[29-31],但有关化学气相沉积法制备金刚石颗粒的文章也有一些报道。上海交通大学孙方宏教授课题组采用化学气相沉积法在有单晶金刚石种子的硅片上制备了最小尺寸为2 μm的单晶微粒[32]。哈尔滨工业大学朱嘉琦教授课题组采用化学气相沉积技术,创新地以石墨为碳源和衬底,制备了自支撑、易分散、高品质的金刚石颗粒[33-34]。现在化学气相沉积法主要用于制备微米金刚石颗粒,但相信使用该方法并添加不同的反应气体种类,可制备出具有不同晶粒尺寸的微米及纳米金刚石颗粒。利用化学气相沉积法得到的金刚石颗粒与通过其他方法得到的金刚石颗粒相比,具有更高的晶体质量和更明显的晶体形貌,更适合于高精密器件的抛光加工。纳米金刚石颗粒制备方法的特点总结见表1。
2.2 纳米金刚石薄膜的制备
纳米(超纳米)金刚石薄膜的制备方法比较单一,主要采用化学气相沉积法。该方法基于CH4、H2和Ar或者N2(碳源还可以是CO、CO2、乙醇、石墨和其它的碳氢化合物)等混合物的分解,分解产物沉积在衬底表面,作为生长金刚石的前驱体[1-2]。经过多年的发展,制备纳米金刚石薄膜常用的方法有热丝化学气相沉积法、氧乙炔燃烧火焰合成法、直流电弧放电等离子体沉积法、激光等离子体合成法、微波等离子体化学气相沉积法等。
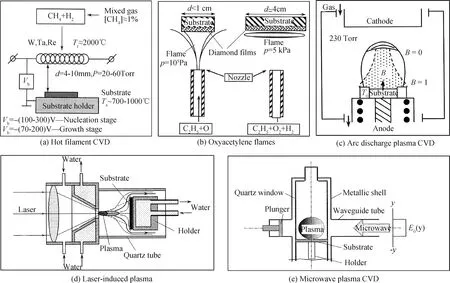
图2 纳米金刚石薄膜制备方法示意图:(a)热丝化学气相沉积法制备纳米金刚石薄膜示意图,Tr-热丝温度,Vb-偏压,Ts-衬底温度[35];(b)氧乙炔混合气体燃烧火焰合成纳米金刚石薄膜示意图[38];(c)直流电弧放电等离子体法沉积纳米金刚石薄膜示意图[42];(d)激光等离子体合成纳米金刚石薄膜示意图[45];(e)微波等离子体化学气相沉积法合成纳米金刚石薄膜设备示意图[49]Fig.2 Schematics of nano-diamond film preparation methods: (a)hot filament chemical vapor deposition, Tr-filament temperature, Vb- bias voltage, Ts-substrate temperature[35]; (b)oxyacetylene flames[38]; (c)arc discharge plasma chemical vapor deposition[42]; (d)laser-induced plasma[45]; (e)microwave plasma chemical vapor deposition[49]
2.2.1 热丝化学气相沉积法
热丝化学气相沉积法是将可加热至2000~2400 ℃的耐高温材料制成的灯丝,放置在用于生长金刚石膜的衬底上方,衬底温度通常保持700~1000 ℃,热丝法制备金刚石示意图如图2(a)所示[35]。热丝法是较早发展起来的化学气相沉积法,1982年Matsumoto发表了使用热丝法制备金刚石的文章,之后这种方法逐渐被人所熟知[36]。利用该方法制备纳米金刚石薄膜与制备微米金刚石薄膜或块体金刚石材料的区别在于反应气体的种类。制备纳米金刚石薄膜需要使用CH4-H2-Ar或CH4-H2-N2混合气体,而制备其他金刚石材料常使用CH4-H2两种气体[37]。热丝法操作简单、且热丝数量可控;但是该方法不能防止金属杂质(通常是热丝的材料钨)进入薄膜,导致金刚石纯度较低,而且不能在气体混合物中添加能与热丝材料发生反应的气体,比如O2。因此热丝法制备的金刚石薄膜质量较差,不能用作光学和电子材料。
2.2.2 氧乙炔燃烧火焰合成法
氧乙炔混合气体燃烧产生火焰也可以用来制备纳米金刚石薄膜,合成过程示意图如图2(b)所示[38]。该方法可得到较高的原子团浓度,且金刚石生长速率较快。Sabitov等利用该方法在铜膜表面制备了金刚石薄膜,并通过改变氧气含量及反应时间分别得到了微米和纳米尺寸的金刚石[39]。但该方法沉积范围不均匀,且沉积面积较小,需要通过改变火焰配置来扩大沉积尺寸[40]。在有保护气体(用来防止氮扩散到衬底)的情况下,该方法可获得大面积的金刚石薄膜,但代价是沉积速率降低,质量并未有显著改善。除此之外该方法所需的沉积温度过高(高于1100 ℃),导致衬底材料的选择受到限制。
2.2.3 直流电弧放电等离子体沉积法
直流电弧放电等离子体沉积法可以快速制备金刚石薄膜,其示意图如图2(c)所示。除此之外,该方法操作简单、气体用量小,但是薄膜会受到电极表面溅射出的原子的污染[41]。使用多阴极系统可以使衬底直径扩大到100 mm,有利于纳米金刚石薄膜的制备,且可避免出现局部放电现象[42]。总的来说,与其他金刚石合成方法相比,直流电弧放电等离子体沉积法沉积金刚石速率相对较快。利用Ar作为等离子体发生气体,并混入CH4和H2,也可以用乙醇蒸汽代替CH4,可快速制备出纳米金刚石薄膜。同时可通过提高发生器的功率来增加沉积面积,降低成本,现已制备出功率为100 kW等离子体发生器[43]。
2.2.4 激光等离子体合成法
激光等离子体合成法是一种较新的金刚石薄膜制备方法,设备构造如图2(d)所示[44]。其工作原理是在连续的激光辐射产生光放电等离子体将气体加热分解,产生合成金刚石的前驱体。Konov等采用CO2激光在Xe(Ar)-CH4-H2混合气体中制备了纳米级金刚石薄膜,证实了该方法的可行性[45]。该方法制备纳米金刚石薄膜的优势在于:可以在1个大气压或更高气压下放电;高密度活跃分子与气体中高密度释放的激光能量相结合,有效提高金刚石薄膜沉积速率;原则上借助气体防护可以无需反应室进行沉积。该工艺的缺点是金刚石膜十分不均匀,沉积面积小,10 kW级及以上功率的CO2激光器造价高昂。因此该方法的研究相对较少,主要研究单位是俄罗斯科学院普通物理研究所[45]。
2.2.5 微波等离子体化学气相沉积法
微波等离子体化学气相沉积法是现阶段最常用的纳米金刚石薄膜制备方法,最初简易的微波等离子体化学气相沉积设备示意图如图2(e)所示。该方法以等离子体高度积聚、沉积速率快和沉积面积大(几十cm2)而深受欢迎。这种微波激发的等离子体相对纯净,不含电极溅射物,产物中杂质少,可以获得光学级甚至电子级的高纯度多晶纳米金刚石薄膜及高品质单晶金刚石[46-48]。利用该方法制备纳米金刚石薄膜主要的气体原料为N2/Ar-CH4-H2混合气体。
2.3 金刚石纳米片、纳米线的制备
除了常规纳米金刚石薄膜外,具有特殊结构的纳米片状金刚石薄膜也吸引了科研人员的关注,制备方法主要以微波等离子体化学气相沉积为主,反应气体主要是高浓度的CH4和H2。Chen等利用微波等离子体化学气相沉积法,在CH4与H2比例为3∶1的条件下制备了形状规则、缺陷密度低的纳米片状单晶金刚石,证实了制备特定纳米结构的单晶金刚石是可行的[8,50-51]。Lu等利用微波等离子体化学气相沉积法,在CH4与H2比例为0.667∶1的条件下制备了规则六边形的金刚石纳米片,晶向主要包括(110)和(111)[52]。姚宁等同样采用微波等离子体化学气相沉积设备,在CH4与H2比例为1∶1的条件下制备了纳米片状金刚石薄膜[53]。纳米片状金刚石薄膜的成功制备将有助于金刚石材料在电子、光学、机械等领域的应用。
金刚石纳米线同样是具有特殊结构的一维纳米金刚石材料。这种特殊的结构使得金刚石纳米线具有一些优于块体金刚石材料的性能,如较好的场发射性能、更大的比表面积、更好的电化学性能等[54-56]。金刚石纳米线的制备方法主要可以归结为两类,分别是自上而下(top-down),主要指反应离子刻蚀技术和自下而上(bottom-up),主要指化学气相沉积技术。
2.3.1 反应离子刻蚀技术
反应离子刻蚀技术是利用高能离子从上方冲击试样表面并发生反应,从而将样品表面构造出所需结构。利用该方法制备金刚石纳米线,通常需要外加模版,常用的模版材料有金属或氧化物。具体来讲,模板法是预先在金刚石薄膜表面沉积一层具有一定形状的金属或氧化物,如铝、镍、金、铁、氧化硅、氧化铝等,然后利用氧等离子体刻蚀样品表面,获得纳米线的微观结构[56]。这种方法可通过改变模板尺寸来可控制备不同尺寸金刚石纳米线,但是模板法也有一定的缺点,主要在后期去除模板时需反复清洗且会残留杂质,会对样品造成污染。近年来,无外加模板的反应离子刻蚀方法被开发,利用该方法已成功制备了掺硼的金刚石纳米线[57]。
2.3.2 化学气相沉积技术
另一种常用的制备方法是化学气相沉积法,反应气体主要是高浓度的N2、CH4和H2。Vlasov等就利用微波等离子体化学气相沉积法,在N2含量为25%条件下制备出了金刚石纳米线,并且检测到该纳米线被一层石墨碳包裹,这大大提高了金刚石纳米线材料的导电性,拓宽了其在电化学检测与分析领域的应用[58]。龚耀庭在N2含量为85%条件下制备了平均长度为2.5 μm的金刚石纳米线,并且获得的纳米线金刚石膜表现出半导体特性[59]。
综上,化学气相沉积法是制备纳米金刚石颗粒、薄膜、金刚石纳米片和金刚石纳米线的共同方法,只需要改变该方法的实验参数以及参与气体的种类及浓度比例,就可以可控制备纳米金刚石颗粒、薄膜、金刚石纳米片和金刚石纳米线。制备纳米金刚石颗粒及薄膜最常使用CH4、H2和Ar混合气体,并且随着氩气比例的升高,合成的金刚石晶粒尺寸越小[60]。制备金刚石纳米片及金刚石纳米线常使用CH4、H2和N2,并且CH4或N2的含量相对较高[53]。化学气相沉积法制备纳米级金刚石材料通常用自由基模型理论进行解释。CH3自由基与金刚石具有相同的sp3杂化结构,被认为金刚石生长的主要前驱体,且CH3浓度越高,金刚石的生长速率就越快[61]。碳氢自由基基团分为活性与惰性,惰性基团的键上都有原子(C或H),而活性基至少有一个键上无原子,处于悬空状态,被称为悬空键。带有活性的碳氢自由基与氢原子发生脱氢反应,再与碳氢自由基结合,不断重复反应过程,基团粒子逐渐长大到一定的尺寸形成金刚石晶核。而高浓度的碳氢自由基会改变原有晶格对称性使得局部晶核发生二次形核现象,导致晶粒尺寸减小,形成纳米级金刚石。但是现在普遍认为C2基团,而非CH3基团,是制备纳米金刚石的关键自由基。美国阿贡实验室Grune等通过计算分析出C2在(100)金刚石表面吸附不存在势垒,且形核过程不需要氢原子的参与,这会导致金刚石二次形核现象的发生[62]。
3 纳米金刚石材料的性质及应用
纳米金刚石与块体金刚石有一些共同的优异性质,如良好的耐磨性、导热性等,常被用作金属、橡胶、塑料、玻璃等材料的涂层,润滑油添加剂,精细加工研磨材料等。将纳米金刚石颗粒涂覆在材料表面,可显著改善材料的耐磨性能[63]。利用纳米金刚石颗粒对光学元件进行精细抛光,可有效降低器件表面粗糙度,最低可达0.2 nm Rmax[64]。美国斯坦福大学朱棣文团队和崔屹团队利用纳米金刚石的高机械强度和紧密结构来抑制锂电池中枝晶生长,构建稳定的金属锂界面,保证了锂电池能够稳定工作[65]。芬兰Carbodeon公司将纳米金刚石颗粒掺入到热塑材料中,从而提高热复合材料的热导率,保证材料在相对低的温度下可以稳定的工作[66]。除此之外,纳米金刚石材料还具有一些区别于以及优于块体金刚石材料的优异特性,包括光学、电学和力学等性质,使其在冷阴极场发射、电化学电极、光学窗口、量子通讯、药物输运等方面展示出良好的应用前景。纳米金刚石与微米金刚石性质对比总结见表2,文中将详细介绍纳米金刚石在各方面优异的性质及应用。

表2 纳米金刚石与微米金刚石材料性能比较[67-68]Table 2 Performance comparison of nano-diamond and micro-diamond materials[67-68]
3.1 生物相容性
纳米金刚石具有优异的生物相容性,容易进入细胞,且表面易被修饰,因此纳米金刚石可作为生物诊断探针、运载工具、基因治疗、抗病毒和抗菌治疗工具以及作为组织支架等。已有文献研究报道将纳米金刚石作为药物载体,并取得了良好的治疗效果[69]。美国西北大学Dean研究组将纳米金刚石粉用做抗肿瘤药物阿霉素的载体并进行了细胞实验,研究发现纳米金刚石粉不但可以负载阿霉素而且可以通过调节氯化钠浓度达到药物的可控释放,并且发现纳米金刚石对正常细胞没有任何副作用[70]。
3.2 光学性质
微米金刚石薄膜表面相对粗糙,将大大增加光线的散射,降低其透过性。相比之下,纳米金刚石薄膜表面相对光滑,可有效减少光线的散射,因而具有较高的实际光学应用价值。王小兵等利用微波等离子体化学气相沉积法,获得了透过率为80%的纳米金刚石薄膜[71]。并且该薄膜粗糙度仅为29.5 nm,但硬度可达到34.9 GPa,弹性模量可达到238 GPa,力学性能可媲美天然金刚石材料。Chen等利用化学气相沉积法获得了透过率为84%的纳米金刚石薄膜[72]。纳米金刚石薄膜凭借其优异的光学特性、抗划擦性能以及较大的硬度,成为制备军事光学元件的理想材料之一。国内外的研究机构和公司,比如英国 De Beers 公司、韩国科学技术研究院、德国弗劳恩霍夫研究所、北京科技大学等相继研究出了大尺寸光学级微米金刚石自支撑膜,但大面积光学级纳米金刚石自支撑膜的相关技术仍需继续开发[73]。
在金刚石内存在许多具有光学活性的缺陷,其中能够在禁带内进行电子跃迁,且跃迁时会吸收或放出光线的缺陷被称为色心。色心属于点缺陷,它可以选择吸收可见光能量并产生颜色,常见的颜色有黄色、粉色、蓝色。金刚石中的色心大致有NV色心、SiV色心、镍相关色心、铬相关色心[3,74]。色心可以存在于各种形态的金刚石材料中,如块体金刚石和纳米金刚石。随着纳米科技的进步,研究发现当纳米级别尺度的金刚石内含有色心时(又成为荧光纳米金刚石),其相比于块体金刚石材料在某些方面变得更具优势:如含有色心的纳米金刚石可以在生物方面得到应用,比如生物荧光标记[75];也可以实现纳米尺度物理量探测,保证高空间分辨[76]等。下面将分别介绍各种色心的性质。
NV 色心是目前研究最广泛的色心,由面心立方金刚石晶格中一个碳空位及邻近的碳原子被氮原子替代形成的,结构示意图如图3(a)所示[5,77]。当NV 色心含有5个电子时,其电荷状态为中性(NV0),自旋S=1/2;当结构中的电子被中性的NV色心捕获时,NV 色心含有 6个电子,表现出负电性(NV-),基态自旋 S=1。图3(b)为室温下得到的纳米金刚石NV色心系统的发光光谱[5,77]。NV0的零声子线在 575 nm(2.156 eV)处,NV-的零声子线在 637 nm(1.945 eV)处。现阶段重点研究的色心通常情况下是NV-。因此在不作特殊说明的情况下,NV色心一般指的是NV-。纳米金刚石NV色心是生物荧光标记的理想材料,与其他生物标记材料相比其性能更稳定[75]。与有机染料分子和量子点相比,纳米金刚石NV色心具有最小的吸收截面,较大的量子效率和较长的激发态寿命;最关键的是纳米金刚石NV色心荧光谱非常稳定,不受IR-UV的影响,NV色心具有最好的热稳定性。
纳米金刚石中SiV色心的形成方式与NV色心类似,都是由一个杂质原子(氮或硅)替代金刚石晶格中一个碳空位及邻近的碳原子形成的缺陷,SiV色心原子结构示意图如图3(c)所示[77]。1981年Vavilov 等首次发现了硅空位(SiV)色心的荧光,自此对SiV色心的研究逐渐展开[78]。纳米金刚石SiV色心在光学性质方面有很多优势。首先,Si在金刚石中的掺杂效率非常高,以含硅的衬底或含硅的组件制备金刚石可获得含SiV色心的纳米金刚石[79]。其次,纳米金刚石中SiV色心的零声子线在738 nm处,如图3(d)所示[77],这距离纳米金刚石本身的谱线(450~650 nm之间)较远,容易分辨。
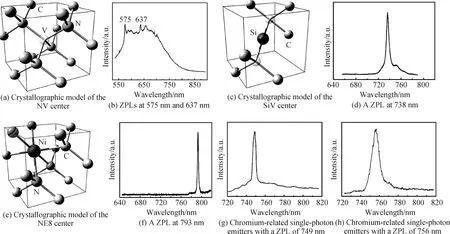
图3 各类纳米金刚石色心的结构及光致发光光谱:(a,b)NV色心原子结构示意图及其在室温下的光致发光光谱;(c,d)SiV色心原子结构示意图及其在室温下的光致发光光谱;(e,f)以NE8为例的镍相关色心原子结构及其在室温下的光致发光光谱;(g,h)含铬色心光致发光光谱[5,77]Fig.3 Crystallographic model and PL spectrum of various nanodiamond centers: (a,b)Crystallographic model and room-temperature PL spectrum of NV center; (c,d) Crystallographic model and room-temperature PL spectrum of SiV center; (e,f) Crystallographic model and room-temperature PL spectrum of NE8 center; (g,h)PL spectrum of Cr-related single-photon emitters[5,77]
金属镍常被用作合成金刚石的触媒或催化剂,因此合成的纳米金刚石中常常含有镍元素,从而形成与镍相关的缺陷。由这种缺陷形成的色心主要在883 nm和885 nm处出现发光峰。除此之外,在高氮含量的金刚石中,由镍-氮复合物(NEx,1≤x≤8)组成的家族也被观察到,以NE8为例的镍相关色心结构如图3(e)所示[77]。NE8缺陷是以镍原子为核心,周围可以连续捕获4个氮原子。NE8色心在纳米和块体金刚石材料中具有不同的零声子线位置,纳米金刚石材料中NE8发光中心在近红外范围内(零声子线在793 nm)如图3(f)所示[77],而在块体材料中NE8零声子线在802 nm。NE8中心呈现三级发射行为,其荧光量子效率估计为0.7[80]。与镍相关的色心还包括镍和硅的复合色心,但该色心激发态寿命较短(3 ns),因此研究较少[81]。
与铬相关的色心是制备金刚石单光子光源的新星,可通过化学气相沉积法获得含铬的金刚石色心。与其他纳米金刚石色心相比,新型的铬相关的色心具有显著的性能,如:近红外区窄发光,含铬纳米金刚石色心和微米金刚石色心分别在756 nm和749 nm处发光,如图3(g)~(h)所示[77]。并且在纳米金刚石中含铬色心单光子发射率最高可达3.2×106s-1,激发态寿命为~4 ns,各项指标均优于块体金刚石中的含铬色心,且具有完全偏振的激发和发射行为[82]。各种类型纳米金刚石色心的基本物理性质与块体金刚石中色心性质的对比如表3所示。最近有科研团队发现了掺入金刚石晶格中的锗原子相关色心,该色心在602 nm处发光,在向化学气相沉积金刚石和高温高压金刚石中掺入锗以及向金刚石中离子注入锗后可以被检测到[83]。
3.1小节中已经介绍了纳米金刚石具有良好的生物相容性,耐酸碱腐蚀性,易识别的拉曼信号,易与生物体结合,如与DNA、阿霉素、酶、胰岛素、细胞色素C结合等优势,相信通过对纳米金刚石色心的研究与应用,纳米金刚石材料能够成为荧光探针、生物标记、生物成像、生物载体等的良好材料。极高的应用价值使得纳米金刚石色心的研究成为现阶段针对纳米金刚石材料的研究热点之一。除了在生物领域的应用之外,纳米金刚石色心在探测微小形变方面也具有极高的应用价值。香港中文大学李泉教授课题组利用金刚石色心构建量子传感器实现材料非局部形变高精度测量,并用于研究复杂材料系统的机械响应[84]。纳米金刚石色心还具有优异的单光子性能,在量子信息处理等量子通信领域也具有极高的研究价值。Leifgen等曾利用金刚石色心单光子源搭建了室温的量子密钥测试平台,并认为SiV色心具有较大的发展潜力[85]。
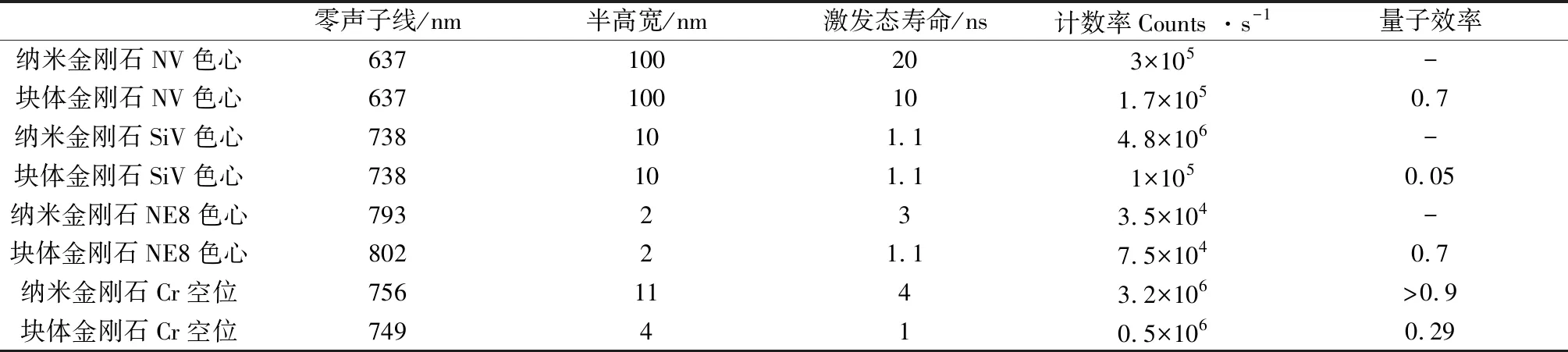
表3 各种纳米金刚石色心基本性质小结[77]Table 3 Summary of the basic properties of various nanodiamond centers[77]
3.3 电学性质
众所周知,本征的块体金刚石材料是绝缘体,不具备导电性能。当金刚石的尺度达到纳米级(包括超纳米级)时,金刚石会表现出一定的导电性。纳米金刚石的导电性主要是来自晶界中存在的导电石墨相和无定形碳相。并且纳米金刚石具有超大的比表面积,表面易吸附各种官能团,如羟基、羧基、氯酸根、硫酸根和含氨官能团等,这也可能是纳米金刚石具有导电性的另一个重要原因。纳米金刚石具有宽禁带、高迁移率等特点,是具有代表性的第三代半导体材料。
纳米金刚石还具有优异的场致电子发射特征。Yang和Chen等利用热丝CVD法,以石墨为碳源,制备了金刚石纳米薄膜及纳米线,并发现由微米金刚石薄膜到纳米金刚石薄膜,场发射性能逐渐提高[86-87]。外加电场为18 V/μm时,微米金刚石薄膜发射电流为0.5 μA,开启电场为11 V/μm;而纳米金刚石薄膜在同样外加电场条件下发射电流为21.7 μA,开启电场低至6 V/μm[87]。关于纳米金刚石的场发射性能提高的原因,最普遍的解释是纳米金刚石中存在的sp2相引进了一些悬挂键或空位等结构缺陷,这些缺陷也会在禁带中引入子能带,降低金刚石的功函数,增强场发射性能。具有特殊结构的金刚石纳米线、金刚石纳米片材料在场发射材料、阴极材料、探针材料以及生物探测器电极材料等方面显示出潜在的应用价值[88]。
纳米金刚石具有优异的电化学性能,如电势窗口宽、背景电流低、耐酸碱腐蚀、高稳定性等[89]。近年来,研究纳米金刚石电化学性能的文章层出不穷,一般都是将纳米金刚石制作成电极,研究其对物质浓度的检测[90-91]。燕山大学臧建兵教授课题组利用纳米金刚石颗粒制备微电极[92-93],发现纳米金刚石电极在氯化钠电解液中具有较大的电势窗口范围(-0.9~+1.6 V),超低的背景电流(10-8A 数量级);对亚硝酸盐物质有极高的响应灵敏度,检测限为1.2×10-4mol/L。由于纳米金刚石颗粒具有较大的吸附能力,研究者们经常对其表面进行修饰,从而提高其电化学性能。修饰物质主要分为三类,分别是表面官能团修饰、有机大分子修饰和金属及金属氧化物纳米粒子修饰。常用的表面官能团是含氧基、氨基及卤素;有机大分子修饰主要是将氨基、烷基、酰基等基团引入到纳米金刚石表面;常用作表面修饰的贵金属及金属氧化物主要包括:金、银、铂、铅、钌和二氧化钛等[94-96]。
纳米金刚石材料在电化学监测、分析方面得到了广泛的研究,在环境监测、生物诊断、食品以及发酵工业等方面具有实际的应用价值。Zhao等利用纳米金刚石颗粒修饰金电极作为葡萄糖生物探测器[97],Briones等利用纳米金刚石颗粒作为修饰电极探测乳酸含量[98]。除此之外,纳米金刚石膜由于形核密度大、晶粒尺寸小,相比于微米级金刚石薄膜表面更加光滑,因此纳米金刚石薄膜具有更好的抗污染物特性,在极端条件下使用寿命更长[99]。纳米金刚石材料在储能方面也具有极好的应用前景。德国锡根大学Jiang教授课题组将磷元素掺入纳米金刚石材料中,得到掺杂纳米金刚石材料,最大电容可达到63.56 mF/cm2,说明纳米金刚石材料有望成为新一代超级电容器的电极材料[100]。
3.4 力学性能
纳米金刚石材料的力学性能也可称为机械性能,主要包括弹性、塑性、刚度、强度、硬度等。纳米金刚石材料具有优异的力学性能。香港城市大学与美国麻省理工学院、新加坡南洋理工大学共同报道了一种具有超大弹性变形能力的单晶金刚石纳米针材料,强度达到接近其理论极限的89~98 GPa,弹性形变达到9%[101],而块体金刚石强度一般小于10 GPa,最大弹性拉伸应变小于1%[68]。强度及弹性性能的提升将有助于纳米金刚石材料应用于更多前沿领域。复旦大学梅永丰教授课题组将金刚石纳米化,从而提高了金刚石的弯折性能,增强了其柔性,实现了纳米金刚石的卷曲[102]。该性能的实现主要得益于纳米金刚石较小的尺寸及较薄的厚度,这样的力学性能提高在微米及块体金刚石中是无法实现的。
4 结 论
本文综述了纳米金刚石材料的研究进展,重点对不同结构的纳米金刚石材料,包括纳米金刚石颗粒、薄膜、纳米线和纳米片的制备和性质进行了介绍。不同形态的纳米金刚石材料制备方法也不尽相同,每种方法都各有利弊。而纳米金刚石薄膜、金刚石纳米线和纳米片均可以采用化学气相沉积法进行制备,只需要改变反应气体的种类及浓度,从而控制金刚石二次形核密度即可。纳米金刚石颗粒和薄膜为传统的纳米金刚石材料,而金刚石纳米线和金刚石纳米片的研发也为纳米金刚石行业发展注入了新的活力。纳米金刚石材料与微米、块体金刚石材料相比,由于尺寸变化而拥有更优异的生物相容性、光学透过性能、荧光色心性质、场发射性质、电化学特性以及机械性能;是制作光学窗口、生物医疗、量子通信、场发射电极、探测器电极、超级电容器电极等的热点材料,在相应领域具有极高的发展潜力。但是现阶段我们对纳米金刚石材料的研究还不够深入,大多停留在理论研究阶段,一些纳米金刚石材料关键问题仍有待突破。例如,提高纳米金刚石颗粒的纯度与产量,解决纳米金刚石颗粒的分散问题,提高产品品级,可控制备大尺寸纳米金刚石薄膜、金刚石纳米线和纳米片等。若能解决纳米金刚石材料的制备问题,降低成本、提高产量,那么纳米金刚石材料将可以在工业上得到实际应用,充分发挥纳米金刚石在研究生产中的经济效益及社会效益。
