二参汤对心力衰竭大鼠模型AngII 通路的干预与影响
2019-12-21王亚萍周丽雅
王亚萍,王 萌,周丽雅
(1.吉林工程技术师范学院校医院,长春 130000;2.长春中医药大学附属医院传统诊疗中心,长春 130022;3.长春中医药大学基础医学院,长春 130117)
近年来,大量研究证明炎性反应是导致CHF病理及生理的重要机制之一,且对于其炎症通路及炎性细胞因子的研究也成为目前的研究热点。当前各项研究证实,AngII本身是一种强大的促炎症因子,它能够激活循环中的白细胞,并通过合成黏附分子、趋化因子等参与白细胞黏附至活化的内皮细胞[1-2]。同时AngⅡ还是 RAAS系统的主要活性物质,体内的RAAS系统被激活,导致血管紧张素II(Ang II)的释放增加,激活核因子-κB(NF-κB),进一步激活 TLR4,触发细胞信号级联反应,而最终导致NF-κB 转录因子依赖的信号途径的整体激活,进而形成各种炎性因子对血管壁的浸润,使得CRP等炎性因子的过度表达,最终产生炎症反应。因此,促炎症因子AngII、核转录因子NF-κB和非特异性炎症反应物CRP的测定可以作为CHF病理、生理状态及预后评价的一种标志物。
1 实验材料与方法
1.1 实验动物 清洁级雄性Wistar大鼠160只,体质量(250±20)g,由长春中医药大学实验中心提供。
1.2 药物 1)药物二参汤:党参20 g,丹参20 g,川芎15 g,麦冬10 g,五味子10 g,木香10 g,降香10 g,薤白15 g,元胡15 g。生药由长春吉林省中医院制剂中心提供,由其中药房代煎,长春中医药大学实验研究室浓缩而成,其中药液含生药量为3. 36 g/mL,4℃冰箱保存。2)成药:缬沙坦,北京诺华制药有限公司,规格: 80 mg×7粒/盒,批号:201604。
1.3 试剂 兔抗鼠NF-κB p65单克隆抗体(C-20):ZS-372,北京中杉金桥生物技术有限公司;辣根过氧化物酶标记的山羊抗兔二抗,北京中杉金桥生物技术有限公司;CRP ELIsA试剂盒,R&D system公司;碘[125I]血管紧张素II(AII)放射免疫分析药盒,北京北方生物技术研究所。
1.4 主要仪器 旋涡混合器(上海XW-80A);超声器(MODELCV188);数显恒温水箱 (金坛HH-W-420);震荡培养箱(哈尔滨HZQ-X100);酶联免疫检测仪(上海DG5031)。
1.5 动物造模与分组 160只雄性Wistar大鼠随机分出10只为假手术组,仅穿线不结扎冠状动脉左前降支(全部存活) ;余下的150只大鼠参照文献[3-4]采用结扎冠状动脉左前降支的方法来建立急性心肌梗死大鼠模型,使用心脏彩超测定其心脏射血分数(ejection fraction, EF)<60% 为造模成功,共43只,进而值筛选出EF指数最低的30只,随机分为缬沙坦组、中药组、模型组各10只。
1.6 给药 假手术组和模型组给予灭菌蒸馏水每只2 mL/d,中药组给药量每只2.085 g/kg,缬沙坦组给药量每只20 mg/kg。1次/d,连续灌胃28 d。
1.7 观测项目
1.7.1 观测各组心肌组织形态学变化 灌胃28 d后,实验大鼠采用眼球取血法,并摘取心尖部部分心肌组织,于10% 福尔马林溶液中固定一部分心肌组织;另一部分心肌组织于-80℃冰箱低温保存。经Masson染色法处理取部分心肌组织,观测其形态学的变化。
1.7.2 检测各组心肌NF-κB的蛋白表达 采用Western blot实验检测其心肌NF-κB的蛋白表达。于实验大鼠左心室处提取50 mg心肌,同时提取总蛋白,电泳先以60 V电压开始,至溴酚蓝指示剂进入分离胶后,再将其电压调整到120 V直至电泳结束。再于100 V恒压转膜60 min,随后将膜移入含有5% 脱脂奶粉的0.1%Tween20的TBST溶液的自封袋中,在室温下于摇床内封闭l h。加一抗TLR4(1:200)、NF-κB p65(1:500),4℃冰箱过夜。次日再用TBST洗膜3次;再加入二抗(1:5000)于室温内在摇床内摇动1 h。TBST洗膜3次,将A、B发光液以1:1的比例均匀混合,1 min后将混合液滴加于膜上,并使用保鲜膜封包。于暗室内使用X光片曝光后常规方法显影、定影,随后用Image J软件分析。
1.7.3 检测各组血清中CRP的浓度 使用大鼠血清因子ELISA试剂盒,检测各实验组大鼠血清标本中CRP的浓度。
1.7.4 检测各组 AngⅡ浓度 采用放射免疫分析分析药盒测定组织、血浆AngⅡ的放射性计数(cpm);之后用log-logit处理数据,得出结果(CONC)。
1.8 统计学分析 运用SPSS 15.0数据分析软件分析处理各项数据。结论得出每组实验数据均为正态分布,方差齐,计量资料以均数±标准差()表示,采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD分析,以P<0.05为差异有统计学意义。
2 结果
2.1 实验大鼠心肌组织形态学改变 1)假手术组:大鼠心脏Masson染色以红色的心肌细胞为主,且心肌组织间分布均匀,结构清晰,细胞排列整齐,细胞间隙窄,且心肌细胞间质与周围血管之间无明显绿色胶原纤维。2)模型组:CHF大鼠心肌细胞间质、血管周围均可见大量的绿色胶原纤维沉积,并有瘢痕形成,部分心肌组织已被胶原纤维组织所取代,心肌细胞肥大,且围绕于心肌细胞的胶原纤维出现断裂、排列紊乱,细胞间隙增宽,血管壁增厚,纤维化程度重。3)给药组:各给药组CHF大鼠心肌间质纤维化程度介于上述2组之间,但较模型组均有不同程度的减轻,其中二参汤组与缬沙坦组无明显差异。见图1。
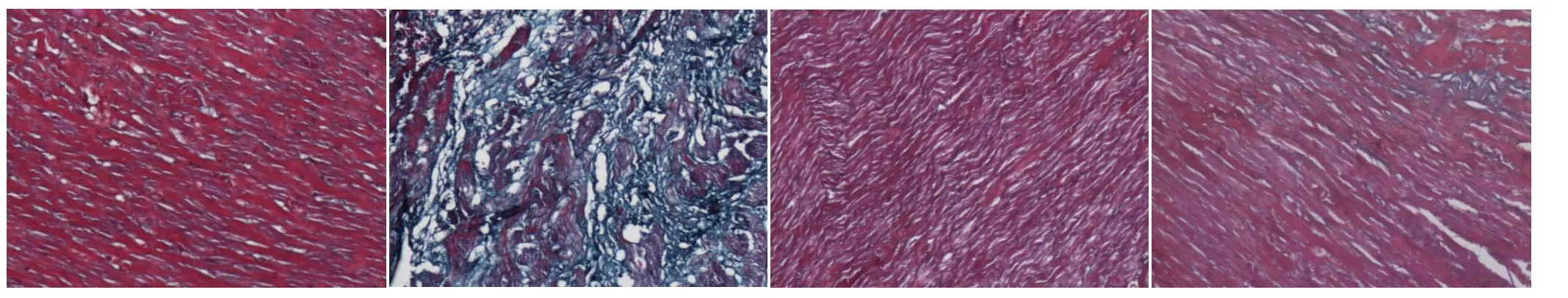
图1 各组心肌组织形态学改变
2.2 各组药物对CHF 大鼠心肌NF-κB 表达的影响 见图2、表1。
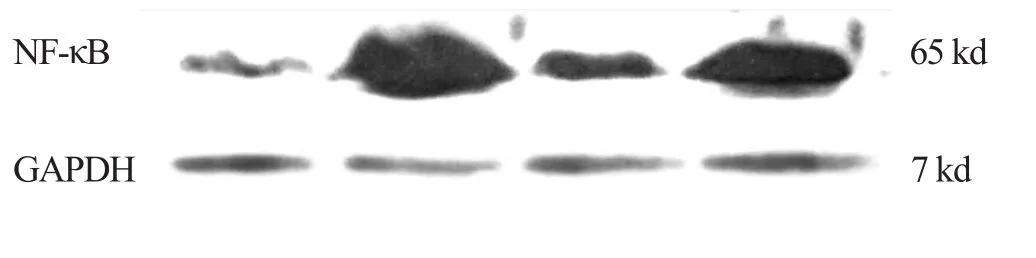
图2 各组药物对CHF 大鼠心肌NF-κB 表达的影响
表1 各组药物对 CHF 大鼠心肌NF-κB蛋白表达量的比较( ) pg/mL
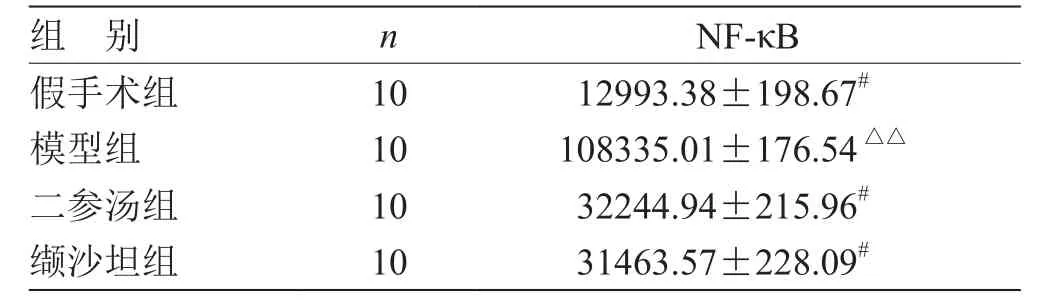
表1 各组药物对 CHF 大鼠心肌NF-κB蛋白表达量的比较( ) pg/mL
注:与模型组比较,# P<0.05;与假手术组比较,△△P<0.01
组 别 n NF-κB假手术组 10 12993.38±198.67#模型组 10 108335.01±176.54△△二参汤组 10 32244.94±215.96#缬沙坦组 10 31463.57±228.09#
2.3 各组血清中CRP含量比较 见表2。
表2 各组血清中CRP含量比较( ) pg/mL
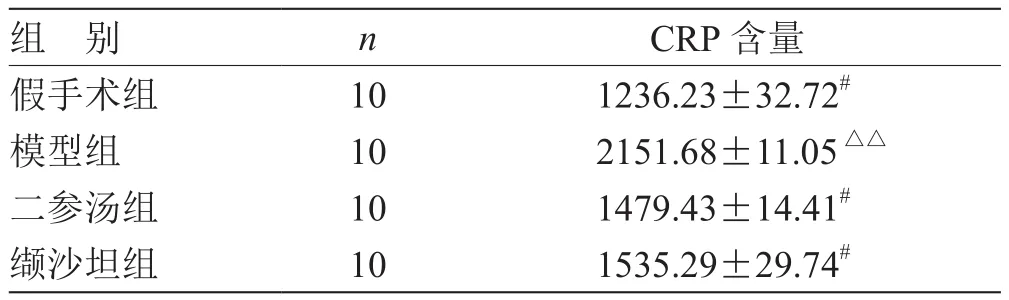
表2 各组血清中CRP含量比较( ) pg/mL
注:与模型组比较,# P<0.05;与假手术组比较,△△P<0.01
组 别 n CRP含量假手术组 10 1236.23±32.72#模型组 10 2151.68±11.05△△二参汤组 10 1479.43±14.41#缬沙坦组 10 1535.29±29.74#
2.4 各组 AngⅡ浓度比较 见表3。
表3 各组 AngⅡ浓度比较( ,n = 10) pg/mL
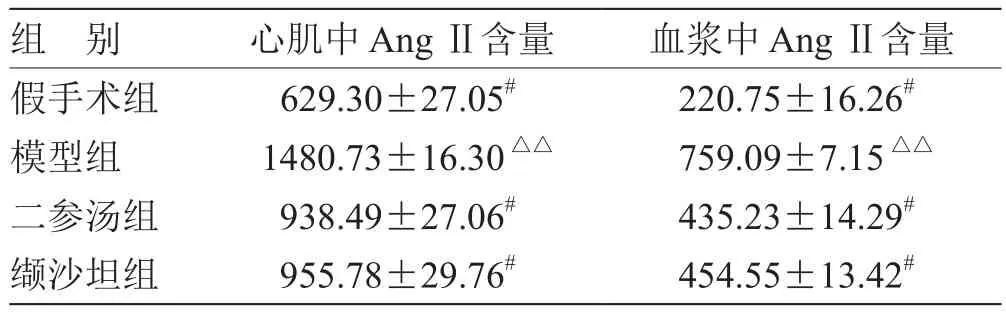
表3 各组 AngⅡ浓度比较( ,n = 10) pg/mL
注:与模型组比较,# P<0.05;与假手术组比较,△△P<0.01
组 别 心肌中 AngⅡ含量 血浆中 AngⅡ含量假手术组 629.30±27.05# 220.75±16.26#模型组 1480.73±16.30△△ 759.09±7.15△△二参汤组 938.49±27.06# 435.23±14.29#缬沙坦组 955.78±29.76# 454.55±13.42#
3 讨论
研究证实,AngII本身是一种强大的促炎症因子,它能够激活循环中的白细胞,并通过合成黏附分子、趋化因子等参与白细胞黏附至活化的内皮细胞。通过对RAAS系统的深入研究,已经发现一条心衰的炎症反应链,即体内的RAAS系统被激活,导致Ang II的释放增加,激活NF-κB,形成各种炎性因子对血管壁的浸润,使得TNF-α、IL-6及CRP等炎性因子的过度表达,最终产生炎症反应。有研究证实,Ang II可以上调TLR4的表达,这可能是Ang II的致炎作用之一[5],并且它通过TLR4/NF-κB通路介导血管平滑肌细胞的炎性反应[6]。研究证明,AngⅡ是 RAAS系统的主要活性物质,在正常生理状态下,心肌局部的AngⅡ水平基本保持在10~8 mol/L左右,调节血管收缩及水盐代谢;但在高血压、心肌缺血或心力衰竭等病理条件下,心肌组织局部的AngⅡ水平便能上升到10~7 mol/L以上,而此时则能够导致心肌肥大及血管重构。近些年通过对RAAS系统的深入研究,人们已经发现一条心衰的炎症反应链,即Ang II释放→激活NF-κB→启动细胞因子CRP最终导致炎症反应。所以Ang II无论是从RAAS系统,还是从炎症通路,均能促使心力衰竭的进一步发展和恶化,所以抑制Ang II的升高,便能够切段该反映链,进而在一定程度上控制心衰的发展。
本次实验结果显示,模型组AngII含量最高,假手术组含量最低,各给药组含量均较模型组有所降低,其中以二参汤组最为显著。说明二参汤、缬沙坦均能抑制AngII的生成,在一定程度上阻断Ang II在CHF中的传导途径,对控制CHF的进一步发展起到了作用。
