黄芪甲苷对高糖诱导肾小管上皮细胞凋亡及线粒体自噬相关蛋白表达的影响
2019-12-20刘新辉
刘新辉
(深圳市中医院肾病科,广东深圳 518033)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病的一种进展性微血管并发症,可累及肾小球、肾小管、肾血管及肾间质。尽管肾小球被认为是DKD肾脏损伤的首要靶点,然而越来越多的证据表明肾小管损伤在DKD进展中发挥了重要作用[1]。目前的观点认为,DKD不仅仅是肾小球硬化的表现,而且是肾小管上皮细胞对多种信号通路、细胞因子进行整合、“精心策划”的结果[2]。肾小管损伤及细胞凋亡与DKD疾病严重程度具有相关性[3]。又有研究表明,近端肾小管上皮细胞是机体含线粒体最丰富的细胞之一,其功能的正常与否极大地依赖于线粒体。近端肾小管上皮细胞线粒体损伤是DKD发生的重要环节[4]。而线粒体自噬是细胞维持线粒体稳态及功能的关键调控机制[5]。其中,同源性磷酸酶张力蛋白诱导的激酶1(phosphatase and tensin homolog deleted on chromosome ten induced kinase 1,PINK1)∕帕金蛋白(Parkin)介导的线粒体自噬是目前哺乳动物细胞中线粒体自噬研究最深入的信号通路,然而其在DKD中的作用还有待阐明。
DKD属中医学“消渴病”范畴,与先天禀赋不足、饮食失节、情志失调、劳倦太过等密切相关,其病位在肾,涉及五脏六腑。DKD的病机特点为本虚标实、虚实夹杂。黄芪是中医方剂中治疗DKD的常用且有效药物[6,7]。黄芪甲苷(astragalosideⅣ,AS-Ⅳ)是中药黄芪的主要活性成分,可抗炎、抗氧化、降糖及抗衰老[8],对糖尿病肾脏有明显的保护作用[9,10]。本课题组前期研究发现,AS-Ⅳ可调控2型糖尿病小鼠(db∕db小鼠)肾脏PINK1∕Parkin介导的线粒体自噬,并发挥肾保护作用[11]。基于此,本研究拟进一步在体外实验中探讨AS-Ⅳ对高糖(HG)诱导的近端肾小管上皮细胞凋亡及线粒体自噬的作用。现将研究结果报道如下。
1 材料与方法
1.1 细胞株及培养 大鼠近端肾小管上皮细胞NRK-52E,由美国ATCC公司提供。NRK-52E细胞培养于含体积分数5%胎牛血清及1%青霉素—链霉素的DMEM培养基内,置于体积分数5%CO2、37℃细胞培养箱中。每1~2 d换液1次。细胞生长融合至80%~90%时用2.5 g∕L胰蛋白酶(含0.2 g∕L EDTA)溶液消化、传代,或无血清化用于后续实验。
1.2 主要药物与试剂 AS-Ⅳ(美国Abmole公司,批号:83207-58-3)。D-葡萄糖(美国Sigma-Aldrich公司);cleaved-caspase-3、PINK1抗体(美国Gene Tex公司);Parkin、轻链-3(light chain 3,LC3)-Ⅱ、LC3-Ⅰ、β-actin抗体(美国Sigma-Aldrich公司);二抗(美国Cell Signaling Technology公司)。
1.3 主要仪器 超净工作台(ESCO公司);CO2培养箱(美国Thermo Scientific公司);酶标仪(美国BioTek公司);垂直电泳仪、转膜仪、全自动凝胶成像和化学发光图像分析系统(美国Bio-Rad Laboratories公司)。
1.4 分组 将NRK-52E细胞分为3组:正常对照组、HG刺激组、AS-Ⅳ干预组。正常对照组仅加入普通培养基;HG刺激组加入含葡萄糖浓度为30 mmol∕L的培养基;AS-Ⅳ干预组加入含葡萄糖浓度为30 mmol∕L的培养基的同时加入AS-Ⅳ100 μmol∕L。刺激时间为48 h。
1.5 细胞增殖能力检测 采用细胞计数试剂盒8(CCK-8)检测HG及AS-Ⅳ对细胞增殖能力的影响。将密度为105个∕mL的单细胞悬液接种于96孔板,每孔100 μL。细胞贴壁后按组别给予HG及HG+AS-Ⅳ刺激,每组设置6个复孔。48 h后向每孔中加入10 μL CCK-8溶液,在培养箱中培养1 h。用酶标仪测定在450 nm处的吸光度[D(λ)],计算细胞增殖抑制率,细胞增殖抑制率(p∕%)=[对照组D(λ)-实验组D(λ)]∕[对照组D(λ)-空白组D(λ)]×100%。
1.6 Westernblot法检测cleaved-caspase-3、PINK1、Parkin、LC3-Ⅱ、LC3-Ⅰ蛋白表达 细胞分组刺激48 h后吸走培养基,用预冷的0.01 mol∕L磷酸盐缓冲液(PBS)洗涤2次。加入1×细胞裂解液100~150 μL∕皿并覆盖均匀,置于冰上,摇床上裂解10~15 min。用细胞刮刮下细胞蛋白并移入预冷的1.5 mL EP管中,离心(4℃,12 000 g,10 min)后将上清转入另一1.5 mL EP管。采用Bradford法测蛋白浓度并配平。将等量的蛋白样本加入孔槽中,依次进行电泳、转膜、5 g∕L脱脂奶粉室温封闭60 min;孵育一 抗(cleaved-caspase-3、PINK1、Parkin、LC3-II、LC3-I、β-actin)、二抗,曝光显影,图像分析。采用Image-Lab软件(美国Bio-Rad公司)进行电泳条带灰度值分析,其结果以目的蛋白与内参蛋白(β-actin)灰度值的比值(p)表示。
1.7 统计方法 采用SPSS 16.0统计软件进行数据分析。结果以均数±标准差()表示,每项实验至少重复3次。多组比较采用单因素方差分析(one-way ANOVA),并进行两两比较,方差齐时采用最小显著性差异法(LSD)检验,方差不齐时采用Games-Howell检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组NRK-52E细胞增殖能力比较 图1结果显示:HG刺激组NRK-52E细胞增殖受到显著抑制(P<0.01),AS-Ⅳ干预可有效缓解HG对细胞增殖的抑制作用(P<0.01)。
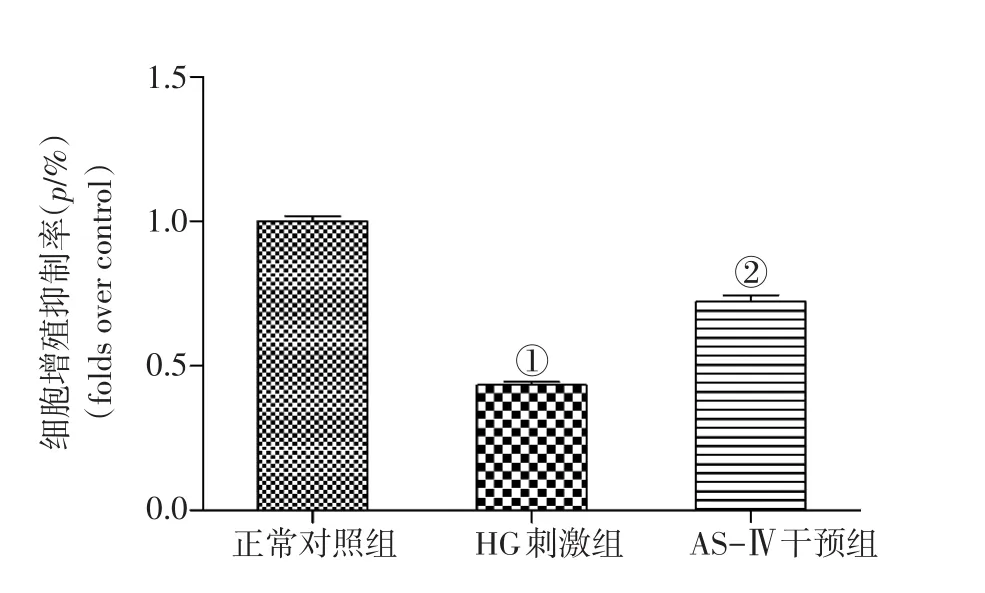
图1 各组NRK-52E细胞增殖能力比较Figure 1 Comparison of the proliferation ability of NRK-52E cells
2.2 各组NRK-52E细胞促凋亡蛋白表达比较 图2结果显示:HG刺激可显著上调NRK-52E细胞促凋亡蛋白cleaved-caspase-3的表达(P<0.01),而HG+AS-Ⅳ组cleaved-caspase-3的表达被显著下调(P<0.05)。提示AS-Ⅳ可抑制HG诱导的NRK-52E细胞凋亡。
2.3 各组细胞线粒体自噬相关蛋白表达比较 图3-a结果显示,HG刺激组细胞线粒体自噬相关蛋白PINK1、Parkin、LC3-Ⅰ、LC3-Ⅱ表达均升高,而HG+AS-IV组以上指标均有所下降。对灰度值进行半定量分析(见图3-b、c、d)显示,HG刺激组PINK1、Parkin相对表达量及LC3-Ⅱ∕LC3-Ⅰ比值显著升高,与正常对照组比较,差异有统计学意义(P <0.01);HG+AS-Ⅳ组PINK1、Parkin相对表达量及LC3-Ⅱ∕LC3-Ⅰ比值显著降低,与HG刺激组比较,差异均有统计学意义(P<0.05或P<0.01)。提示HG可促进NRK-52E细胞线粒体自噬,而经AS-Ⅳ干预后其自噬现象有所缓解。
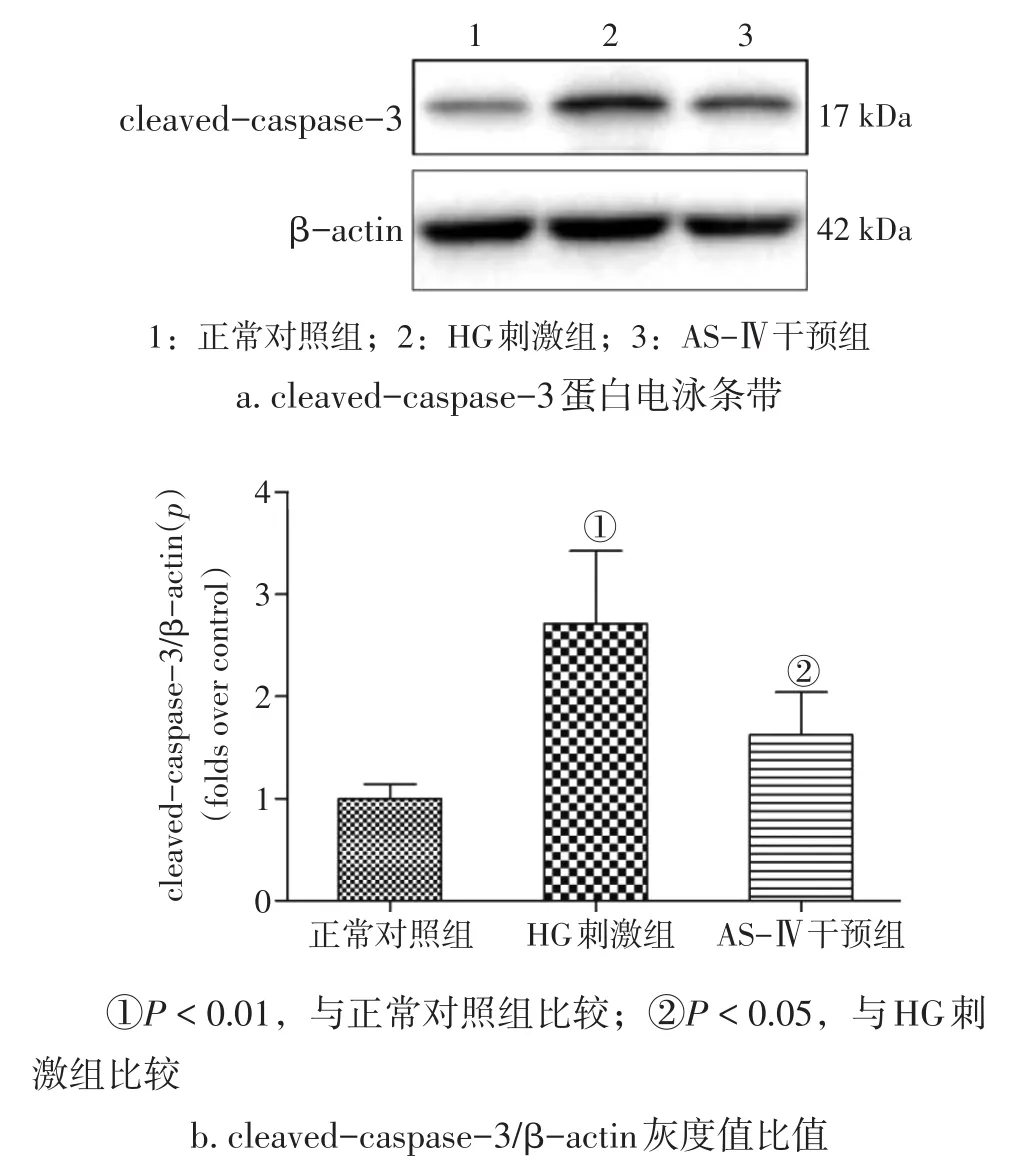
图2 各组NRK-52E细胞cleaved-caspase-3蛋白表达比较Figure 2 Comparison of the expression levels of cleaved-caspase-3 protein in NRK-52E cells of various groups
3 讨论
既往有研究表明,高糖环境可多途径诱导肾小管上皮细胞凋亡,从而导致肾脏小管间质纤维化改变[12]。本研究采用高糖(HG)刺激近端肾小管上皮细胞的方法,在体外模拟DKD的形成,并探讨AS-Ⅳ抗凋亡的可能机制,结果表明30 mmol∕L HG刺激NRK-52E细胞48 h可以上调促凋亡蛋白cleaved-caspase-3的表达,而AS-Ⅳ干预可抑制HG诱导的NRK-52E细胞凋亡。结果与文献[13]研究结果一致。
近年来,近端肾小管上皮细胞线粒体损伤在DKD中的作用受到重视。HG状态下的线粒体损伤包括线粒体分裂增多、融合减少导致的线粒体片段化改变、线粒体DNA氧化性损伤、线粒体膜通透性增加等。这些因素可引起细胞氧化应激、炎症、凋亡等,从而导致DKD的发生发展[14,15]。从来自临床患者的资料发现,无论是尿液代谢组学还是外周血单个核细胞分析结果,均表明DKD患者线粒体代谢功能是下降的[16,17],这进一步证实了线粒体损伤在DKD中的重要性。线粒体并不是静止的细胞器,而是处于一系列动态变化中,包括生物发生、分裂∕融合及线粒体自噬等。当线粒体受到损伤后,持续去极化的线粒体将通过线粒体自噬途径降解,防止受损线粒体积聚影响细胞功能[18]。然而,过度的线粒体自噬将清除过多的线粒体成分,同样会导致线粒体功能障碍影响细胞功能。因此,线粒体自噬是双刃剑,既可促进细胞生存,也可导致细胞死亡,是线粒体质量调控的关键环节。

图3 各组NRK-52E细胞PINK1、Parkin、LC3-I、LC-3II蛋白表达比较Figure 3 Comparison of the expression levels of PINK1,Parkin,LC3-I and LC-3II proteins in NRK-52E cells of various groups
PINK1∕Parkin介导的线粒体自噬是目前哺乳动物细胞中线粒体自噬研究较深入的信号通路。PINK1是一种包含线粒体定位序列的丝氨酸∕苏氨酸蛋白激酶。正常情况下,PINK1在线粒体膜上经过两次裂解后从线粒体解离并快速降解。当各种因素引起线粒体膜电位下降时,PINK1在线粒体的裂解受到抑制,使得大量PINK1积聚在线粒体外膜。PINK1在线粒体外膜的积聚将诱导具有E3泛素连接酶活性的Parkin由胞浆移位到损伤的线粒体,使线粒体外膜的特异性底物蛋白泛素化并募集p62蛋白,进而与自噬蛋白LC3结合,胞浆型LC3(即LC3-Ⅰ)被脂质化为(自噬体)膜型LC3(即LC3-Ⅱ),介导泛素化的底物进入自噬体,启动线粒体自噬以清除受损线粒体[19]。LC3-Ⅱ∕LC3-Ⅰ比值的大小可估计自噬水平的高低。Smith M A等[20]发现链脲佐菌素(STZ)诱导1型糖尿病4周后大鼠肾脏皮质PINK1蛋白表达增加,而Zhan M等[21]研究发现STZ诱导1型糖尿病8周后小鼠肾小管上皮细胞PINK1表达减少。本课题组前期研究采用2型糖尿病小鼠模型(db∕db小鼠),提取肾脏皮质线粒体进行分析,结果显示,与正常对照组(db∕m小鼠)比较,db∕db小鼠肾脏线粒体PINK1、Parkin蛋白表达显著增加[11]。而本研究结果亦显示,HG刺激可诱导体外肾小管上皮细胞PINK1、Parkin表达水平及LC3-Ⅱ∕LC3-Ⅰ比值增加。AS-Ⅳ可下调线粒体自噬相关蛋白的表达。该结果与本课题组前期体内研究结果一致,从体外研究角度再次验证了AS-Ⅳ对DKD的治疗作用可能与调控线粒体自噬有关。
综上所述,AS-IV可抑制HG诱导的肾小管上皮细胞凋亡,减轻线粒体自噬,为其治疗DKD提供新的证据及可能靶点。但本研究仅观察了线粒体自噬及凋亡相关几种蛋白的表达,下一步拟通过siRNA或过表达质粒下调或上调线粒体自噬,进一步探讨AS-Ⅳ对肾小管上皮细胞的保护作用机制。
