强肌健力方对重症肌无力大鼠Th17∕Treg平衡的影响
2019-12-20方学君梁艺刘晓曼谭梅傲曹敏赵利娜
方学君,梁艺,刘晓曼,谭梅傲,曹敏,赵利娜
(1.广州中医药大学,广东广州 510405;2.广州中医药大学第一附属医院,广东广州 510405)
重症肌无力(myasthenia gravis,MG)是一种由于丧失功能受体导致胆碱能神经传递的缺陷,从而导致自发性肌无力和肌疲劳的神经自身免疫性疾病,属于中医的“痿病”范畴。MG具有病情重、死亡率高、易复发的特点,是世界性难治疾病之一。临床中,西医学主要应用胆碱酯酶抑制剂、糖皮质激素、免疫抑制剂、血浆置换法、胸腺切除术等疗法治疗,但副作用多,疗效欠理想,故寻求安全、有效的治疗手段是亟待解决的问题。国医大师邓铁涛教授根据“脾主肌肉”理论和“脾胃虚损,五脏相关”学说,运用健脾益气法治疗该病,在提高临床疗效、减轻激素的依赖性及减少患者的复发率方面存在一定优势。健脾益气法代表方强肌健力方在临床上取得了良好的疗效,多项临床试验表明,该方能有效治疗脾胃气虚型MG[1-5],减缓乙酰胆碱受体(acetylcholine receptor,AchR)的降解,增加有效AchR数量,促进神经递质的传递[6]。强肌健力方虽临床疗效确切,但其作用机理尚不明确。有研究表明,辅助性T细胞17型细胞(T helper cell 17,Th17)在MG发病过程中起到了关键性的作用,而调节性T细胞(regulatory cell,Treg)能抑制其功能。因此,本研究拟观察不同剂量强肌健力方灌胃前后MG大鼠体质量及肌力变化,同时采用蛋白免疫印迹(Western blot)法检测不同剂量强肌健力方灌胃后MG大鼠脾脏Th17细胞特异性核转录蛋白维甲酸受体相关孤儿受体γt(RORγt)、相关细胞因子白细胞介素17A(IL-17A),Treg细胞特异性转录因子叉头蛋白p3(Foxp3)及其转化生长因子β(TGF-β)蛋白表达水平,以探讨强肌健力方能否通过影响MG大鼠Th17、Treg细胞的转录及其相关细胞因子的表达来调节二者平衡,从而对MG大鼠产生治疗作用,并明确其量—效关系,以期从免疫学方面为中医药治疗MG的临床研究提供依据。现将研究结果报道如下。
1 材料与方法
1.1 实验动物 6~8周龄Lewis雌鼠共70只,体质量180~200 g,购自北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2016-0011]。饲养于广州中医药大学实验动物中心SPF级别动物房中[许可证号:SYXK(粤)2013-0001],自由进食、饮水,保持恒温22℃,湿度55%,昼夜节律。
1.2 实验药物 强肌健力方中黄芪、五爪龙、熟党参、生白术、当归、广升麻、北柴胡、蒸陈皮、甘草等中药饮片均购自广州中医药大学第一附属医院中药房。
1.3 主要试剂与仪器 鼠源性AchR-α亚单位97-116肽段(杭州中肽生化有限公司);完全弗氏佐剂(CFA)(美国Sigma公司,批号:F5506)、不完全弗氏佐剂(IFA)(美国Sigma公司,批号:F5881)。鼠源性多克隆RORγt抗体(美国Novus公司,批号:NBP2-24449);Foxp3抗体(美国abcam公司,批号:ab22510);IL-17A抗体(美国Affinity公司,批号:DF6127);TGF-β抗体(美国Abcam公司,批号:ab170874);山羊抗兔IgG H&L(HRP)(美国Abcam公司,批号:ab6721);BCA试剂盒(美国Pierce公司,批号:23227);电化学发光(ECL)试剂盒(美国Millipore公司,批号:WBKLS0500)。BL-420S生物信号采集与分析系统(成都泰盟公司);Mini-PROREAN3垂直电泳仪及转移系统(美国Bio-Rad公司);Tanon 1600凝胶成像系统(上海天能公司)。
1.4 造模与分组 将70只Lewis雌性大鼠适应性喂养1周后随机选取7只作为正常组,其余63只参照许文华等[7]的造模方法进行造模:首次免疫当天视为0天,将鼠源性AchR-α亚单位97-116肽段、完全弗氏佐剂(CFA)和磷酸盐缓冲液(PBS)按照1∶1∶1比例经振荡器混匀成乳化剂。水合氯醛按照1∶10的比例配成100 g∕L质量浓度,按0.3 mL∕kg的剂量腹腔注射麻醉大鼠后,取200 μL乳化剂分别注射于脊柱两侧及双侧后足垫皮下(含多肽100 μg);第2次加强免疫于首次免疫后第4周末进行,多肽、不完全弗氏佐剂(IFA)和PBS按照1∶2∶2比例混匀乳化后于相同部位皮下注射(含多肽50 μg);首次免疫后第6周末进行第3次加强免疫,其注射方法及剂量同第2次加强免疫。第3次加强免疫结束后1周(首次免疫第7周)评估造模。造模成功评估标准:①出现肢体乏力症状;②Lennon评分≥1分;③低频重复电刺激(repetitive nerve stimulation,RNS)[RNS=(第1波波幅-第5波波幅)∕第1波波幅×100%]≥10%。再将成模的Lewis大鼠随机分为模型组(N=7),强肌健力方高剂量组(N=8)、中剂量组(N=7)、低剂量组(N=8)。
1.5 给药方法 各组灌胃液体积为10 mL∕kg(体质量),其浓度及等效剂量按成人体质量折算[8]。首次免疫后第8周,强肌健力方高、中、低剂量组开始分别给予大鼠强肌健力方(剂量分别为23.4、15.6、7.8 g·kg-1·d-1)灌胃,正常组和模型组予相同体积生理盐水灌胃。1次∕日,疗程为4周。
1.6 观察指标与方法
1.6.1 体质量及肌力 称体质量及肌力评估于实验前及接种免疫后(每周2次)进行。以Lennon评分作为肌力评估标准,对于肌无力临床体征表现不明显的大鼠,重复抓握笼顶1 min后再评估。具体评分标准[9]为:0分,无任何临床体征;1分,检测前无临床体征,运动后出现疲乏无力症状;2分,检测前即出现肌无力体征,如蜷缩、抓握及抬颈无力;3分,无力抓握和行走、活动;4分,濒死状态。介于两者之间的以0.5、1.5、2.5、3.5分评定。
1.6.2 Western blot法检测大鼠脾脏组织RORγt、Foxp3、IL-17A、TGF-β蛋白表达水平 取各组大鼠脾脏组织100 mg样品充分研磨,加入组织裂解液RIPA冰上裂解 30 min后,14 000 r∕m离心15 min,收集上清提取组织蛋白,参照二喹啉甲酸(BCA)试剂盒说明书操作测定组织总蛋白浓度。各孔取40 μg的蛋白上样,经100 g∕L聚丙烯酰胺凝胶电泳进行蛋白分离,将分离后的蛋白电转移至PVDF膜,加入脱脂奶粉封闭液于摇床上室温封闭2 h。TBST溶液共洗膜6次,5 min∕次,加入经稀释的一抗4℃孵育过夜。第2天用TBST洗膜3次,10 min∕次,加入稀释后的二抗,室温孵育2 h。孵育结束后,室温下浸泡于TBST溶液中置于脱色摇床上洗2次,10 min∕次。根据ECL试剂盒说明书进行显影。采用Image J图像分析管理系统对蛋白条带灰度值进行分析。
1.7 统计方法 采用SPSS 19.0统计软件进行数据分析,计量资料采用均数±标准差()表示,多组比较采用单因素方差分析,多组间的两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 造模结果 造模过程中,造模组大鼠因麻醉过度低体温死亡3只,最终成模30只,成模率约50%。其原因可能为诱导免疫的乳化剂中未额外添加具有增强免疫作用的HR37a冻干粉,免疫原性较弱所致。另外,灌胃过程中因误灌入肺,强肌健力方高、低剂量组各死亡1只。
2.2 各组大鼠体质量及肌力比较 图1、2结果显示:造模前,各组大鼠体质量相近,肌力正常。造模过程中,正常组大鼠体质量呈稳步上升趋势且肌力正常,造模大鼠体质量增速较为缓慢,逐渐出现活动减少、叫声及抓握力减弱及动作迟钝等症状,特别是第3次免疫过后,各造模组大鼠体质量出现下降,肌无力症状明显加重。首次免疫后第8周开始灌胃给药后,模型组体质量及肌力继续下降,各中药剂量组大鼠体质量开始逐渐上升,Lennon评分开始下降。给药4周结束后,与模型组比较,强肌健力方各剂量组均能有效增加MG大鼠体质量(P<0.05),降低Lennon评分(P<0.01),且各给药组MG大鼠体质量及肌力改善程度与灌胃中药剂量呈正相关。
2.3 各组大鼠脾脏RORγt、Foxp3、IL-17A、TGF-β表达比较 图3、表1结果显示:与正常组比较,模型组大鼠脾脏RORγt、IL-17A蛋白表达水平均明显升高,Foxp3、TGF-β蛋白表达水平均明显下降,差异均有统计学意义(P<0.05或P<0.01);与模型组比较,强肌健力方各剂量组大鼠脾脏RORγt、IL-17A蛋白表达水平均显著下降(P<0.01),Foxp3(低剂量组除外)、TGF-β蛋白表达水平均明显上升(P<0.05);且强肌健力方各剂量组对MG大鼠脾脏RORγt、IL-17A、Foxp3、TGF-β蛋白表达的作用在量—效关系上呈正相关。表明强肌健力方能够抑制MG大鼠脾脏Th17细胞转录蛋白RORγt及细胞因子IL-17A的表达,促进Treg细胞转录蛋白Foxp3及细胞因子TGF-β的表达,且其作用与药物剂量呈正相关。
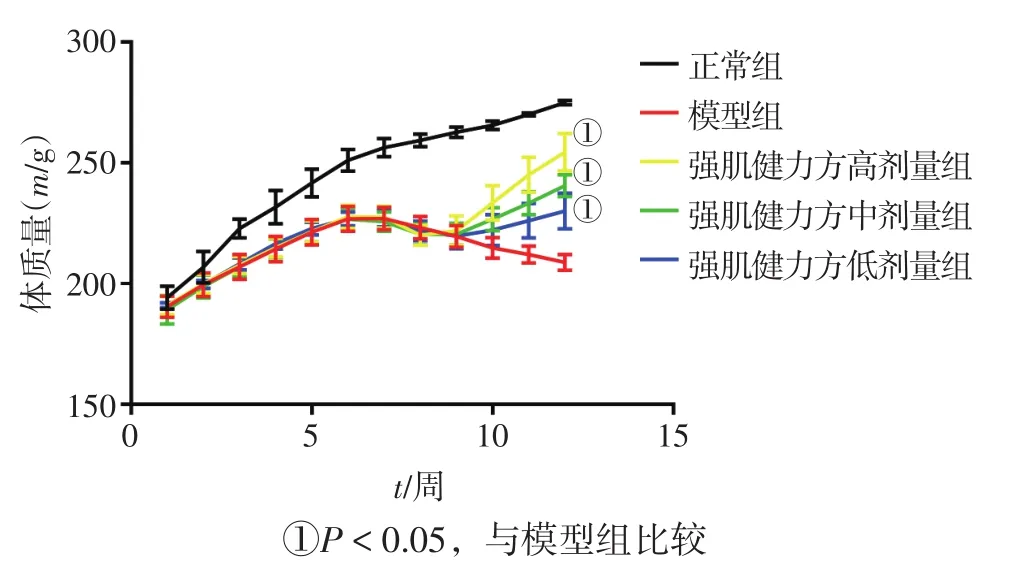
图1 大鼠体质量趋势Figure 1 The trend of body mass in rats
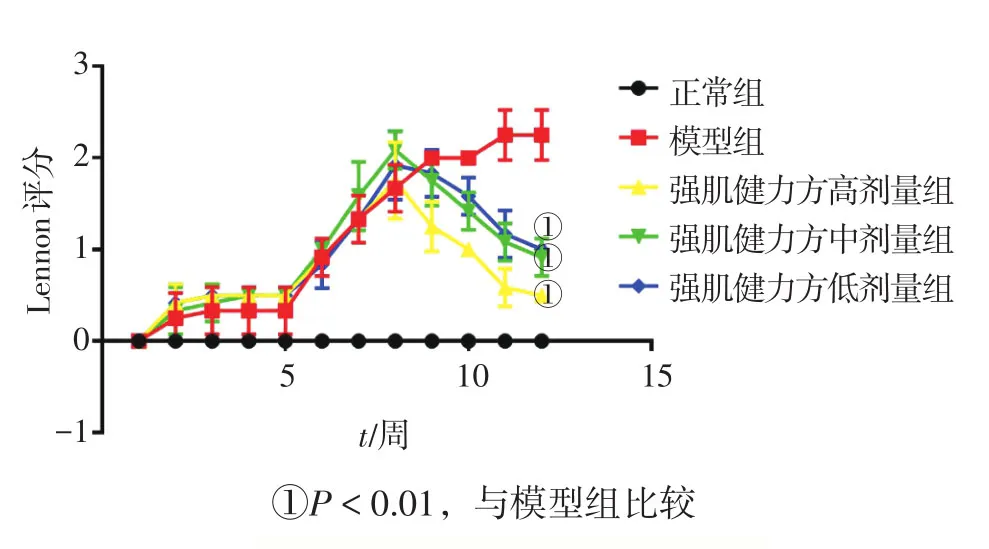
图2 Lennon评分趋势图Figure 2 The trend of Lennon scores in various groups
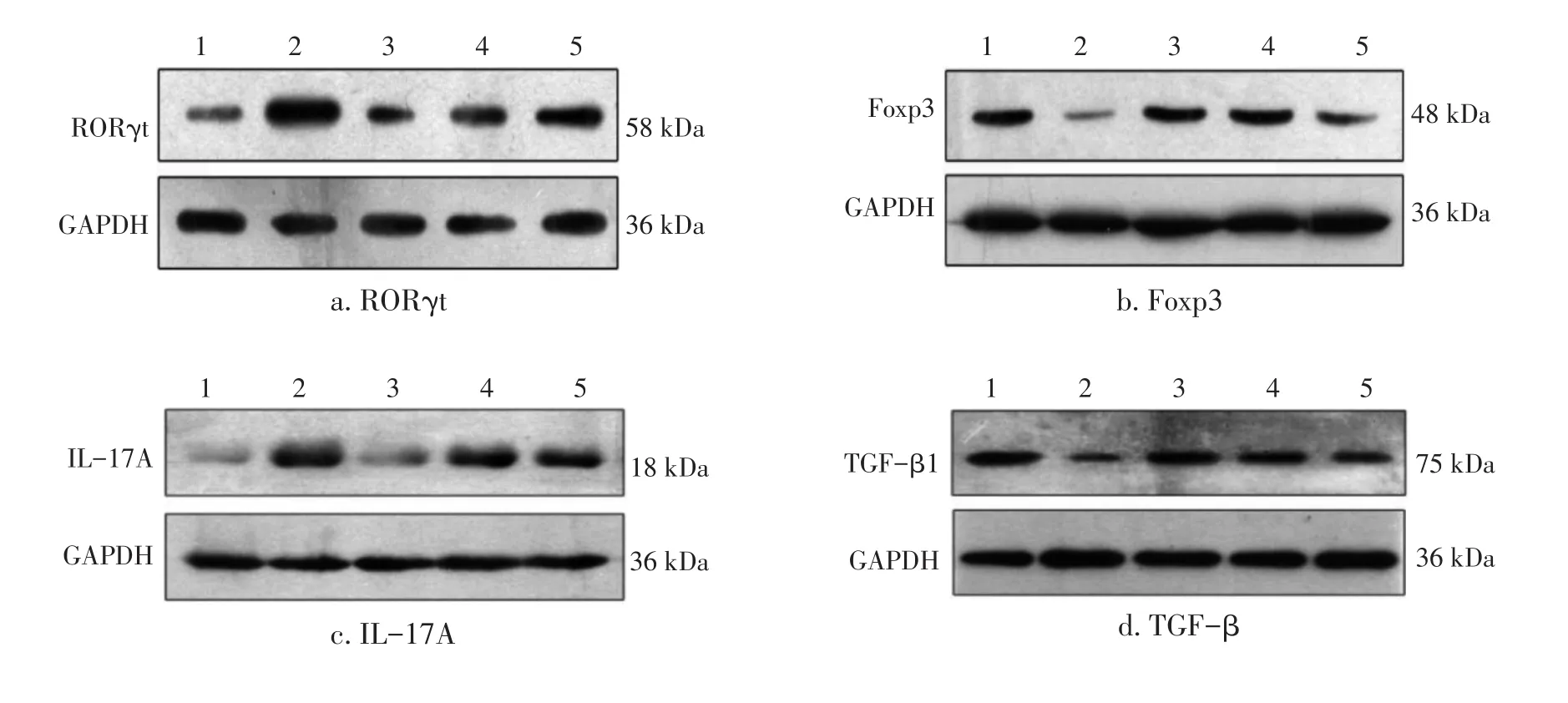
图3 各组大鼠脾脏RORγt、Foxp3、IL-17A、TGF-β蛋白电泳条带图Figure 3 The graph of electrophoresis bands of RORγt,Foxp3,IL-17A and TGF-β proteins in rat spleen tissues of various groups
表1 各组大鼠RORγt、Foxp3、IL-17A、TGF-β蛋白相对表达Table 1 Comparison of the relative expression levels of RORγt,Foxp3,IL-17A and TGF-β proteins in rat spleen tissues of various groups (,p)
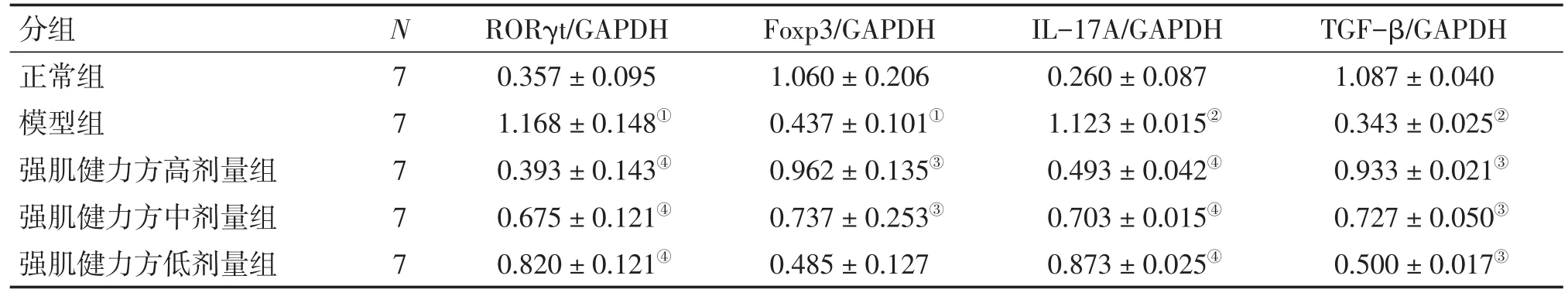
表1 各组大鼠RORγt、Foxp3、IL-17A、TGF-β蛋白相对表达Table 1 Comparison of the relative expression levels of RORγt,Foxp3,IL-17A and TGF-β proteins in rat spleen tissues of various groups (,p)
①P<0.05,②P<0.01,与正常组比较;③P<0.05,④P<0.01,与模型组比较
分组正常组模型组强肌健力方高剂量组强肌健力方中剂量组强肌健力方低剂量组TGF-β∕GAPDH 1.087±0.040 0.343±0.025②0.933±0.021③0.727±0.050③0.500±0.017③N7 7 7 7 7 RORγt∕GAPDH 0.357±0.095 1.168±0.148①0.393±0.143④0.675±0.121④0.820±0.121④Foxp3∕GAPDH 1.060±0.206 0.437±0.101①0.962±0.135③0.737±0.253③0.485±0.127 IL-17A∕GAPDH 0.260±0.087 1.123±0.015②0.493±0.042④0.703±0.015④0.873±0.025④
3 讨论
邓铁涛教授认为,MG病机根本在于脾胃,脾虚则气血生化无力,气血不足无以濡养肌肉四肢则导致肌肉无力。强肌健力方全方以补气健脾、益气升陷为法,使肌肉得以充养,下垂之证得以缓解,从而改善MG的肌无力症状。本研究观察强肌健力方对MG大鼠体质量及肌力的影响,结果显示,首次免疫后第8周开始给药前,正常组体质量均明显高于各造模组,而Lennon评分则明显低于各造模组。结束4周给药后,强肌健力方不同剂量组大鼠体质量与模型组比较均明显升高,Lennon评分明显降低,且其升高及下降幅度随中药给药剂量逐渐加大。表明强肌健力方能够有效提高MG大鼠的体质量及肌力,且量—效关系呈正相关。
既往认为,MG的免疫学发病机制与Th1∕Th2型细胞因子失衡导致B细胞产生过多自身免疫性抗体有关,这一理论机制一直占主导地位[10]。近期研究发现Th17细胞参与了Th1∕Th2型细胞因子的失衡,辅助B细胞产生过多自身免疫性抗体,导致免疫紊乱,从而促使MG的发生[11],而Th17细胞的免疫学功能受Treg细胞功能的限制。
Th17细胞作为CD4+T淋巴细胞亚群中的一个重要亚群,特异性表达核转录因子RORγt,分泌细胞因子IL-17、IL-23,参与促进自身免疫性疾病的发生及发展。临床及动物研究均表明,Th17细胞及其相关细胞因子,尤其是IL-17,具有促进MG发病的作用,MG患者外周血及胸腺的Th17细胞增多,且与病情严重程度呈正相关[12];而动物实验表明Th17细胞通过分泌IL-17促进AchR-ab IgG2b表达和诱导B细胞耐受的缺失,进而增加AChR-Ab的产生[13]。Treg细胞特异性表达转录因子Foxp3,分泌细胞因子TGF-β、IL-10,具有维持自身免疫耐受的作用。Treg细胞的功能异常在自身免疫性MG的发病机制中起着十分重要的作用,其主要原因为Foxp3表达缺失,影响Treg细胞发育及功能的发挥,且Foxp3的缺失程度与MG的严重程度相关[11,14]。研究表明,Foxp3能够通过直接作用于RORγt抑制Th17细胞的产生[15]。本实验研究结果表明,与模型组比较,强肌健力方各剂量组均能有效提高Treg细胞特异性转录因子Foxp3蛋白表达水平,降低Th17特异性转录因子RORγt蛋白表达水平,推测强肌健力方可能通过促进Foxp3的表达,同时抑制RORγt的表达,影响Th17及Treg细胞的分化,从而调节二者的平衡对MG大鼠产生治疗作用。
相关研究还发现,初始CD4+T淋巴细胞在TGF-β单独存在的情况下向Treg细胞分化,在炎症因子IL-6及少量TGF-β共同存在情况下则向Th17分化,且Th17细胞相关细胞因子IL-17、IL-21可以抑制Treg细胞的分化[16,17]。本实验研究结果显示,强肌健力方各剂量组与模型组比较能够不同程度降低细胞因子IL-17蛋白表达水平,提高细胞因子TGF-β蛋白表达水平,故推测强肌健力方可能通过影响Th17及Treg细胞转录蛋白的表达调节二者的分化,进而调节其相关细胞因子IL-17、TGF-β的表达,而IL-17表达的抑制及TGF-β表达的增加在促进初始CD4+T细胞向Treg细胞分化的同时又抑制其向Th17细胞分化,因此对MG大鼠产生治疗作用。
综上所述,强肌健力方能够有效提高MG大鼠的体质量及肌力,缓解病情,抑制Th17细胞特异性转录蛋白RORγt及细胞因子IL-17A的表达及促进Treg细胞特异性核转录蛋白Foxp3及细胞因子TGF-β的表达。推测强肌腱力方对MG大鼠的治疗作用可能是通过影响Th17、Treg细胞的分化及相关细胞因子的表达,从而调节二者平衡来实现的。而其具体的作用通路有待进一步研究阐明。
