住院患者使用利奈唑胺致贫血的相关危险因素
2019-12-20戴映蒋淑莹余旭奔张春红胡卢丰林观样
戴映,蒋淑莹,余旭奔,张春红,胡卢丰,林观样
(1.温州医科大学附属第一医院 药学部,浙江 温州 325015;2 台州市中心医院 药学部,浙江 台州 318000)
利奈唑胺(linezolid,LZD)作为第一个应用于临床的新型唑烷酮类抗生素,因与其他药物无交叉耐药,为耐药革兰氏阳性球菌引起的深部感染提供了新选择。口服LZD后1~2 h达峰浓度,生物利用度接近100%,血浆蛋白结合率约为31%,其组织渗透性强,整体组织分布稳定,半衰期为5~7 h。 目前认为该药不会与细胞色素P450 家族(cytochrome P450 proteins,CYP)氧化系统发生相互作用,而是经肝氧化代谢生成两种无活性的开环羧酸代谢产物,非肾脏清除率约占总清除率的65%。基于其独有的理化特性和药代动力学特征,LZD在临床上得到广泛应用。然而随着应用的推广,不断增多的不良反应报道逐渐引起人们关注,其中以血液系统毒性尤为突出[1-2]。目前已有较多关于LZD引起血小板减少的报道,并证实药物体内浓度与不良反应直接相关,但关于LZD所致贫血事件,国内外鲜有报道,其相关危险因素的确定中各研究间存在较大差异,尚未见中国人群LZD血药浓度与贫血发生的相关研究[3-4]。本研究从治疗药物监测(therapeutic drug monitoring,TDM)的住院患者收集LZD药物浓度,对住院患者治疗期间发生LZD相关性贫血进行相关危险因素评估,旨在为临床安全用药提供一些参考。
1 对象和方法
1.1 对象 采用回顾性研究,收集温州医科大学附属第一医院2012年5月至2017年5月因临床需要接受LZD治疗且行TDM的住院患者的临床资料。
排除标准:①年龄<18岁;②LZD治疗疗程<4 d;③LZD采血时间非稳态血药谷浓度;④血液系统疾病(白血病、淋巴瘤、骨髓瘤等)和免疫系统疾病(系统性红斑狼疮等);⑤接受放化疗;⑥大失血,弥散性血管内凝血患者;⑦白细胞、血红蛋白(hemoglobin,Hb)、血小板首剂予LZD前低于正常下限值者。本研究方案通过本院伦理委员会批准。
1.2 临床资料收集 收集患者性别、年龄、基础疾病、感染部位、LZD使用情况(剂量和疗程)、首次监测的谷浓度(trough concentration,Cmin)、联合用药,以及使用药物前后血生化指标等。肝功能指标选用丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸氨基转移酶(aspartate aminotransferase,AST),肾功能指标选用肾小球滤过率(glomerular filtration rate,GFR)。
贫血定义:Hb计数较基础值下降≥25%。中重度肾功能不全定义:GFR<60 mL·(min·1.73 m2)-1。
1.3 血药浓度测定 在稳态条件下(即给予LZD后第3 天开始),在下一剂给予之前抽取患者的静脉血样(Cmin)2 mL,使用高效液相色谱法(high performance liquid chromatography,HPLC)测定LZD血药浓度。线性范围0.25~50 mg·L-1,最低检测限0.05 mg·L-1,日内、日间变异系数均<10%。
1.4 统计学处理方法 采用SPSS25.0统计学软件。定量变量用或M(P25,P75)描述,分类变量的假设检验采用χ2检验,对连续变量符合正态分布的参数采用独立样本t检验,非正态分布参数采用Mann-Whitney U 检验。使用二分类多因素logistic回归分析危险因素优势比(odds ratio,OR)及95%置信区间(95%CI)。P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征 按入排标准纳入有效病例161例,感染部位:皮肤软组织感染67例(占41.6%),肺部感染62例(占38.5%),全身多部位感染7例(占4.3%),颅内感染6例(占3.7%),腹腔感染7例(占4.3%),败血症4例(占2.5%),感染性心内膜炎5例(占3.1%),骨和关节感染3例(占1.9%)。患者的各项临床特征详见表1。

表1 住院期间使用利奈唑胺患者临床特征
2.2 贫血发生情况及影响因素分析 161例住院患者中,有31例患者被评估为发生LZD相关性贫血(占19.3%)。将2组患者相比较,提示贫血发生组具有更高Cmin(P=0.005),同时GFR相对更低(P=0.001),AST基础值相对更高(P=0.037)。其他指标如性别、肾脏替代治疗、LZD疗程、联合使用其他抗生素等在2组之间差异无统计学意义(P>0.05)。见表2。
关于LZD治疗上限阈值至今未有一致的定值,大部分学者认为Cmin上限阈值为7~9 mg·L-1最佳[5],故本研究将Cmin分为<7 mg·L-1、≥7 mg·L-12个亚组,根据GFR将患者分为<60 mL·(min·1.73 m2)-1(中重度肾功能不全者)和≥60 mL·(min·1.73 m2)-12个亚组,分析贫血在各亚组下的发生率及趋势。其中Cmin≥7 mg·L-1的患者共86例,发生贫血患者23例,贫血发生率显著高于Cmin<7 mg/L的患者组(26.7% vs. 10.7%,χ2=6.661,P=0.01)。在肾功能不全患者亚组分析中,中重度肾功能不全患者发生贫血患者21例,发生率较GFR≥60 mL·(min·1.73 m2)-1组高(30.9% vs. 10.8%,χ2=10.237,P=0.001)。
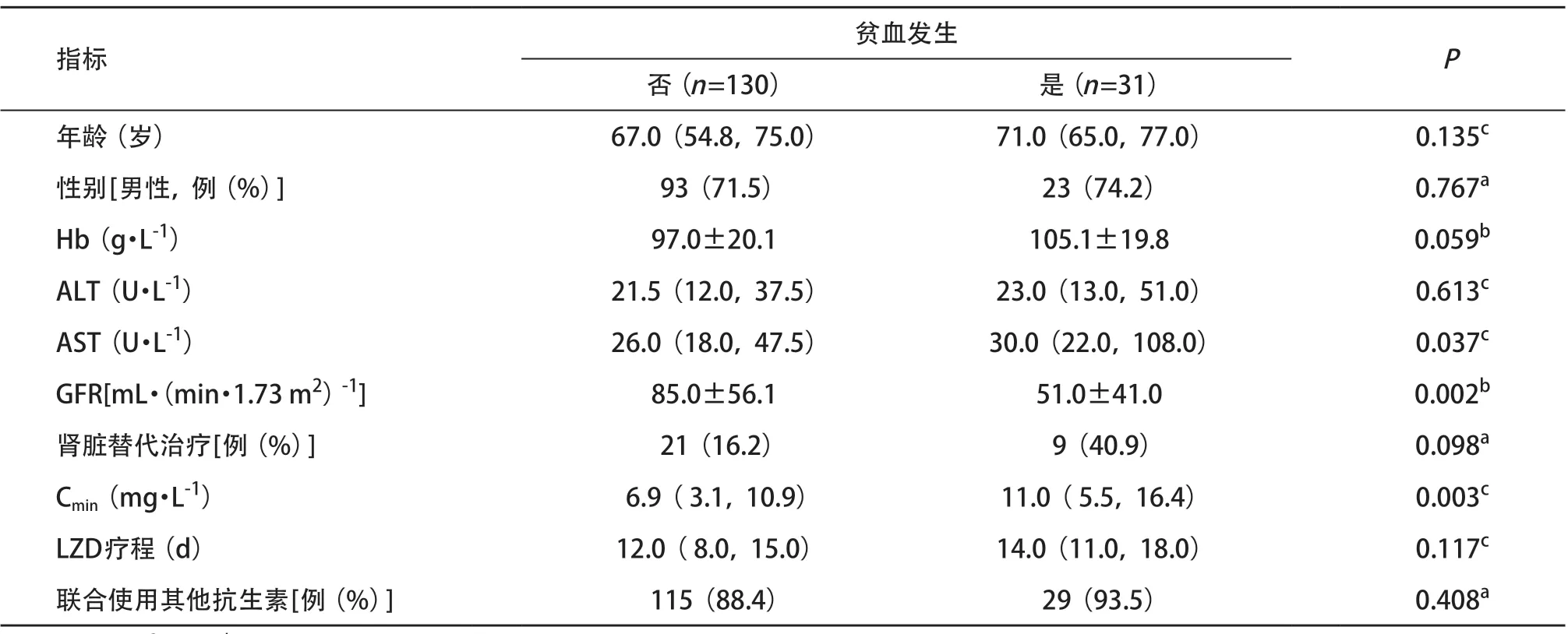
表2 发生LZD相关性贫血与未发生患者组间的临床指标比较
多因素logistic回归模型提示中重度肾功能不全患者及Cmin≥7 mg·L-1的患者发生贫血风险增加 (P<0.05),见表3。
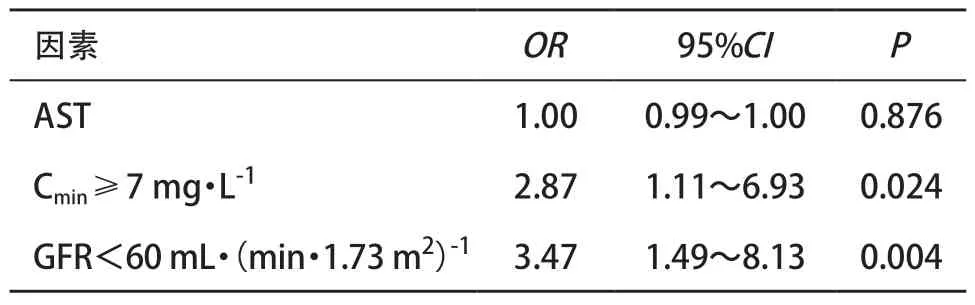
表3 LZD相关性贫血的多因素logistic回归分析
3 讨论
3.1 LZD相关性贫血发生情况 截至2019年5月,WHO药物管理数据库(VigiBase)已收13 776份LZD相关不良反应报告,比例最高的为血液系统不良反应,共4 598份,其中关于贫血的报告有1 050份,仅次于血小板减少症。目前药源性贫血的定义尚未统一,Hb较前下降20%~30%均有,笔者翻阅美国临床及循证数据库(MICROMEDEX)关于LZD贫血的不良反应发生率章节,将贫血定义为治疗期间Hb较基础值下降25%。本次纳入研究的161例住院患者中有31位患者被评估为LZD相关性贫血,发生率为19.3%,远高于说明书描述的发生率(为7.1%),提示临床使用中LZD相关性贫血非小概率事件。
3.2 LZD相关性贫血发生机制 关于LZD引起贫血的机制尚目前未完全阐明,多倾向于骨髓抑制学说。有学者认为LZD可结合到与细菌核糖体类似的人线粒体核糖体亚单位的RNA位点,以致线粒体呼吸链复合体中由线粒体DNA编码的一些关键亚单位的生化活性减弱,抑制蛋白质合成[6-7]。也有学者发现在接受LZD治疗的患者中Hb下降同时,网织红细胞计数也会降低,认为可以将网织红细胞计数作为贫血的预测标志物[8]。
3.3 肾功能与贫血发生的相关性 本研究结果提示,在接受LZD治疗的中重度肾功能受损[GFR<60 mL· (min·1.73 m2)-1]的患者中,相关性贫血发生更频繁,这类患者是肾功能正常或轻度肾损伤患者发生贫血风险的3.47倍,可能与肾功能受损导致药物清除率降低并在体内蓄积有关。HIRAKI等[4]通过贝叶斯法建立群体药动学模型,发现Hb随着清除率下降而降低,两者具有较强的线性相关(r2=0.54)。还有研究者发现,在终末期肾病(end-stage renal disease, ESRD)患者中使用LZD发生Hb降低较非ESRD患者显著升高(71.4% vs. 36.5%,P=0.003),且ESRD为LZD相关的贫血的唯一独立危险因素(OR=4,95%CI:1.50~10.64,P=0.006)[9]。最近发布的一项研究结果相似:研究者在纳入603例,包括1 309次LZD浓度的药代动力研究中,通过贝叶斯法计算出肾功能不全患者[GFR≤60 mL·(min·1.73 m2)-1]的平均个体LZD清除率明显低于肾功能正常患者[(3.80± 1.94)L·h-1vs.(5.47±2.38)L·h-1,P<0.001)],并且通过构建蒙特拉罗模型指出,可以根据肾功能情况,经验性地调整药物剂量,以期更快达到治疗的目标[13]。然而现有LZD(商品名:斯沃)说明书标注“肝、肾功能不全患者体内药代动力学参数不会发生显著改变,无须根据肝肾功能调整给药剂量”。结合本次研究结果及国内外研究,在肾功能不全尤其是在严重肾功能不全患者的患者接受LZD治疗,合适的给药剂量需进一步探讨。
3.4 药物Cmin与贫血的相关性及TDM意义 LZD的血液毒性随Cmin增高呈增长趋势已被大多数研究[14-16]证实。此次研究中我们发现在多数发生贫血事件患者中,首次检测血药浓度时已具有较高的谷浓度。其中Cmin≥7 mg·L-1组较Cmin<7 mg·L-1组贫血发生风险高1.87倍。本研究中161例患者均接受同样的给药方案(600 mg,q12 h),而首次监测时的Cmin从 0.50 mg·L-1到38.89 mg·L-1不等,这与国外报道[17]类似,显然,药品说明书中“12岁以上患者当革兰氏阳性菌感染时给予LZD 600 mg q12 h的剂量疗法”在临床应用中存在一定的局限性。
目前评价LZD药动药效学主要评价参数为浓 度-时间曲线下面积(AUC)与最低抑菌浓度(minimum inhibitory concentration,MIC)之比。MATSUMOTO 等[18]发现AUC24h和Cmin之具有强相关性(r=0.970,AUC24h=18.2×Cmin+134.4),因此常规可以监测Cmin来评价药物药动学特性。考虑其对大多数革兰氏阳性菌感染病原体的MIC90=2 mg·L-1,下限阈值普遍定为2 mg·L-1。然而关于治疗上限阈值,至今未有一致的定值,普遍认为上限阈值为7~9 mg·L-1最佳,并指出LZD Cmin为治疗期间血小板减少症的重要预测因子[5,11]。虽然目前尚未见相关指南共识,但TDM有望成为LZD在临床实践治疗中一项常规工作得以开展实施。
3.5 本研究的局限性 本研究因部分患者为重症患者,未能获取每位患者的体质量、身高,故影响因素研究未纳入BMI、体质量等因素。此外,本次研究为回顾性研究,样本量有限,尚需在大样本量、前瞻性研究中进一步证实。
综上所述,本研究发现中重度肾功能不全及药物谷浓度为LZD相关性贫血的危险因素。我们建议住院患者(尤其是肾功能不全的患者)在使用LZD治疗期间行药物浓度及血常规监测,一方面预防体内药物浓度过高所致的毒性发生,另一方面预防药物暴露量不足所致临床治疗失败,基于血药浓度结果同时结合患者临床实际情况及时调整给药剂量,以期防治不良反应的发生[19-20]。
