福建枫香炭疽病病原的种类鉴定
2019-12-19朱仰艳苏锦钰潘爱芳何学友胡红莉
朱仰艳 苏锦钰 潘爱芳 何学友 胡红莉


摘 要 在調查福建霞浦杨家溪榕枫公园和福州森林公园的枫香树叶部病害过程中,分离得到了6株形态特征有差异的炭疽菌,并采用形态特征与多基因位点系统发育分析相结合的方法对其进行鉴定。形态特征包括菌落性状、分生孢子盘、分生孢子梗及分生孢子等;系统发育分析包括内转录间隔区(ITS)、β-微管蛋白(TUB2)、肌动蛋白(ACT)、3-磷酸甘油醛脱氢酶(GAPDH)和几丁质合成酶(CHS-1)5个基因。研究明确了这6个菌株可鉴定为炭疽菌的3个种,即胶孢炭疽复合种中的果生炭疽菌C. fructicola和热带炭疽菌C. tropicale,以及尖孢炭疽复合种中的松针炭疽菌C. fioriniae。经柯赫氏法则的验证,这3个炭疽菌种均可引起枫香炭疽病,但致病力有所不同。这也是C. fructicola、C. tropicale和C. fioriniae引起枫香炭疽病的首次报道。
关键词 炭疽病;枫香;种类鉴定;系统发育分析
中图分类号 R379 文献标识码 A
Abstract Six morphologically different Colletotrichum strains were obtained during the investigation of Liquidambar formosana Hance leaf diseases in Fujian. The six strains were identified based on morphology (colony, acervuli, conidiophores and conidia) and multi-loci (ITS, TUB2, ACT, GAPDH and CHS-1) phylogenetic analyses. The six strains belonged to three Colletotrichum species, i.e., C. fructicola, C. tropicale and C. fioriniae, which belonged to Colletotrichum gloeosporioides complex and Colletotrichum actatum complex, respectively. The results from Kochs postulates supported the three Colletotrichum species could cause leaf anthracnose to Liquidambar formosana, and the pathogenecity of them was different. This is the first report of the three Colletotrichum species to cause leaf anthracnose on Liquidambar formosana.
Keywords anthracnose; Liquidambar formosana; identification; phylogenetic analyses
DOI 10.3969/j.issn.1000-2561.2019.11.014
枫香(Liquidambar formosana Hance)为金缕梅科枫香属植物,别名枫树,为落叶乔木,树干笔直高耸,适应性强,是优良的园林观赏树种和行道树种[1]。枫香在生长过程中容易发生病虫害,严重影响枫香的生长和观赏价值[2]。
2017年在福建霞浦杨家溪榕枫公园及福州森林公园的枫香叶片上发现了较为严重的叶部病害,导致枫香叶片在变黄或变红前就凋落,严重影响其观赏价值。我们在调查枫香叶部病害的过程中发现引起枫香叶部病害的病原菌不止1种,仅炭疽菌属就分离纯化得到了6株形态特征有差异的菌株。查阅文献发现,2000年Lu等[3]在《香港真菌列表》里报道过香港枫香上胶孢炭疽菌(Colletotrichum gloeosporioides)的有性阶段围小丛壳菌(Glomerella cingulata),2018年何学友和潘爱芳[2]在《中国枫香病虫害》一书中提到的未鉴定到种的炭疽菌属真菌就是本文中获得的菌株。
目前国际上通用的炭疽菌属的分类主要基于形态特征和多基因序列的系统发育分析,已确定了14个复合种和15个独立种[4-5]。有学者也多次报道在同一寄主上分布着不同炭疽菌,比如山茶属和辣椒上都发现了多种炭疽菌[6-7],但国内对枫香上的炭疽菌未见详细的报道[3]。本研究拟通过分离枫香叶部炭疽病的病原物,对病原物的形态特征进行观察和差异比对,结合病原物的致病性实验以及多基因序列的系统发育分析的方法,明确枫香叶部炭疽病病原的种类,以期为枫香炭疽病的防治提供参考依据。
1 材料与方法
1.1 材料
2017年9月,在福建霞浦杨家溪榕枫公园和福州森林公园(SLGY)采集枫香树的发病叶片,可以观察到2种主要的病斑特征,分别是褐斑及黑斑(图1),其中褐斑可以在叶片及叶柄(本研究中将叶片基部以下划分为叶柄)上观察到,并分别标记为HB及YB,而将黑斑标记为OHB(文中关于菌株的编号均参照此标记)。
1.2 方法
1.2.1 病原菌的分离、纯化及保存 在发病部位的病健交界处剪取大小约为1.5 mm×1.5 mm左右的叶片,将其放入75%的酒精中浸泡45 s取出,用无菌水冲洗3次,置于灭过菌的滤纸片上,吸干水分后,放入PDA培养基上,并置于26 ℃、光周期为12 h光暗交替的培养箱中培养,48 h后观察,如有菌丝从叶片组织周围长出,进行纯化,将纯化得到的纯菌落保存在PDA试管斜面,放置于4 ℃冰箱保存。
将获得的纯菌落用接种针挑取菌丝至PDA培养基上,封口后放于26 ℃,光周期为12 h的培养箱中继续培养6 d后,观察其菌落形态并测量记录其菌落直径的大小。培养7 d后,观察其是否产孢。如果产孢,制作临时水玻片,拿到显微镜下观察产孢结构和分生孢子等形态特征,并拍照、测量(孢子的长度和宽度)和记录(每株供试菌株测量30个孢子并求其平均值来确定该供试菌株孢子的大小)。如没产孢,将菌丝划断造成胁迫使其产孢,即用灭过菌的1 mL枪头在培养基上打孔(4~5个)后,将其放回培养箱培养1周后,观察到在孔口周围有橘黄色的孢子堆产生。此后的观察方法同上。
1.2.2 DNA粗提及PCR扩增 DNA提取采用真菌基因组粗提取法(1 mol/L Tris-HCL,pH 8.0,0.5 mol/L EDTA,20% SDS,5 mol/L NaCl),对获得的DNA进行多基因PCR扩增[ITS(ITS1和ITS4)[8-9],TUB2(BT2A和BT2B)[10],ACT(ACT-512F和ACT-783R)[11],GAPDH(GDF和GDR)[12],CHS-1(CHS-79F和CHS-345R)[11]],扩增后取5 ?L PCR产物加至1%的琼脂糖凝胶中电泳检测,当条带明亮清晰无杂带,且条带大小与所扩基因片段大小相同时,将扩增产物送至博尚公司测序。
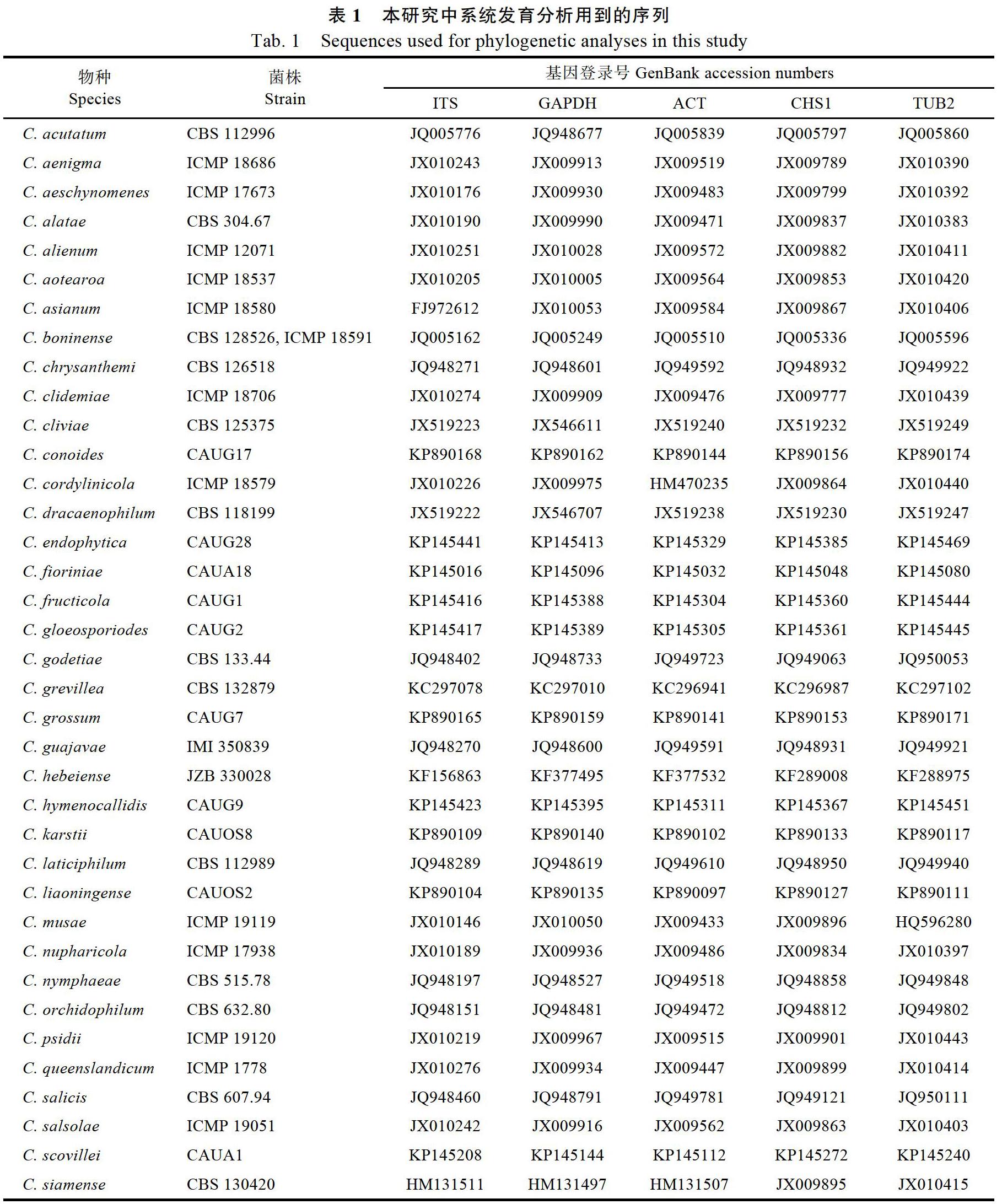
在BioEdit[13]中对获得的序列进行修正,将修正过的序列放入NCBI(https://blast.ncbi.nlm.nih. gov/Blast.cgi)中进行BLAST,得到初步的比对结果。根据已发表的文献,从NCBI中选取42个炭疽菌种的序列作为参考序列,加上本研究中获得的6个菌株的序列(表1),一起用于系统发育分析。用PhyloSuite[14]进行单基因序列的比对及多基因序列串联在一起后,分别使用IQ-tree[15]进行最大似然(maximum likelihood,ML)分析及使用MrBayes[16]进行贝叶斯(Bayesian inference,BI)分析,并将获得的不同系统发育树进行拓扑结构比较。最后用Figtree(https://www. softpedia.com/get/Science-CAD/FigTree-AR.shtml)对系统发育树进行注释。
1.2.3 致病性测试 为了确认所得菌株的致病性,取枫香的健康幼嫩叶片及成熟叶片(大小及叶片颜色相似)用自来水轻微冲洗后,用草纸吸干;将准备好的叶片放入准备好的培养皿中(皿内放有2张滤纸并已用水润湿),叶柄用棉花包裹后并将棉花润湿,培养皿内保持湿润但无积水;每株供试菌接5点,分别为叶片的3个叶尖、叶中及叶柄,每张叶片3个重复,用10 ?L枪头对叶片进行轻微造伤后,将打好的菌柄放于造伤处;盖好盖子后置于恒温光照培养箱中培养10 d(5 d后有病斑出现)后拍照记录,实验重复3次。同时对实验数据进行方差分析。
2 结果与分析
2.1 病原菌形态鉴定
本研究从感病的枫香叶片及叶柄分离得到6株炭疽菌菌株,其具体形态特征见图2和表2。根据菌落的性状、产孢结构、分生孢子梗、分生孢子等形态特征将6个菌株分为3组,即FX HB 2、FX HB SLGY 2、FX YB 3和FX HB 3分为第1组,FX OHB 1 2为第2组,而FX YB SLGY 2为第3组。通过与已知的炭疽菌种进行比较发现,前2组的形态特征(分生孢子盘褐色,有时在盘中央可见锥刺状褐色刚毛;分生孢子无色、单胞、表面光滑、棍棒状、两端稍钝圆)与胶孢炭疽复合种(Colletotrichum gloeosporioides species complex)的形态特征相似[17],其中,第1组与果生炭疽菌C. fructicola的描述相符,第2组与热带炭疽菌C. tropicale的描述相符[18];第3组的形态特征(分生孢子无色,单胞,表面光滑,似梭形,两端稍钝)与尖孢复合种(Colletotrichum acutatum species complex)松针炭疽菌C. fioriniae的描述相符[19]。
2.2 病原菌序列系统发育分析
单基因序列分析(ACT,CHS-1,GADPH,ITS,TUB2)和多基因序列联合(5个基因位点串联)分析得到的系统发育树拓扑结构相似,但是多基因序列分析得到的系统发育树部分分支的支持率(SH-aLRT≥75%,bootstrap support≥95%)更高。本研究采用多基因序列分析(图3)。从图3可以看出,第1组和第2组的菌株分布在胶孢炭疽复合种(Colletot?ri???chum gloeosporioides complex),第1组的菌株与果生炭疽菌C. fructicola聚在一起,支持率分别为97和100;第2组的菌株与热带炭疽菌C. trop?icale聚在一起,支持率分别为74%和95%。第3组的菌株与尖孢炭疽复合种(Colletotrichum acu???ta?tum complex)的松针炭疽菌C. fioriniae聚在一起,支持率分别为99%和100%。从上述结果来看,系统发育分析的结果支持了形态鉴定。
2.3 病原菌致病性测试
3 讨论
目前国际通用的炭疽菌属真菌分类鉴定的方法,主要是结合形态学与分子系统发育学(多基因位点的系统发育分析),即比较形态特征(包括菌落大小、颜色,无性态与有性态的产孢结构和孢子形态特征,以及有无刚毛等)的分类与多基因序列组合分析得到的系统发育树的拓扑结构,从而选择对不同复合种进行系统发育分析的最适基因位点[17, 20-21]。但对于不同的复合种(species complex),所用的基因位点有所不同,比如:在胶孢炭疽复合种(Colletotrichum gloeosp?orio?ides complex)的研究中运用到了ITS、GAPDH、CAL、ACT、CHS-1、GS、SOD2和TUB2等8个基因位点[17],在博宁炭疽复合种(Colletotr?i?chu?m boninense complex)的研究中运用到了ITS、ACT、TUB2、CHS-1、GAPDH、HIS3以及CAL等7个基因位点[21],而对于尖孢炭疽复合种(Colletotrichum acutatum complex)的研究,前人则运用ITS、ACT、TUB2、CHS-1、GAPDH、HIS3等6个基因位点[22]。本文运用了形态学与多基因序列系统发育分析相结合的方法,因为对于不同的复合种运用的基因位点既有相同的位点也有不同的位点,并且在本研究中是将胶孢炭疽复合种和尖孢炭疽复合种放在一块儿分析,所以就选取了ACT、CHS-1、GAPDH、TUB2、ITS等5个基因位点对分离到的6个炭疽菌菌株进行分析,并将引起枫香炭疽病的6个炭疽菌菌株具体鉴定到3个种,即胶孢炭疽复合种(Colletotrichum gloeosporioides complex)的果生炭疽菌C. fructicola和热带炭疽菌C. tropicale,以及尖孢炭疽复合种(Colletotrichum acutatum complex)的松针炭疽菌C. fioriniae。这2个复合种的多基因系统发育分析得到系统发育树的拓扑结构跟中国辣椒上炭疽病菌[7]的研究报道相似。这也驗证了本文中系统发育树的准确性。
前人多次報道在同一寄主上分布不同炭疽菌,比如山茶属和辣椒上都发现了多种炭疽菌,常见的炭疽菌种类包括松针炭疽菌C. fioriniae、果生炭疽菌C. fructicola、胶孢炭疽菌C. gloeosporioides等[6-7],除此之外,像辣椒炭疽菌Colletotrichum capsici不仅存在于辣椒上,在南瓜上也有发现[23]。因此有些炭疽菌并不是某些植物上特有的,这说明多种炭疽菌在同一种植物上出现的可能性很大,但有些炭疽菌有寄主偏好性。因为之前鉴定手段的局限性,枫香上只报道过胶孢炭疽菌的有性阶段围小丛壳[3],本文在此基础上,进一步对枫香炭疽病的病原菌种类进行了鉴定,首次报道枫香上的3种不同炭疽菌,即果生炭疽菌C. fructicola、热带炭疽菌C. tropicale和松针炭疽菌C. fioriniae。虽然同一寄主上有不同的炭疽菌,大部分都可以致病,但不同炭疽菌在同一寄主上的致病性也是有差异的。例如,在对梨属(Pyrus)植物上的炭疽菌进行研究时,致病性实验的结果表明,胶孢炭疽复合种、尖孢炭疽复合种和博宁炭疽复合种的炭疽菌在致病性上存在差异,如生炭疽菌C. fructicola对梨的果实和叶片的致病性高于松针炭疽菌C. fioriniae[24]。与本文的研究结果相一致,即对于枫香的叶片及叶柄而言,果生炭疽菌C. fructicola和热带炭疽菌C. tropicale引起的病斑比松针炭疽菌C. fioriniae引起的病斑大。
在已报道的研究中,多数病原菌接种实验都是用孢子悬浮液[24],对不产孢的菌株,则用菌丝块接种。本文中使用菌丝块做致病性实验,3次重复的结果显示,对于叶片的接种而言,果生炭疽菌C. fructicola、热带炭疽菌C. tropicale和松针炭疽菌C. fioriniae引起的病斑大小差异较小,但是3个种在叶柄上的接种结果差异比较大。为了提高致病性实验的准确性,在后续的研究过程中,会找出促进文中3种炭疽菌的最适产孢方式并进行孢子悬浮液接种,从而更好地比较果生炭疽菌C. fructicola、热带炭疽菌C. tropicale和松针炭疽菌C. fioriniae 3种炭疽菌的致病力。
参考文献
[1] 张云霞, 鲁海菊, 陈润琼, 等. 草果叶斑病和枫香干腐病的病原菌鉴定[J]. 云南农业大学学报, 2005, 20(3): 438-440.
[2] 何学友, 潘爱芳. 中国枫香病虫害[M]. 北京: 中国林业出版社, 2018.
[3] Lu B, Hyde K D, Ho W H, et al. Checklist of Hong Kong Fungi[M]. Hong Kong: Fungal Diversity Press, 2000.
[4] Marin-felix Y, Groenewald J Z, Cai L, et al. Genera of phytopathogenic fungi: GOPHY 1[J]. Studies in Mycology, 2017, 86: 99-216.
[5] Damm U, Sato T, Alizadeh A, et al. The Colletotrichum dracaenophilum, C. magnum and C. orchidearum species complexes[J]. Studies in Mycology, 2019, 92: 1-46.
[6] Liu F, Weir B S, Damm U, et al. Unravelling Colletotrichum species associated with Camellia: employing ApMat and GS loci to resolve species in the C. gloeosporioides complex[J]. Persoonia, 2015, 35: 63-86.
[7] DiaoY Z, Zhang C, Liu F, et al. Colletotrichum species causing anthracnose disease of chili in China[J]. Persoonia, 2017, 38(1): 20-37.
[8] Grades M, Bruns T D. ITS primers with enhanced specificity for basidiomycetes-application to the identification of mycorrhizae and rusts[J]. Molecular Ecology, 1993, 2(2): 113-118.
[9] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H, Sninsky J J, et al. PCR Protocols: a guide to methods and applications. San Diego, USA: Academic Press, 1990, 38: 315–322.
[10] Glass N L, Donaldson G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323-1330.
[11] Carbone I, Kohn L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999, 91(3): 553-556.
[12] Templeton M D, Rikkerink E H, Solon S L, et al. Cloning and molecular characterization of the glyceraldehyde-3- phosphate dehydrogenase-encoding gene and cDNA from
the plant pathogenic fungus Glomerella cingulata[J]. Gene (Amsterdam), 1992, 122(1): 225-230.
[13] Hall T A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series, 1999, 41: 95-98.
[14] Zhang D, Gao F, Li W X, et al. PhyloSuite: an integrated and scalable desktop platform for streamlined molecular sequence data management and evolutionary phylogenetics studies[J/OL]. Molecular Ecology Resources, 2019, doi:org/10.1111/1755-0998.13096
[15] Nguyen L T, Schmidt H A, Von Haeseler A, et al. IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies[J]. Molecular Biology and Evolution, 2015, 32(1): 268-274.
[16] Huelsenbeck J P, Ronquist F. MRBAYES: Bayesian inference of phylogenetic trees[J]. Bioinformatics, 2001, 17(8): 754-755.
[17] Weir B S, Johnston P R, Damm U. The Colletotrichum gloeosporioides species complex[J]. Studies in Mycology, 2012, 73(1): 115-180.
[18] Rojas E I, Rehenr S A, Samuels G J, et al. Colletotrichum gloeosporioides s.l. associated with Theobroma cacao and other plants in Panama: multilocus phylogenies distinguish host-associated pathogens from asymptomatic endophytes [J]. Mycologia, 2010, 102(6): 1318-1338.
[19] Shivas R G, Tan Y P. A taxonomic re-assessment of Colletotrichum acutatum, introducing C. fioriniae comb. et stat. nov. and C. simmondsii sp. nov.[J]. Fungal Diversity, 2009, 39: 111-122.
[20] Sharma G, Pinnaka A K, Shenoy B D. Resolving the Colletotrichum siamense species complex using ApMat marker[J]. Fungal Diversity, 2014, 71(1): 247-264.
[21] Damm U, Cannon P F, Woudenberg J H, et al. The Colletotrichum boninense species complex[J]. Studies in Mycology, 2012, 73(1): 1-36.
[22] Damm U, Cannon P F, Woudenberg J H, et al. The Colletotrichum acutatum species complex[J]. Studies in Mycology, 2012, 73(1): 37-113.
[23] Chai A L, Zhao Y J, Shi Y X, et al. Identification of Colletotrichum capsici ( Syd.) Butler causing anthracnose on pumpkin in China[J]. Canadian Journal of Plant Pathology, 2014, 36(1): 121-124.
[24] Fu M, Crous P W, Bai Q, et al. Colletotrichum species associated with anthracnose of Pyrus spp. in China[J]. Persoonia, 2019, 42: 1-35.
