Snail在肿瘤中的研究进展
2019-12-19蔡东京李敏胡成平
蔡东京 李敏 胡成平
中南大学湘雅医院呼吸内科(呼吸与危重症医学科) 国家临床重点专科,长沙410008
Snail家族是锌指蛋白家族的一个分支,包括Snail(Snail1)、Slug(Snail2)、Smuc(Snail3)。 在 人 体 中,Snail主要表达于胎盘,胚胎中胚层,成人心、肝、骨骼肌及某些未分化组织中[1-2]。Snail是一种半衰期为25~180 min、易于降解的蛋白质,由264个氨基酸构成,相对分子质量为29 100,基因位于20q13.2,其羧基端是锚定区域,包括4~6个C2H2锌指结构,可以特异性的和靶基因启动子的E-box系列(CAGGTG)结合;氨基端为功能区域,是一个进化上相对保守的SNAG(Snail/Gfi)结构域,可以抑制靶基因的转录[3]。本文主要对Snail(Snail1)的结构和功能进行综述。
1 Snail在肿瘤细胞中的表达
根据近年研究,Snail在乳腺癌、胃癌、结肠癌、非小细胞肺癌(non-small cell lung cancer,NSCLC)、黑色素瘤等肿瘤中均有报道[4-9]。2019年,Sonego等[10]发现,在接受铂类联合化疗的卵巢癌患者中,USP1及其下游分子Snail的表达与患者的总生存期和无进展生存期密切相关。在接受手术切除的NSCLC患者标本检测中发现55.2%具有Snail的高表达,Snail高表达患者的总生存时间及无复发生存时间差于Snail低表达的患者,它和HIF-1α、TWIST1一起成为NSCLC术后预后的重要分子[11]。Miyoshi等[12]研究发现,54.5%的肿瘤切除患者在1年后肝脏肿瘤复发,这些患者肿瘤组织中均检测到高Snail基因的表达。高Snail的表达为手术后肿瘤较早(<1年)复发的独立危险因素之一,是术后判断患者预后的一个重要参考因素。近年来对Snail分子在肿瘤中作用的研究越来越多,因其在不同肿瘤组织中的表达及作用机制不尽相同,关于Snail在肿瘤中的作用还需要继续探索。
2 Snail与肿瘤的发生、发展
肿瘤的形成是一个较为复杂的过程。在乳腺癌中,异常表达的Snail可以促进肿瘤细胞生成乳腺球,增加乳腺上皮细胞的生成、种植和干细胞标志分子的表达,这个过程与Wnt、Notch、hedgehog、Bmi-1等信号通路的激活密切相 关[13-16]。 在 卵 巢 癌 中,Snail可 以 促 进NANOG、HDAC1、TCF4、KLF4、HDAC3和GPC3等细胞干性相关性分子的表达,促进肿瘤干细胞(cancer stem cell,CSC)的CD44+和CD117+的表达,提高肿瘤细胞和辅助细胞的再生能力,促进肿瘤的发生、发展[17](表1)。目前我们虽然对Snail在肿瘤发生中的作用有一定的研究,但还没有一个系统的认识,Moon等[18]对各种小鼠肝癌模型的肿瘤发生过程进行研究后发现,在HRASG12V+shp53诱导的肝癌模型中同时检测到pSmad2/3和Snail的表达增加,在人为降低Snail表达后HRASG12V+shp53诱导肝癌模型的形成受阻;在S7HP肝癌模型中,TGF-β抑制剂造成的肝癌形成抑制效应可被异常增多的Snail逆转,进一步证明了Snail分子在肝癌形成中的重要作用。Julien等[19]发现,果蝇中的核因子κB(nuclear factor kappa B,NF-κB)同族蛋白可以结合到Snail基因启动子的-194 and-78 bp上,上调Snail基因的转录;同时NF-κB能够通过CSN2结合到Snail分子上,竞争GSK-3β和β-Trcp与Snail分子结合,减少Snail分子的降解,促进肿瘤的发生。Snail与肿瘤发生的关系虽然已经有了一些证据,但具体的分子机制仍然不清楚,值得进一步的探索。
3 Snail调控上皮间质转化(epithelial mesenchymal transition,EMT)与肿瘤转移
目前认为EMT是肿瘤转移的重要部分。发生EMT后的肿瘤细胞不仅自身细胞的功能和形态发生改变,肿瘤组织中的微环境也随之改变。EMT是上皮细胞向间皮细胞转化的过程,它发生在胚胎发育、肿瘤、慢性炎症和纤维化等过程中[20]。EMT的改变主要表现在细胞形态和功能上,发生EMT的上皮细胞之间丢失了联系,与基底膜的连接也变得松散,失去了极性,自身也从立方形转化为多边形,拥有了间皮细胞的部分特性[21-22]。EMT分为3型:Ⅰ型主要在胚胎发育期,参与中胚层的发育和器官形成;Ⅱ型主要发生在组织损伤和持续炎症刺激的情况下,常常伴有纤维化和器官重塑;Ⅲ型主要发生在网状基底膜,伴有新生血管增生和纤维化,同时出现特征性的EMT标志物,如:E-cadherin、Vimentin等,肿瘤细胞发生的EMT属于此型[23]。
Snail是EMT的关键分子,Snail的异常表达可以促进肿瘤上皮细胞向间质细胞转化,增强细胞的运动、侵袭能力,同时也会促进肿瘤细胞获得干性,使其具备较强自我更新、分化能力,促进细胞的迁移[24]。此外,Snail也会刺激肿瘤相关性成纤维细胞(cancer-associated fibroblasts,CAFs)、CSC等生成,诱导肿瘤细胞分化,改变间质的环境,协助肿瘤细胞的迁徙[25-26]。在肿瘤细胞的EMT过程中,Snail可以招募去乙酰化酶和甲基化酶PRC2结合到E-cadherin启动子上,使组蛋白甲基化,抑制E-cadherin的表达,同 时,Snail诱 导 的ZEB1也 可 以 招 募PRC2到E-cadherin启动子上,抑制E-cadherin表达,缺乏E-cadherin的上皮细胞黏附能力下降,易于游走[27-31]。此外,基质金属蛋白酶(matrix metallo proteinases,MMPs)是一种能够降解基底膜的金属蛋白酶,Snail可以增强MMP2、MMP9等表达,破坏上皮与间质之间的间隔,打开上皮细胞向下迁徙的天然屏障,促进上皮细胞的迁移;MMPs也可以增加间质通透性,增强细胞在组织中的机动能力[32-34]。
在EMT过程中,Snail也受到很多信号的调控。TGF-β是EMT的一个调控分子,其介导的TGF-β/Smad/Snail通路对Snail表达起着重要作用,TGF-β与Ⅰ型和Ⅱ型受体结合后,使Smad3、4磷酸化,磷酸化后的Smad和转录辅助因子结合到Snail基因启动子上,促进Snail的表达;TGF-β也会诱导H MGA2复合物的生成,直接促进Snail基因表达[35-39]。此外,Wn T和配体(Wnt1或Wnt3a)结合后与膜表面受体(由Frizzled和LDL受体相关蛋白LRP5/6构成)作用,激活β-catenin,抑制GSK-3β的活性,减低Snail的泛素化降解[40]。在RAS通路中,RAS激动后,活化下游的RAF/ERK、PI3K/AKT通路,抑制GSK-3β的活性,减少Snail的降解,RAS通路也可产生HMGA2复合物,直接促进Snail的表达,促进EMT[41-44]。
翻译后的修饰调控对Snail的功能也有很大的影响。在细胞中,Snail分子是一种极其不稳定的蛋白质,其在细胞中的半衰期较短,翻译加工后的大部分Snail蛋白在入核前会受到磷酸化、泛素化、乙酰化等化学修饰,经蛋白酶体降解系统降解[45]。有研究报道,TGF-β/Smad通路中的表达产物GSK-3β使Snail的第一、二磷酸化位点磷酸化,进而结合β-Trcp和泛素分子,启动泛素依赖的蛋白酶体降解过程,减少Snail入核发挥功能[46-47]。Lee等[48]发现,A20可以使Snail分子寡泛素化,降低Snail与GSK-3β的亲和力,抑制Snail分子的降解。Zhu等[49]在食管鱗状细胞癌中的研究发现,PSMD14可以使Snail分子去泛素化,加强其在细胞质中的稳定性,促进肿瘤细胞转移。在Snail的泛素化与去泛素化调控过程中还有许多其他分子的参与,比如:CYLD、USP16、OTUB1等,它们在Snail的入核前调控中扮演着重要的作用,对Snail介导的EMT和肿瘤转移发挥起着举足轻重的作用(图1)。
4 Snail与肿瘤耐药
4.1 Snail通过通过各种信号网络调控肿瘤细胞的耐药性Bonavida和Baritaki[50-51]认为肿瘤细胞中NF-κB/Snail/YY1/RKIP调控网络的失衡使得细胞凋亡程序关闭,细胞存活相关信号通路激活。在产生耐药的肿瘤细胞中可发现RKIP的表达降低,NF-κB、Snail、YY1表达增多,RKIP对Raf/MEK/ERK和NF-κB的通路抑制作用降低,下游的细胞生存通路活化,产生耐药。进一步研究发现,NO可以促进RKIP的表达,加强凋亡信号的强度,降低细胞的药物抗性。在顺铂耐药的研究中发现,AKT/β-catenin/Snail、STAT3/Snail等信号通路激活后促进Snail的表达,异常表达的Snail加强ERCC1、DYRK2等基因的表达水平,促进肿瘤细胞对顺铂的抵抗[52]。Maseki等[53]报道在头颈部的鳞状细胞癌中,吉非替尼耐药的肿瘤细胞可以通过激活AKT/GSK-3β/Snail通路,减少膜上EGFR的表达量来实现耐药。Li等[54]在小鼠结直肠癌研究中发现,Snail阳性的肿瘤相关成纤维细胞可以诱导结直肠癌对5-氟尿嘧啶和紫杉醇耐药,其中机制可能和CCL1介导的TGF-β和NF-κB通路激活有关。Zhou等[55]发现经吉西他滨治疗后的肺癌细胞中由于缺失Scribble导致p38 MAPK通路激活,从而促进Hu R易位,增加Snail m RNA的转录,增强Snail的表达,导致肺癌细胞对吉西他滨的耐药。

表1 细胞干性相关的细胞通路和效应分子
4.2 Snail与肿瘤相关成纤维细胞、外泌体在耐药中的作用 CAFs是存在于肿瘤间质的一种肿瘤辅助细胞,有“基质母细胞”之称[56]。Herrera等[57]在对13例结肠癌患者肠道黏膜CAFs的研究发现,CAFs中Snail的表达高于正常成纤维母细胞,它可以通过旁分泌的方式介导肿瘤细胞的耐药形成。Richards等[58]研究发现,在胰腺肿瘤中经吉西他滨治疗后的CAFs可分泌出大量包含Snail mRNA的外泌体,外源性的Snail m RNA进入靶细胞后可以大量表达Snail分子,促进靶细胞发生耐药;同时吉西他滨的代谢物也可入核促进HIF-α的表达,HIF-α进而促进Snail基因表达发挥耐药作用。在食管癌中,被辐射后的T细胞可以分泌外泌体作用于肿瘤细胞,通过激活肿瘤细胞中β-catenin和NF-κB/Snail通路启动EMT,促进肿瘤细胞的迁移[59]。
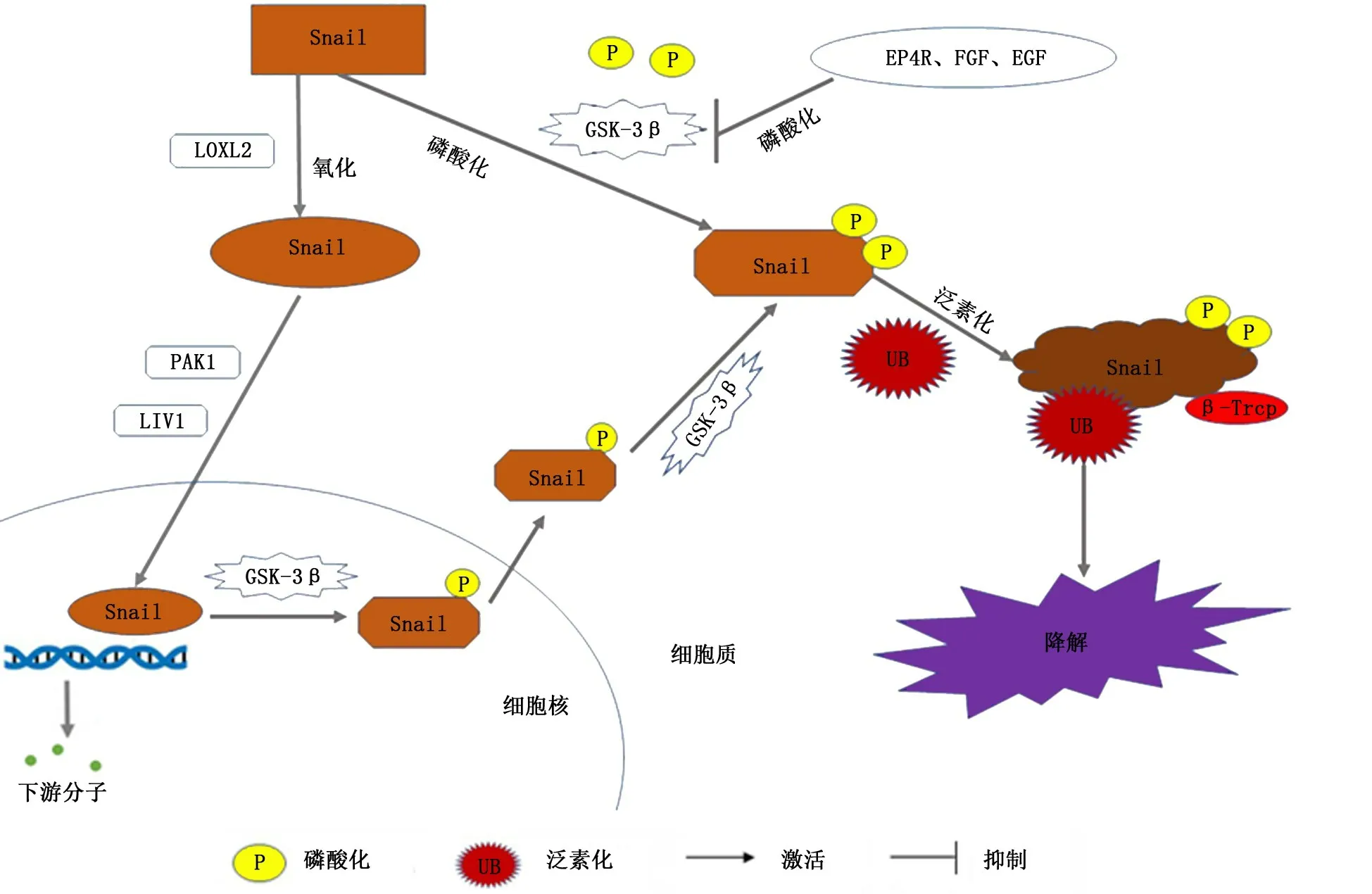
图1 Snail转运及泛素化降解调控
5 展望
Snail在EMT、细胞干性、肿瘤发生、转移和耐药等方面发挥着重要的作用,是潜在的临床肿瘤治疗靶点和预后分子。希望在人们不断的探索之后,最终能够使它真正的为人所用,造福人类。
利益冲突所有作者均声明不存在利益冲突
