血清S100A2和S100A6浓度对非小细胞肺癌患者诊断价值
2019-12-19杨莹吴小玲邓治平
杨莹 吴小玲 邓治平
自贡市第一人民医院呼吸内科643000
肺癌是全球癌症死亡主要原因之一,早期肺癌缺乏特异性症状和诊断标志物。痰细胞学和低剂量计算机断层扫描是诊断和筛查早期肺癌的主要手段,组织学活检是肺癌诊断的主要依据[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)占所有肺癌病例的85%,诊断时常处于中晚期,导致预后不佳。探讨NSCLC非侵入性血清标志物对NSCLC早期诊断尤为重要[2]。
S100蛋白家族包含25个钙结合蛋白,其多个成员参与炎症反应和细胞周期进程,在细胞分化、侵袭和上皮-间质转化(epithelial-mesenchymal transition,EMT)过程中发挥重要作用[3]。S100A2是S100蛋白家族重要成员之一,在早期NSCLC患者中,其表达水平增加,且与NSCLC患者预后不良相关[4]。S100A6是S100蛋白家族另一个成员,在NSCLC、肝细胞癌和急性白血病患者中观察到细胞质S100A6表达增加[5]。S100A6蛋白参与细胞周期调节、细胞内钙稳态和信号传导、细胞凋亡、细胞骨架重排和泛素化蛋白降解[6]。采用免疫组织化学或蛋白质印迹法均可在NSCLC中检测到S100A2和S100A6蛋白异常表达,而NSCLC患者血清中S100A2和S100A6蛋白浓度及其临床意义国内外尚无报道。本研究采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检查新诊断的原发性NSCLC患者和健康受试者的血清中S100A2和S100A6蛋白浓度,并评估其临床诊断价值。
1 对象与方法
1.1 研究对象 本研究纳入自2018年1月至12月自贡市第一人民医院呼吸内科共招募最新诊断且组织学证实为原发性NSCLC患者141例为NSCLC组。所有患者均获得病理诊断资料,并根据TNM分期第八版进行分类[7]。纳入标准:病理组织学诊断为NSCLC,未接受任何放化疗。排除标准:存在NSCLC外其他恶性肿瘤。选取同时间段在自贡市第一人民医院进行常规年度健康检查年龄和性别相匹配健康个体150名作为健康对照组。健康对照组受试者不存在恶性肿瘤,并且没有任何肿瘤家族史。本研究通过自贡市第一人民医院伦理委员会批准(CL2017120941),所有参与研究的受试者均签署知情同意书。
1.2 方法 采用标准化问卷从参与研究者中收集年龄、性别、吸烟状态、肿瘤分期、组织学类型、分化状态等信息。
1.2.1 血清样本收集 采集所有参与研究者空腹静脉血8 ml,4℃以1 500×g离心10 min,分离得到血清,将血清样品在冷冻管中分成100μl等分试样,储存在-80℃直到统一分析。
1.2.2 血清S100A2和S100A6蛋白浓度检测采用ELISA法检测研究对象血清中S100A2和S100A6蛋白浓度,ELISA试剂盒购自武汉联合生物技术公司。人S100A2蛋白ELISA试剂盒(目录号:SEC009 Hu)和人S100A6蛋白ELISA试剂盒(目录号:SEB769Hu),严格按照说明书操作检测S100A2和S100A6蛋白浓度。S100A2灵敏度为0.124μg/L,测 范围为0.312~20μg/L;S100A6灵敏度为32 ng/L,测定范围为78~15 000 ng/L。针对每份血清样本检测3次,取平均值作为最终分析数据。
1.3 统计学分析 采用SPSS 20.0软件进行统计分析。计量资料以表示,计数资料以例数(百分比)表示;采用t检验和χ2检验比较NSCLC组和健康对照组之间差异,多组之间比较采用单因素方差分析。受试者工作特征(receiver operating characteristic,ROC)曲线分析血清S100A2和S100A6蛋白浓度对NSCLC的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 NSCLC组共141例,其中男111例,女30例;年龄(61.11±0.74)岁,年龄范围为39~75岁。健康对照组共150名,其中男114名,女36名;年龄(60.57±0.55)岁,年龄范围为40~74岁。2组患者性别和年龄比较,差异均无统计学意义(P值均>0.05)。健康对照组和NSCLC组吸烟比较,差异有统计学意义(60例比105例,χ2=35.171,P=0.03)。NSCLC组中腺癌71例(50.4%),鳞状细胞癌70例(49.6%);TNM分 期Ⅰ期16例(11.3%),Ⅱ期14例(9.9%),Ⅲ期46例(32.6%),Ⅳ期65例(46.1%);高分化10例(7.1%),中分 化67例(47.5%),低分化64例(45.4%)。
2.2 血清S100A2/A6浓度比较 NSCLC组患者血清S100A2浓度高于健康对照组(t=3.794,P<0.001);NSCLC组患者血清S100A6浓度高于健康对照组(t=70.320,P<0.001),见表1。
表1 2组患者血清S100A2和S100A6蛋白浓度比较()
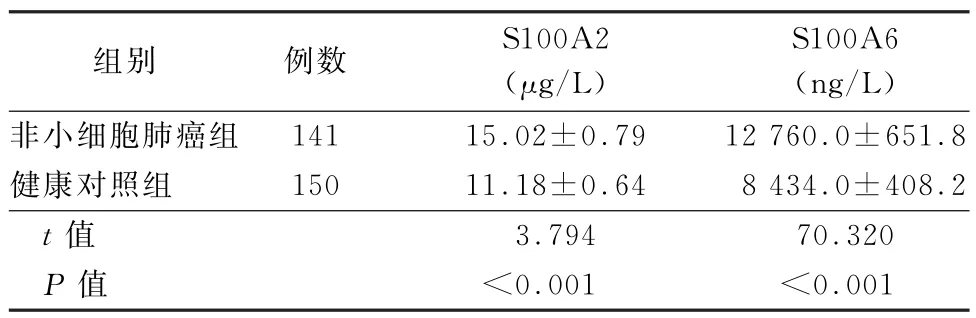
表1 2组患者血清S100A2和S100A6蛋白浓度比较()
组别 例数 S100A2(μg/L)S100A6(ng/L)非小细胞肺癌组141 15.02±0.79 12 760.0±651.8健康对照组 150 11.18±0.64 8 434.0±408.2 t值 3.794 70.320 P值 <0.001 <0.001
2.3 NSCLC患者不同TNM分期血清S100A2和S100A6浓度比较 早期(Ⅰ+Ⅱ期)NSCLC患者和晚期(Ⅲ+Ⅳ期)NSCLC患者血清S100A2浓度均高于健康对照组(P值均<0.05);早期(Ⅰ+Ⅱ期)NSCLC患者和晚期(Ⅲ+Ⅳ期)NSCLC患者血清S100A6浓度均高于健康对照组(P值均<0.05),见图1、2。
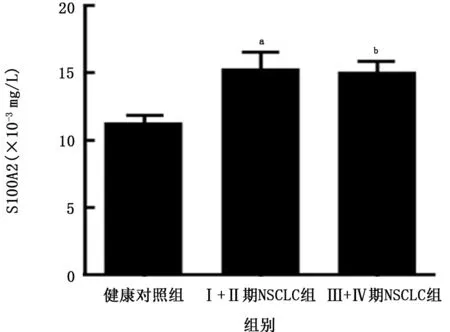
图1 不同TNM分期NSCLC组与健康对照组血清S100A2蛋白浓度比较
2.4 血清S100A2和S100A6蛋白浓度对NSCLC诊断价值 采用ROC曲线评估血清S100A2和S100A6蛋白浓度对NSCLC患者和健康志愿者诊断区分能力。当cut-off值为13.81μg/L时,血清S100A2浓度区分NSCLC与健康对照者的曲线下面积(area under curve,AUC)为0.696,特异度为82.0%,敏感度为59.3%;当cut-off值为10 152 ng/L时,血清S100A6浓度区分NSCLC与健康对照者的AUC为0.738,特异度为64.0%,敏感度为61.7%(图3、4)。进一步分析显示,血清S100A2蛋白浓度cut-off值为12.42μg/L;其区分Ⅰ+Ⅱ期NSCLC与健康对照者ROC曲线的AUC为0.708,特异度为71.8%,敏感度为75.0%;血清S100A6蛋白浓度cut-off值为16 829 ng/L时,其区分Ⅰ+Ⅱ期NSCLC与健康对照者ROC曲线的AUC为0.702,特异度为99.6%,敏感度为42.9%。
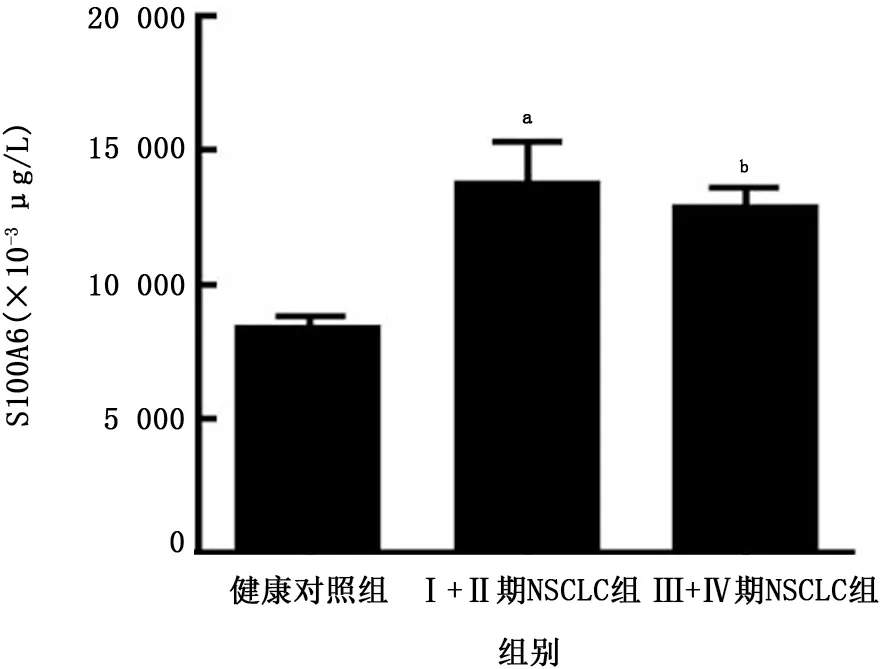
图2 不同TNM分期NSCLC组与健康对照组血清S100A6蛋白浓度比较
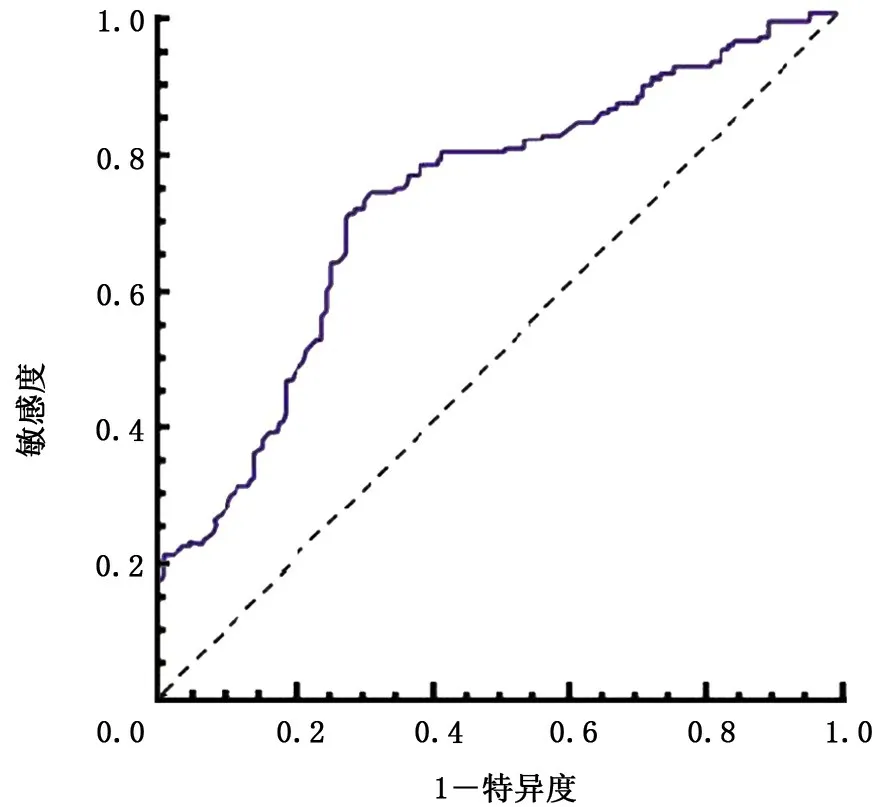
图3 血清S100A2蛋白浓度诊断非小细胞肺癌的ROC曲线
2.5 血清S100A2和S100A6蛋白浓度与NSCLC患者临床参数相关性 NSCLC患者血清中S100A2和S100A6浓度与患者的年龄、性别、吸烟状况、组织学、TNM分期和分化状态均无相关性(P值均>0.05),S100A2和S100A6浓度与患者肿瘤大小有相关性(r=0.89、0.91,P值均<0.05),见表2。

图4 血清S100A6蛋白浓度诊断非小细胞肺癌的ROC曲线
3 讨论
NSCLC是癌症死亡主要原因之一,导致其预后不佳的重要原因之一为患者诊断时常处于中晚期,无法手术完全治愈。NSCLC患者缺乏有效的非侵入性生物标志物用于早期诊断[8]。本研究探讨血清S100蛋白家族S100A2和S100A6在NSCLC诊断和早期检测中的临床价值。
本研究发现NSCLC患者血清中S100A2和S100A6蛋白浓度均显著高于健康对照者,进一步证实S100A2和S100A6蛋白家族参与了NSCLC发生和进展病理生理过程。S100蛋白家族包含25个已知成员,每个成员由一个单独的基因编码,其中22个基因聚集在染色体位点1q21[9]。与钙离子结合后,大多数S100蛋白经历构象变化,与各种蛋白质靶标相互作用,发挥广泛的细胞内和细胞外功能[10]。S100蛋白家族成员S100A2和S100A6与包括肺癌在内的多种癌症有关。最新研究报道S100A2通过诱导EMT过程而增加A549肺癌细胞系的侵袭能力,细胞增殖能力和Akt磷酸化,调节TGF-β/Smad-3过程,促进肿瘤靶基因的转录活性[10]。Diederichs等[11]最先发现S100A2蛋白在早期NSCLC组织中过度表达,且与NSCLC患者转移密切相关;S100A2蛋白高m RNA表达水平与手术切除的NSCLC患者的生存率低有关[12]。本研究发现NSCLC患者血清S100A2蛋白浓度显著高于健康对照者,与上述结果一致。S100A6最初被鉴定为在急性白血病中上调,并且与肺癌、结肠癌的预后和转移风险有关[13]。S100A6在胰腺癌中诱导EMT并促进β-catenin依赖性细胞迁移和侵袭[14]。S100A6被证明与p53相互作用并增强p53转录活性,从而促进p53的凋亡作用。在NSCLC中,He等[15]报道S100A6在25%的早期NSCLC中表达阳性,而正常肺组织中表达阴性,本研究中也进一步发现早期NSCLC患者血清中S100A6蛋白浓度增加。另一方面,其他肿瘤研究也有报道称肿瘤患者血清中S100A2和S100A6蛋白增高,因此,这2种指标在应用时需校正其特异性。
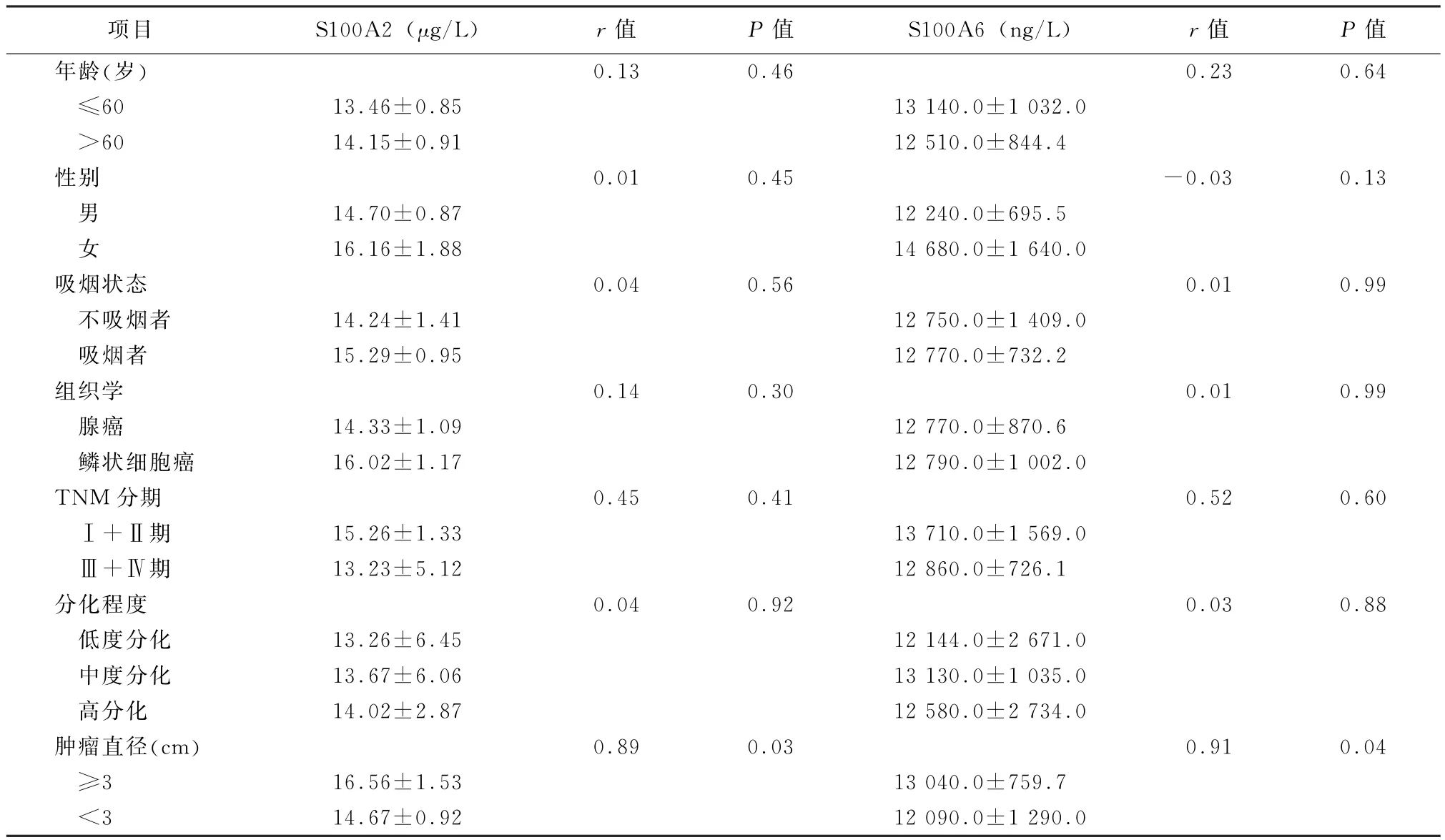
表2 血清S100A2和S100A6蛋白与非小细胞肺癌患者临床参数相关性
本研究发现血清S100A2和S100A6蛋白浓度可有效区分NSCLC与健康受试者,且ROC曲线分析显示获得良好的诊断效能:S100A2蛋白诊断NSCLC的AUC为0.696,特异度为82.0%,敏感度为59.3%,S100A6蛋白诊断NSCLC的AUC为0.738,特异度为64.0%,敏感度为61.7%,提示2种蛋白可帮助临床医师检测NSCLC。但对于早期(Ⅰ+Ⅱ期)NSCLC患者,S100A6蛋白诊断NSCLC的敏感度为42.9%,低敏感度降低了其对早期肺癌筛查的临床价值。鉴于NSCLC非侵入性分子标志物较少,其与NSCLC其他分子标志物,如癌胚抗原、神经元特异性烯醇化酶和细胞角蛋白19片段联合检测的临床意义值得进一步研究。
本研究发现血清S100A2和S100A6蛋白浓度与NSCLC患者临床病理参数中肿瘤转移和组织学类型无相关性,其提示血清S100A2和S100A6蛋白可能无法提示NSCLC患者肿瘤转移状态和组织学类型。血清S100A2和S100A6蛋白浓度均与肿瘤大小有相关性,尽管机制尚不清楚,其可能原因与肿瘤负荷相关,尚需要进一步研究。
本研究存在不足之处:(1)本研究为单中心研究,纳入病例数目较少,尚需要多中心大量病例研究证实本研究结果;(2)本研究并未探讨NSCLC患者血清S100A2和S100A6增加精确分子机制;(3)本研究并未探讨血清S100A2和S100A6蛋白浓度和其他NSCLC肺癌分子标志物之间的关系。
综上所述,NSCLC患者血清S100A2和S100A6蛋白浓度显著高于健康对照者,与肿瘤大小密切相关,血清S100A2和S100A6蛋白均存在良好的诊断NSCLC效能,是潜在NSCLC分子标志物。
利益冲突所有作者均声明不存在利益冲突
