北沙参多糖复合酶提取工艺及理化性质研究
2019-12-19景永帅张丹参张瑞娟刘东波郑玉光吴兰芳
景永帅 - 张丹参 - 张瑞娟 - 韩 钰 刘东波 - 郑玉光 - 吴兰芳 -
(1. 河北科技大学化学与制药工程学院,河北 石家庄 050018;2. 河北中医学院药学院,河北 石家庄 050200)
北沙参为伞形科植物珊瑚菜(GlehniaLittoralisFr. Schmidt ex Miq.)的干燥根,是传统的名贵药材和药食同源物品,具有滋阴清肺、益胃生津等功效[1-2]。其有效成分主要为香豆素类、聚炔类及多糖类物质,其中多糖类含量最高,具有抗氧化和调节免疫等功能[3-4]。
北沙参多糖提取方法主要有热水回流提取法[5]、微波辅助提取法[3]、超声波辅助提取法[6]、酸碱提取法[7]、酶提取法[7]等。酶提取法因其提取条件温和,可加速有效成分释放、纯化提取液中的提取物等特点,已被广泛应用于植物中有效成分的提取[8-10]。常用的酶有纤维素酶、果胶酶、蛋白酶或复合酶。纤维素是细胞壁的主要成分,也是多糖溶出的主要屏障,利用纤维素酶水解细胞壁,可加速多糖的溶出,且对细胞内的物质结构无影响;木瓜蛋白酶是含巯基肽链的内切酶,具有蛋白酶和酯酶的活性,可水解蛋白质,帮助多糖溶出[11]。使用单一酶提取北沙参多糖已有研究[7],而研究采用复合酶提取北沙参多糖较少[12]。
试验拟选用纤维素酶和木瓜蛋白酶按一定比例进行北沙参多糖提取,应用响应面法确定最佳提取工艺,并对其结构特征进行分析,考察其对DPPH自由基的清除作用,为提高北沙参多糖的提取率及开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
北沙参:产自河北保定,亳州市问善堂药业科技有限公司;
1,1-二苯基-2-苦味基肼(DPPH)、1-苯基-3-甲基-5-吡唑啉酮(PMP)、甘露糖(Man)、鼠李糖(Rha)、葡萄糖醛酸(GlcA)、半乳糖醛酸(GalA)、葡萄糖(Glc)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)、岩藻糖(Fuc)、DEAE-52纤维素:色谱纯,上海阿拉丁试剂有限公司;
纤维素酶:1×105U/g,宁夏夏盛实业集团有限公司;
木瓜蛋白酶:1×105U/g,南宁庞博生物工程有限公司。
1.2 仪器与设备
恒温水浴锅:HH-2型,江苏金坛宏华仪器厂;
磁力加热搅拌器:DF-2型,江苏金坛宏华仪器厂;
旋转蒸发仪:EYELAN-1100型,日本东京理化株式会社;
超声波清洗器:KS-300DE型,昆山洁力美超声仪器有限公司;
傅里叶变换红外光谱仪:S-100型,德国珀金埃尔默公司;
TSK-GEL凝胶柱:G4000 PWXL、G2500 PWXL型,日本东京株式会社;
液相色谱仪:LC1220型,安捷伦科技(中国)有限公司;
液相色谱仪:e2695型,美国Alliance公司。
1.3 试验方法
1.3.1 北沙参预处理 取北沙参粉碎,过40目筛,用3倍体积的95%乙醇回流提取2次,除去脂溶性成分,药渣干燥后,备用。
1.3.2 北沙参多糖提取工艺优化
(1) 酶解时间:取5 g经预处理的北沙参粉末,酶解温度70 ℃,液料比20∶1 (mL/g),纤维素酶与木瓜蛋白酶质量比1∶1,酶添加量1%(质量分数),考察酶解时间(1,2,3,4 h)对多糖提取率的影响。
(2) 酶解温度:取5 g经预处理的北沙参粉末,液料比20∶1 (mL/g),纤维素酶与木瓜蛋白酶质量比1∶1,酶添加量1%(质量分数),酶解2 h,考察酶解温度(40,50,60,70,80 ℃)对多糖提取率的影响。
(3) 液料比:取5 g经预处理的北沙参粉末,酶解温度70 ℃,纤维素酶与木瓜蛋白酶质量比1∶1,酶添加量1%(质量分数),酶解3 h,考察液料比[20∶1,30∶1,40∶1,50∶1 (mL/g)]对多糖提取率的影响。
(4) 酶添加量:取5 g经预处理的北沙参粉末,酶解温度70 ℃,液料比30∶1 (mL/g),纤维素酶与木瓜蛋白酶质量比3∶1,酶解3 h,考察酶添加量(1%,2%,3%,4%,质量分数)对多糖提取率的影响。
(5) 纤维素酶与木瓜蛋白酶质量比:取5 g经预处理的北沙参粉末,酶解温度70 ℃,液料比30∶1 (mL/g),酶添加量1%(质量分数),酶解3 h,考察纤维素酶与木瓜蛋白酶质量比(1∶1,1∶2,2∶1,1∶3,3∶1)对多糖提取率的影响。
(6) 响应面试验优化:根据Box-Behnken中心组合试验设计原理,选取酶解时间、液料比和酶添加量为响应面因素,利用Design-Expert 8.0软件设计优化提取工艺,并对结果进行分析。
1.3.3 多糖提取率的测定 按式(1)计算多糖提取率。
(1)
式中:
E——多糖提取率,%;
C1——粗多糖质量,g;
C2——样品质量,g。
1.3.4 分离纯化 采用DEAE-52纤维素柱层析法对北沙参粗多糖进行分离纯化。取北沙参多糖(GLP-E)约200 mg,加入10 mL蒸馏水溶解,离心,上样,分别以蒸馏水和0~1 mol/L NaCl洗脱,并用自动收集器收集,每10 min 收集一管,苯酚—硫酸法显色。
1.3.5 理化性质分析
(1) 傅里叶变换红外光谱(FT-IR)分析:检测北沙参多糖在4 000~450 cm-1处的FT-IR[13]。
(2) 北沙参多糖相对分子质量:采用HPGPC-ELSD法[14]。以保留时间为横坐标,相对分子质量为纵坐标,绘制标准葡聚糖标准曲线(y=-0.310 8x+11.749,R2=0.991 1),根据标准曲线计算北沙参多糖相对分子质量。色谱柱为TSK-GEL G4000 PWXL、TSK-GEL G2500 PWXL;流动相为超纯水;柱温30 ℃;进样量20 μL;漂移管温度60 ℃;雾化温度30 ℃;载气为N2;载气流量2.0 mL/min。
(3) HPLC分析:根据文献[15]略作修改。Eclipse XDB-C18色谱柱(4.6 mm×250 mm,5 μm);检测波长245 nm;柱温30 ℃;上样量20 μL;流速1 mL/min;流动相为磷酸盐缓冲液(0.1 mol/L,pH 6.85)—乙腈(83∶17,体积比);洗脱方式为等度洗脱。
1.3.6 清除DPPH自由基能力 参照文献[16-17]。
1.4 数据处理
采用Design-Expert 8.0、Origin 8、SPSS 16.0和Excel等分析软件对试验数据进行处理分析。
2 结果与分析
2.1 单因素试验
2.1.1 酶解时间对北沙参多糖提取率的影响 由图1可知,随着酶解时间的增加,提取率总体呈先增后减趋势,酶解3 h时提取率达峰值,可能是随着酶解时间的增长,酶解作用充分发挥,使得提取率增大,但时间过长,部分多糖被酶解导致提取率降低。因此,选择酶解3 h。
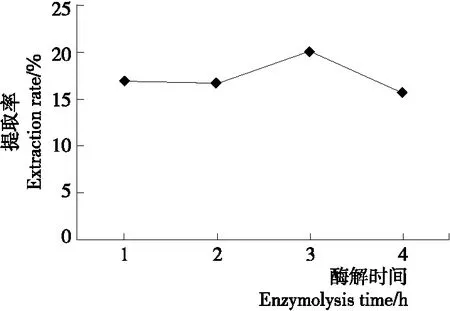
图1 酶解时间对北沙参多糖提取率的影响
2.1.2 酶解温度对北沙参多糖提取率的影响 由图2可知,30~70 ℃时提取率随酶解温度的升高而上升;温度继续升高,提取率下降。随着温度的升高,多糖在溶剂中的溶解度、扩散系数增大,提取率增加;温度过高,多糖结构受到破坏,且酶逐渐失活,提取率降低。因此,选择酶解温度为70 ℃。
2.1.3 液料比对北沙参多糖提取率的影响 由图3可知,当液料比为30∶1 (mL/g)时,提取率最高,继续增大液料比,提取率反而降低,其原因可能与液料比过高不利于多糖溶出有关。因此,选择液料比为30∶1 (mL/g)。
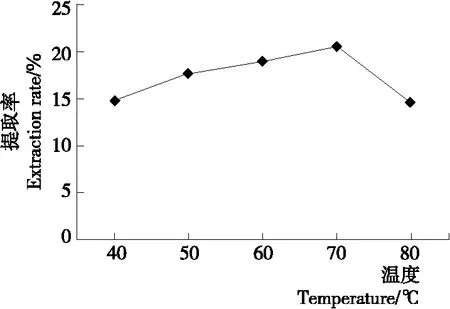
图2 酶解温度对北沙参多糖提取率的影响
Figure 2 Effect of enzymolysis temperature on the extraction rate of polysaccharide fromGlehniaeRadix
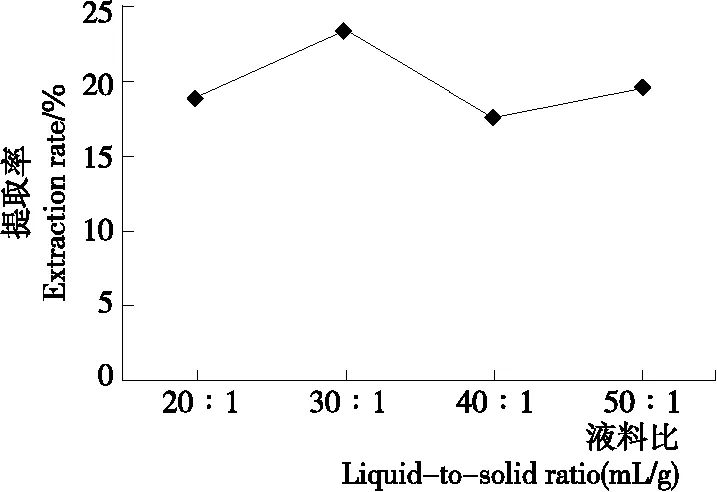
图3 液料比对北沙参多糖提取率的影响
Figure 3 Effect of liquid-to-solid ratio on extraction rate of polysaccharide fromGlehniaeRadix
2.1.4 酶添加量对北沙参多糖提取率的影响 由图4可知,北沙参多糖提取率随着酶添加量的增加先上升后下降,当酶添加量为3%时,提取率最高,可能是在一定范围内,增加酶的用量有利于水解植物细胞组织,从而利于多糖的溶出;当酶添加量继续增加时,北沙参多糖被过量的纤维素酶和木瓜蛋白酶降解,导致提取率降低。因此,选择酶添加量为3%。
2.1.5 纤维素酶与木瓜蛋白酶质量比对多糖提取率的影响 由图5可知,当纤维素酶与木瓜蛋白酶质量比为3∶1时,多糖提取率最高达21.9%;当纤维素酶与木瓜蛋白酶质量比为1∶3时,多糖提取率最低为12.7%,二者之间存在显著差异。可能是酶种类不同,作用位点不同,纤维素酶可水解细胞壁,木瓜蛋白酶可水解蛋白质,有助于多糖溶出,当二者以适当比例复合时,才能显著提高多糖提取率。因此,选择纤维素酶与木瓜蛋白酶质量比为3∶1。
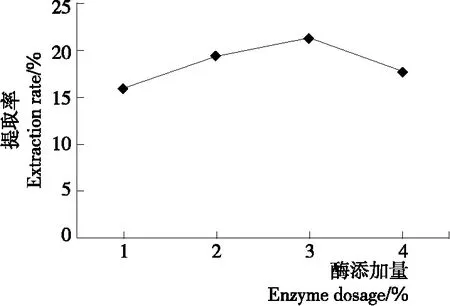
图4 酶添加量对多糖提取率的影响
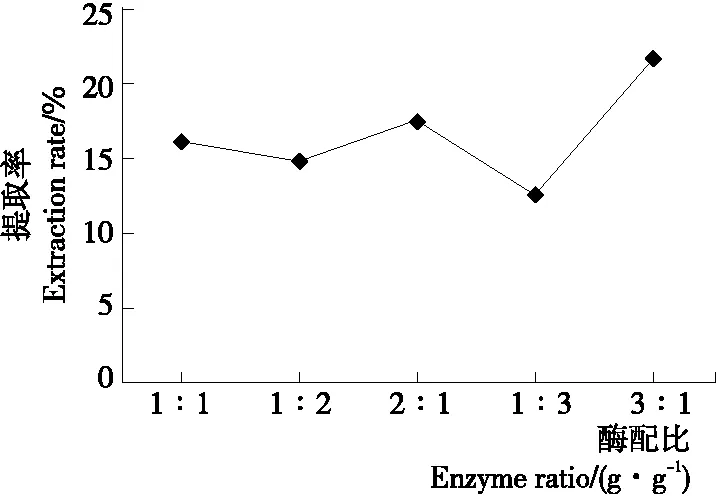
图5 酶比对多糖提取率的影响
2.2 Box-Behnken试验结果
采用Box-Behnken Design试验设计方法,通过响应面分析寻求最优工艺参数[18]。根据单因素试验结果,确定多糖酶解时间、液料比、酶添加量的各项参数水平(见表1)。采用Box-Behnken设计对北沙参多糖提取进行工艺优化,结果见表2。
由软件分析所得各因素和响应值关系的二次多元回归方程为:
Y=22.23+0.069A+0.17B-0.71C-0.34AB+0.93AC+0.40BC-1.36A2-2.26B2-2.12C2。
(2)
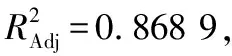
表1 Box-Behnken试验设计因素水平表
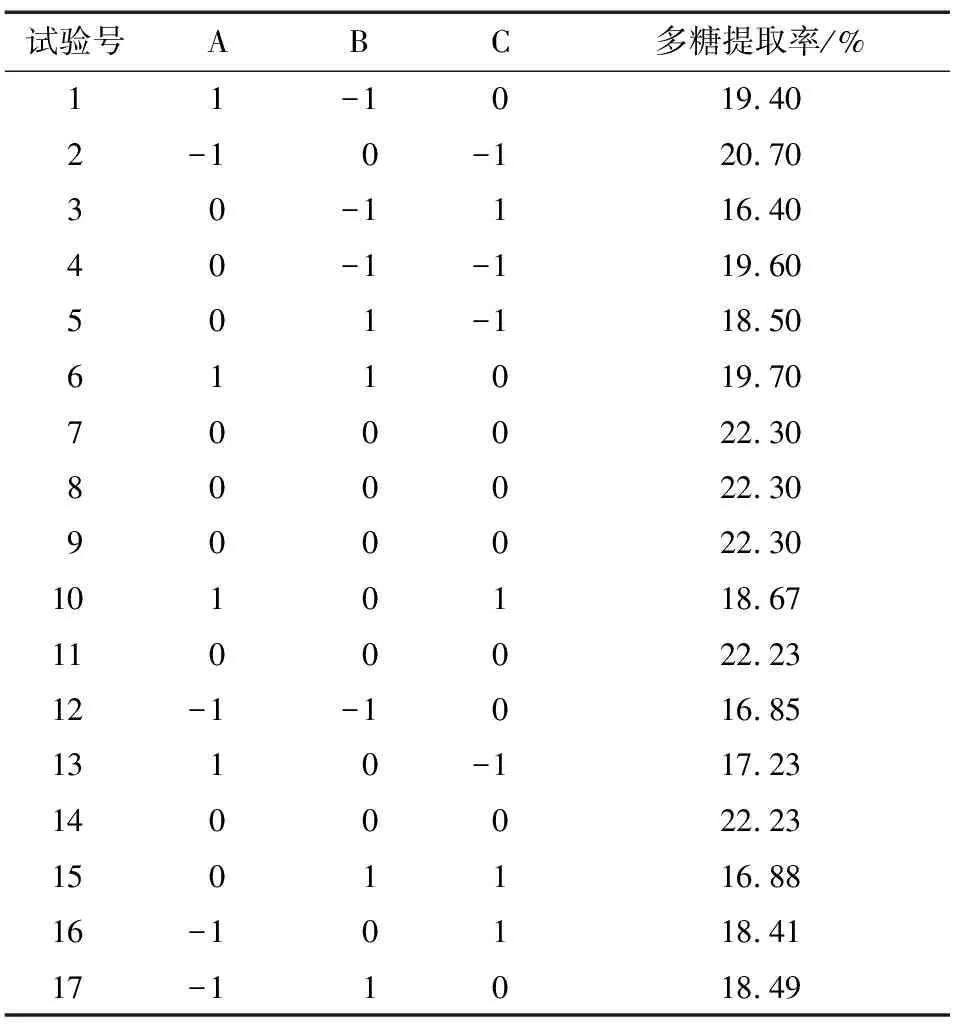
表2 试验设计及结果
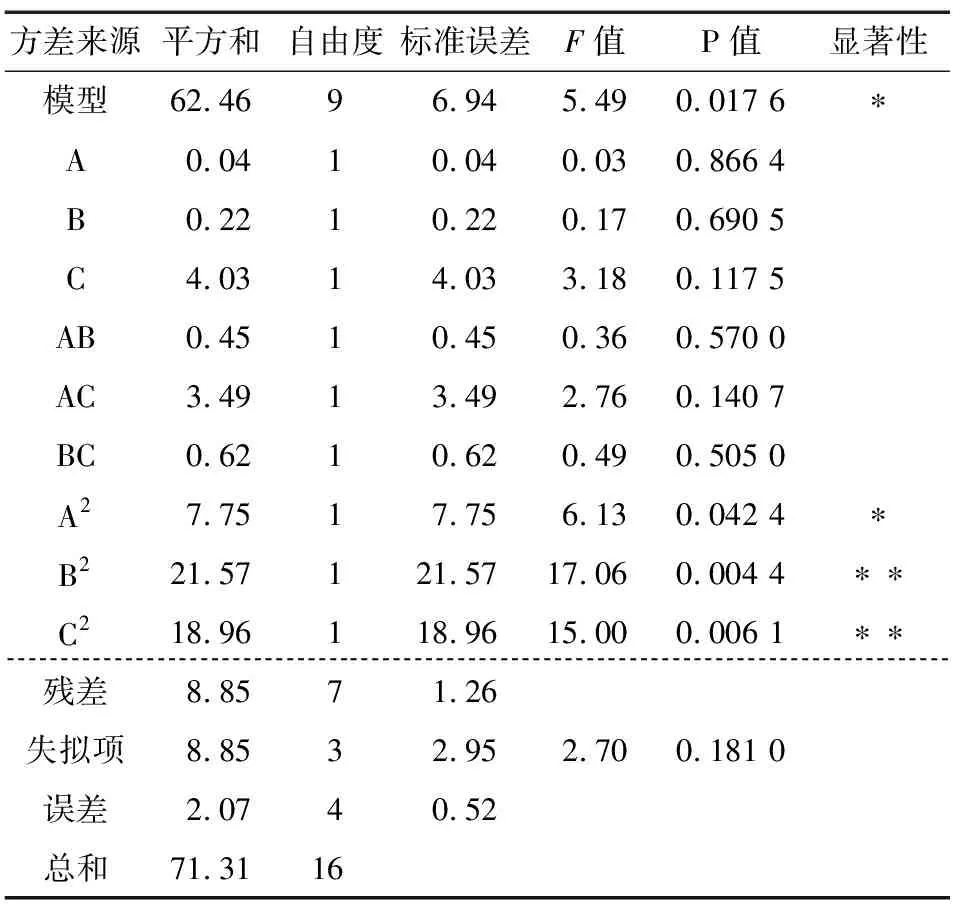
表3 回归模型方差分析†
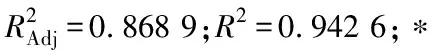
2.3 等高线图和响应曲面图
由图6~8可知,各等高线图均呈椭圆形,说明酶解时间与液料比、酶解时间与酶添加量、液料比与酶添加量之间存在交互作用。
2.4 模型的验证
通过Design-Expert 8.0软件分析,北沙参多糖提取的最佳工艺条件为酶解时间2.98 h,液料比30.12∶1(mL/g),酶添加量2.91%,为检测该法的可靠性,考虑到实际操作的便利,最优工艺修正为酶解时间3 h,液料比30∶1 (mL/g),酶添加量3%,进行3次验证实验,北沙参多糖提取率为(22.04±0.23)%,与预测值22.30%相差0.25%,说明用该模型对北沙参多糖的提取进行工艺优化具有一定的实际可操作性。该条件下的北沙参多糖提取率(22.04%)高于课题组前期研究[6]的(12.13%),说明复合酶法提取多糖,有更好的协同作用,效率更高。
2.5 北沙参粗多糖分离纯化
由图9可知,蒸馏水和NaCl作为洗脱相,均有一个洗脱峰,分别命名为GLP-E1、GLP-E2。
2.6 GLP-E、GLP-E1、GLP-E2理化性质分析

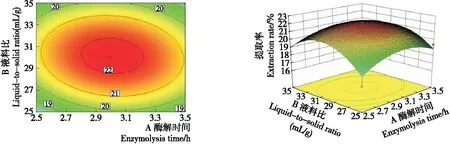
图6 酶解时间与液料比对多糖提取率的交互作用
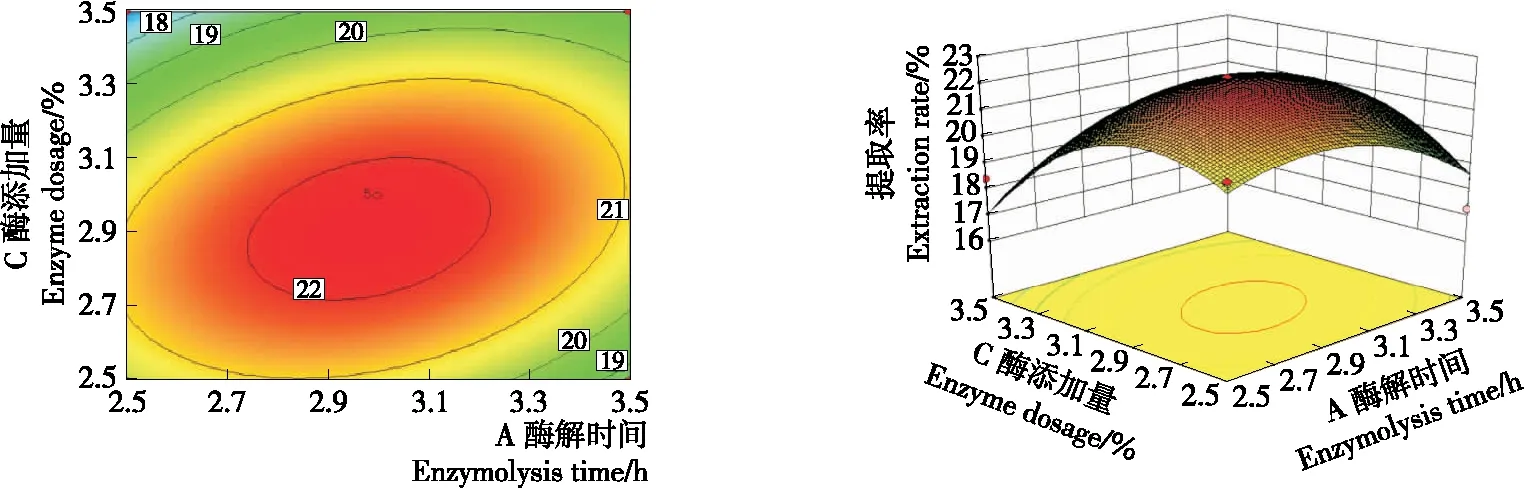
图7 酶解时间与酶添加量对多糖提取率的交互作用
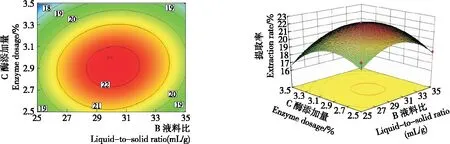
图8 液料比与酶添加量对多糖提取率的交互作用
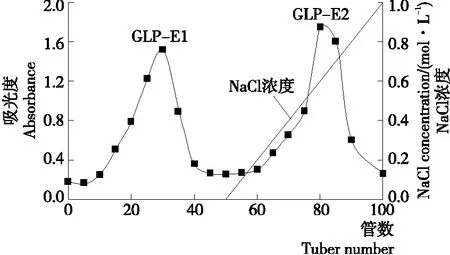
图9 北沙参粗多糖DEAE-52纤维素洗脱曲线图
2.6.2 单糖组成 由图11可知,GLP-E由GlcA、Glc、Gal和Ara组成;GLP-E1由GlcA、Glc、Gal和Ara组成;GLP-E2由Glc组成。
2.6.3 相对分子质量 由图12可知,GLP-E具有3个吸
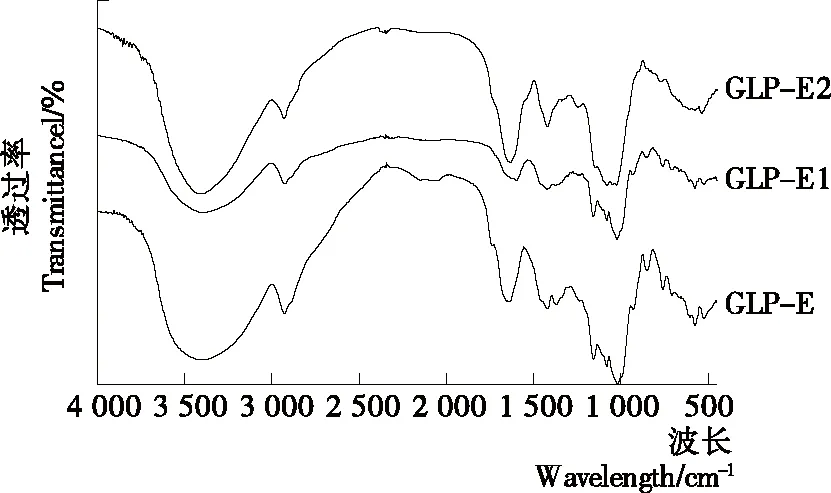
图10 GLP-E、GLP-E1、GLP-E2红外图谱
1. Man 2. Rha 3. GlcA 4. GalA 5. Glc 6. Gal 7. Xyl8. Ara 9. Fuc
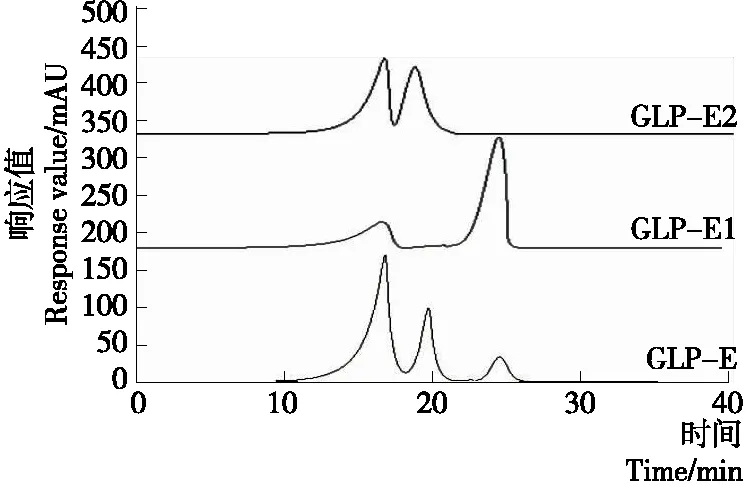
图12 GLP-E、GLP-E1、GLP-E2相对分子质量分布图
收峰,相对分子质量分别为4 662.98,376.89,10.40 kDa;GLP-E1具有2个吸收峰,相对分子质量分别为4 221.45,377.96 kDa;GLP-E2具有2个吸收峰,相对分子质量分别为4 626.41,10.24 kDa。由此可见,GLP-E、GLP-E1和GLP-E2为非均一多糖。
2.7 体外抗氧化活性
由图13可知,在0~8 mg/mL浓度范围内,GLP-E、GLP-E1、GLP-E2对DPPH自由基有一定的清除作用,且呈浓度依赖性。三者清除DPPH自由基的IC50值分别为1.918,7.422,3.392 mg/mL,清除能力大小为GLP-E>GLP-E2>GLP-E1,优于超声波辅助提取法的(1.99 mg/mL)[7]和纤维素酶法的(6.317 mg/mL)[8],但均低于阳性对照VC(IC50为0.005 mg/mL)的清除能力。
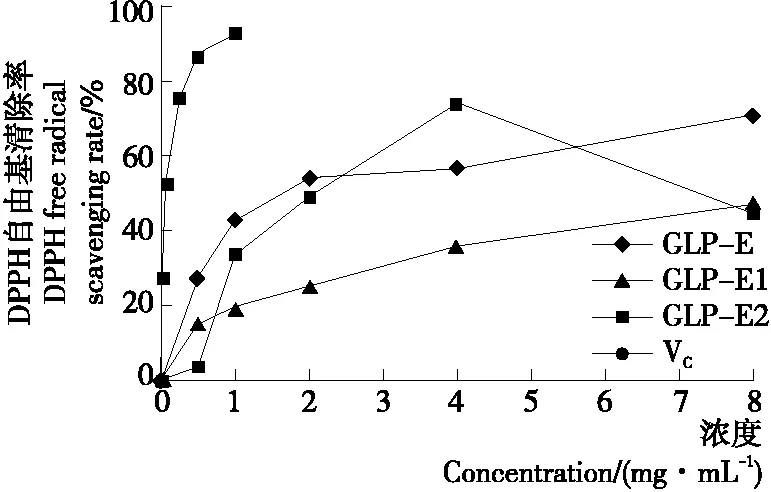
图13 GLP-E、GLP-E1和GLP-E2对DPPH自由基的清除作用
李亚辉等[21]研究表明复合酶提取的多糖对DPPH自由基和羟基自由基的清除作用均略大于同质量浓度的VC。故复合酶法提取的多糖具有较好的抗氧化作用,可能由于:① 双重酶解作用,有利于多糖的溶出;② 提取时间短、条件温和,对多糖的结构破坏较小;③ 木瓜蛋白酶水解蛋白质,多糖溶出的同时,提高了多糖的纯度[22]。
3 结论
通过单因素试验及响应面综合分析,得到复合酶法提取北沙参多糖的最优提取工艺为酶解温度70 ℃,酶解时间3 h,液料比30∶1 (mL/g),酶添加量3%,纤维素酶与木瓜蛋白酶质量比3∶1,此条件下的提取率为(22.04±0.23)%。经DEAE-52纤维素纯化后得到两个组分,GLP-E1 与GLP-E2。GLP-E由GlcA、Glc、Gal和Ara组成,相对分子质量分别为4 662.98,376.88,10.40 kDa;GLP-E1由GlcA、Glc、Gal和Ara组成,相对分子质量分别为4 221.45,377.96 kDa;GLP-E2由Glc组成,相对分子质量分别为4 626.41,10.24 kDa;且3种组分均表现出一定的清除DPPH自由基的能力,其IC50值分别为1.918,7.422,3.392 mg/mL。后期将对北沙参多糖的结构特征及体内抗氧化活性进行研究。
