新疆哈萨克族传统奶酪中潜在益生乳酸菌的筛选
2019-12-19陈欢王斌史学伟郑晓吉郭孝敬黄倩
陈欢,王斌,史学伟,郑晓吉,郭孝敬,黄倩
(石河子大学 食品学院,新疆 石河子 832000)
大量研究证明,人体胃肠道内的乳酸菌重要种类及数量对人体健康有着极为重要的作用,一些益生乳酸菌可在人体的肠道内吸附并且繁殖,从而形成了生理性防护屏障,间接起到了排斥、抑制有害菌的存活生长,调节人体内环境、稳定健康的作用[1]。不仅如此,乳酸菌在食品领域也有其他菌种不可替代的作用,目前乳酸菌在乳制品、调味品等类型的食品中都得到了重要的应用。例如,乳酸菌对于食醋的酿造是至关重要的微生物群体,在此过程中酒精与乳酸菌代谢产生的乳酸会发生酯化反应生成醋中的重要芳香呈味物质乳酸乙酯,醋在酿造过程中若没有乳酸菌或乳酸菌的量不足就会导致食醋的口感欠缺[2]。
奶酪是新疆哈萨克族最具特色的自制发酵食品之一,这种特色奶酪中蕴含着大量的乳酸菌资源,但是随着这些年国内工业化进程的飞速发展,人们对于市场上商业化的奶酪需求远大于这类传统手工奶酪,又因乳酸菌对奶酪风味有着十分重要的影响,这样不仅会造成奶酪口味的单一,更会造成优质乳酸菌资源的流失。所以,本研究对新疆部分地区的哈萨克族传统奶酪中具有潜在益生特性的乳酸菌进行了筛选,期望可以对该地区的优质乳酸菌资源及这类传统奶酪起到一定的保护作用,并为益生菌食品的发展奠定一定基础。
1 材料与方法
1.1 材料与试剂
菌株来源:本试验从新疆伊犁地区牧民自制哈萨克族传统奶酪中分离筛选出8株乳酸菌。
主要试剂:细菌基因组DNA提取试剂盒、溶菌酶:北京酷来搏科技有限公司;细菌通用引物27F与1492r:上海捷瑞生物工程有限公司;琼脂糖:生工生物工程(上海)有限公司;牛胆盐:上海麦克林生化科技有限公司。
1.2 培养基[3]
MRS固体培养基:牛肉膏 10.0 g、酵母膏5.0 g、柠檬酸氢二铵2.0 g、葡萄糖20.0 g、吐温80 1.0 mL、乙酸钠5.0 g、磷酸氢二钾2.0 g、硫酸镁0.58 g、硫酸锰0.25 g、琼脂 18.0 g、蒸馏水1000 mL。
MRS液体培养基:牛肉膏 10.0 g、酵母膏5.0 g、柠檬酸氢二铵2.0 g、葡萄糖20.0 g、吐温80 1.0 mL、乙酸钠5.0 g、磷酸氢二钾2.0 g、硫酸镁0.58 g、硫酸锰0.25 g、蒸馏水1000 mL。
1.3 主要仪器与设备
SW-CJ无菌操作台 苏州苏洁净化设备有限公司;CX21 FS1光学显微镜 Olympus公司;X7型多功能酶标仪 基因有限公司;SPX-240B生化培养箱 常州诺基仪器有限公司;5810R高速冷冻离心机 德国Eppendorf仪器公司;B2J0智能数显恒温油水浴锅 上海博讯实业有限公司;BYY-BC电泳仪 北京六一生物科技有限公司。
1.4 试验方法
1.4.1 菌株的耐酸能力测定[4]
用1 mol/L HCl、1 mol/L NaOH调节MRS液体培养基,pH值分别调为2,3.5,5,6.5,8,9.5,将纯化的菌悬液以2%的接种量于不同pH值的200 mL MRS液体培养基中,置于37 ℃恒温培养箱24 h,将不同pH的菌液,用酶标仪测定OD600 nm值,每组3个平行试验,以分析酸度对乳酸菌生长状况的影响。
1.4.2 菌株对胆盐耐受性测定
将待测菌株活化2次,活化好的乳酸菌株接种于MRS液体培养基于37 ℃培养24 h后,于3500 r/min离心20 min,收集菌体沉淀弃上清液,菌体用等体积的灭菌的生理盐水洗涤3次,以相同的条件离心,再将菌体重悬于等体积的生理盐水中即可[5]。
将上述种子液分别接种于含有胆盐0.03%、0.1%、0.2%、0.3%、0.4%的液体MRS培养基中混匀,37 ℃培养24 h后用菌落平板计数法计算活菌数,每组做3个平行试验,计算公式如下:
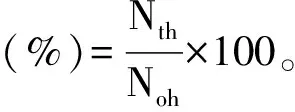
式中:Nth为含有不同浓度胆盐的MRS培养基中活菌数,CFU/mL;Noh为不含胆盐的MRS培养基中活菌数,CFU/mL。
1.4.3 菌株对模拟胃液耐受性测定[6-8]
新鲜人工模拟胃液的配制:将胃蛋白酶溶于PBS缓冲液中使其终浓度为3 g/L,用HCl调节pH值为2.7,经0.2 μL无菌滤膜过滤即为人工模拟胃液。
将试验筛选的乳酸菌进行活化后,取30 mL乳酸菌培养物在4 ℃,3500 r/min下离心12 min,收集到的菌体用灭菌后的PBS缓冲溶液(0.1 mol/L,pH 7.2,内含80 g/L NaCl)以1∶9的比例稀释。然后取0.2 mL悬浮液添加到2.0 mL模拟胃液中在37 ℃,250 r/min摇床培养,分别在1,2,3 h用酶标仪测定培养前后的OD600 nm值,计算菌株的存活率:

式中:ODth为菌株在人工模拟胃液1,2,3 h后的吸光度;ODoh为没有放进人工模拟胃液中的初始值。
1.4.4 菌株降解亚硝酸盐能力的测定
乳酸菌株降解亚硝酸盐的能力根据文献[9]和文献[10]进行测定。
1.4.5 菌株的表面疏水性测定[11,12]
本试验采用微生物粘附碳烃化合物法,以二甲苯萃取菌体的能力作为评价乳酸菌的疏水能力。取8 mL将经过28 h在最适温度下活化后的乳酸菌液在9000 r/min、4 ℃条件下离心8 min,弃上清液留沉淀,将沉淀用pH为6.8的PBS缓冲液洗涤2次后,再次在相同条件下离心,重新悬浮收集菌体,用PBS缓冲液调整菌液的浓度,用酶标仪测定OD600 nm的吸光值在0.6~0.8之间,取4 mL的菌液与800 μL的二甲苯混合,振荡1 min,室温静置20 min后发生相分离,提取水相并测定OD600 nm处的吸光值,以计算菌株的疏水性:

式中:A0与At是加二甲苯前后在OD600 nm处的吸光度。
1.4.6 菌株的抑菌性测定[13,14]
选用牛津杯法对菌株的抑菌特性进行测定,将筛出的乳酸菌和指示菌经过2次活化后进行平板计数,调整菌液浓度为106CFU/mL。吸取指示菌(大肠杆菌、金黄色葡萄球菌)8 mL分别于800 mL的MRS培养基中混匀,将灭菌的牛津杯放置在无菌的平板上,使杯底紧贴于平皿底部,将混有指示菌的MRS培养基倒平板,等平板凝固后拔出牛津杯,在孔中加入100 μL的乳酸菌种子液,在最适温度条件下培养24 h后,测定抑菌圈直径大小。
1.4.7 16S rDNA测序
1.4.7.1 乳酸菌DNA的提取及PCR扩增
乳酸菌基因组DNA提取按照细菌基因组DNA提取试剂盒(离心柱型)说明书中的步骤进行提取,可用1%琼脂糖凝胶电泳检测提取DNA的质量。提取的基因组DNA进行PCR扩增,上游引物27F(5'-AGAGTTTGATCMTGGTCAG-3'),下游引物(5'-TACGGYTACCTTGTTACGACTT-3')均为细菌16S rDNA的通用引物。PCR扩增条件及反应体系参考文献[15]和文献[16]。
1.4.7.2 扩增产物测序及系统发育树的建立[17]
扩增产物经1%的琼脂糖凝胶电泳后,将产物(长度在1500 bp左右)送至公司进行单向测序,测得的序列在NCBI的Blast程序上进行同源性分析,从数据库中获得16S rDNA的序列同源性比对,比对结果使用Mega 6.0建立系统发育树。
2 结果与分析
2.1 菌株的耐酸能力
分离鉴定的8株乳酸菌于不同pH值环境下的生长状况见图1,OD600 nm处的吸光度代表该菌株对酸碱的耐受程度。

图1 菌株在不同pH下的生长状况Fig.1 Growth of strains at different pH values
由图1可知8株乳酸菌在不同酸度下的生长状况,酸度过高或过低都不利于菌株的生长。几株乳酸菌的生长趋势较相似,pH在2~6.5之间,菌株的吸光度不断增加,说明乳酸菌在这个区间内的菌落数随酸度减小而不断增加;pH在6.5~9.5之间时,乳酸菌的菌落数随着酸度的减小而受到了抑制。菌株D-12、S-4、B-9这3株菌在不同pH条件下的吸光度相对较低,各pH梯度之间降幅也较大,且在pH为2的高酸环境下,3株乳酸菌的吸光度都小于0.2,说明菌株在高酸条件下的生长受到了抑制;菌株D-14、D-2、S-7、B-6、S-3在各个pH环境下吸光度相对较高,即有较高的生长活性,在pH为2的高酸环境下,这5株菌的吸光度均大于0.4;在pH为9.5的碱性环境下,这5株菌的吸光度均大于0.8,说明菌株D-14、D-2、S-7、B-6、S-3相对于D-12、S-4、B-9的耐酸碱能力强。
2.2 菌株对胆盐的耐受性
将分离鉴定的8株乳酸菌分别接种到含有不同浓度胆盐的MRS培养基中于37 ℃恒温培养24 h,菌株的存活率表示各菌株在不同浓度胆盐环境中的耐受性,见图2。
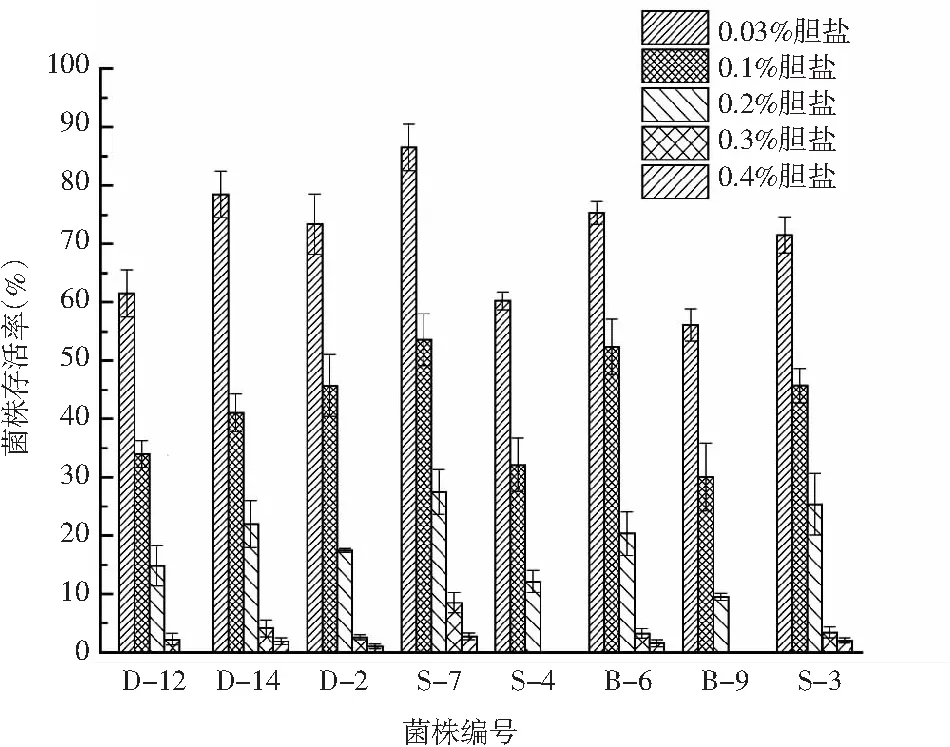
图2 菌株在不同浓度胆盐中的生长状况 Fig.2 Growth of strains in different concentration of bile salts
由图2可知,不同浓度的胆盐对8株乳酸菌的存活率影响的差异较大,菌株随着胆盐浓度的增大受到的抑制随之增加。当培养基中胆盐浓度为0.03%时,各菌株的存活率均大于55%,其中菌株D-14、S-7、B-6的存活率更是达到了75%以上;当培养基中胆盐浓度为0.1%时,各菌株存活率都明显下降,菌株D-2、S-7、B-6、S-3的存活率均大于45%;当培养基中胆盐浓度为0.2%时,只有菌株S-7、S-3的存活率大于25%,而菌株D-12、S-4、B-9的耐受性较差,存活率均低于25%;当培养基中胆盐浓度为0.3%与0.4%时,8株菌的存活率迅速降低到5%以下,菌株S-4、B-9在这两种环境下的存活率为0,菌株D-12在胆盐浓度为0.3%的条件下具有一定存活率,但在胆盐浓度为0.4%的条件下存活率下降到0,菌株D-14、S-3、S-7、B-6、D-2在这两种环境下均有一定的存活率,但D-2在胆盐浓度为0.4%时存活率几乎接近0。所以,菌株D-14、S-3、S-7、B-6这4株菌对胆盐的耐受性较强。
2.3 菌株对模拟人体胃液的耐受性
将经过上述试验的菌株置于模拟的人体胃液中,分别在1,2,3 h后测定菌株的存活率,见图3。

图3 菌株在模拟人体胃液下的生长状况Fig.3 Growth of strains in simulated human gastric juice
由图3可知,8株菌在胃液中的生长状况因菌株各自的特异性与在胃肠道中停留时间的差异而不同,菌株D-14、D-2在3个时间段的存活率都比较高,存活率均达到了60%以上;菌株S-7在模拟胃液中培养2 h,存活率也均在50%以上,3 h的存活率下降到了40%左右;1 h菌株B-6与S-3存活率在65%以上,高于D-12、S-4、B-9在模拟胃液中40%~55%的存活率,3 h后菌株的存活率均有所下降,菌株D-12、S-4、B-9的存活率均下降到25%以下。所以,菌株D-14、D-2、S-7若较长时间处在模拟胃液环境下,相对于其他菌株对于人工胃液有较高的耐受性。
2.4 菌株降解亚硝酸盐的能力
将经上述试验得到的益生菌株D-14、D-2、S-7、B-6、S-3接种到含有150 μg/mL NaNO2的MRS培养液中,放置于37 ℃的恒温培养箱中培养24 h,分析5株菌对亚硝酸盐的降解能力,见图4。

图4 菌株降解亚硝酸能力比较Fig.4 Comparison of nitrite degradation ability of strains
由图4可知,5株菌降解亚硝酸盐的能力存在显著性差异(P<0.05)。菌株D-14对亚硝酸盐的降解率是78%左右,显著高于菌株S-7、B-6、S-3,菌株B-6与其他4株菌存在显著性差异(P<0.05),对亚硝酸盐的降解率为68%左右,显著低于菌株D-14、D-2、S-7、S-3。菌株D-2与菌株S-3存在显著性差异(P<0.05),亚硝酸盐降解率分别为73%与65%左右,除了菌株B-6其他菌株对亚硝酸盐的降解率均在75%以上。
2.5 菌株的表面疏水性
将经上述试验得到的益生菌株D-14、D-2、S-7、B-6、S-3经一定处理后的菌液与二甲苯混合,二甲苯与菌体的结合力来作为乳酸菌的疏水能力的标准,分析不同乳酸菌株之间表面疏水性差异,见图5。

图5 菌株表面疏水性比较Fig.5 Comparison of surface hydrophobicity of strains
由图5可知,5株菌之间的表面疏水性存在显著性差异(P<0.05)。菌株D-14与D-2表面疏水性较高,范围在35%~40%之间,显著高于菌株S-7、B-6与S-3。菌株B-6与S-3表面疏水性较低,菌株S-7表面疏水性为27%左右,显著高于菌株B-6、S-3的表面疏水性。
2.6 菌株的抑菌性
将菌株D-14、D-2、S-7、S-3接种到含病原菌的MRS培养基中,分析这4株菌的抑菌效果,见表1。

表1 菌株抑菌效果比较Table 1 Comparison of antibacterial effect of strains
由表1可知,各菌株对两种病原菌的抑制作用存在显著性差异(P<0.05)。S-3对大肠杆菌有抑制作用,对金黄色葡萄球菌无抑制作用,是4株菌中抑制作用最小的;菌株D-14在含有大肠杆菌与金黄色葡萄球菌的培养基上均有较大的抑菌圈,菌株D-14的抑菌性在这4株菌中最好;菌株D-2与S-7对大肠杆菌的抑制作用不存在显著性差异(P>0.05),对金黄色葡萄球菌的抑制作用菌株D-2显著高于菌株S-7。
2.7 菌株16S rDNA测序分析
分别提取D-14、D-2、S-7、S-3的基因组DNA后,进行PCR扩增,见图6。扩增得到4株待测菌株的条带清晰明亮,无明显拖尾现象,4株菌的条带大小均在1.5 kb附近,与理论值相符。
将4株乳酸菌的DNA扩增产物测序,测序结果登录NCBI通过Blast对比分析,发现D-14与干酪乳杆菌(Lactobacilluscasei)的同源性达99%,D-2与格氏乳球菌(Lactococcusgarvieae)的同源性达100%,S-7与瑞士乳杆菌(Lactobacillushelveticus)的同源性达100%,S-3与乳酸明串球菌(Leuconostoclactis)的同源性在98%以上。

图6 16S rDNA扩增结果Fig.6 Amplification result of 16S rDNA
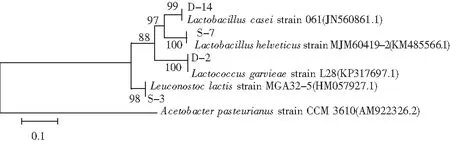
图7 基于4株菌16S rDNA序列构建的系统发育树Fig.7 Phylogenetic trees based on 16S rDNA sequences of four strains of bacteria
3 结论
乳酸菌是一类在自然界分布很广泛的细菌,有着较为丰富的生物多样性,它们不仅在理论上具有重要的学术价值,也是各领域研究(如:基因工程、遗传、分子生物等)的优良菌种[18,19]。本研究对从新疆伊犁地区采集的哈萨克族传统奶酪中筛选出的8株乳酸菌进行了体外耐酸、耐胆盐、模拟人体胃液、降解亚硝酸盐、疏水性及抑菌试验。结果表明,菌株D-14、D-2、S-7、B-6、S-3耐酸碱能力较好;菌株D-14、S-7、B-6、S-3对胆盐的耐受性较好,当胆盐的浓度为0.3%与0.4%时,这4株菌在这两种环境下均有一定的存活率,菌株D-2在胆盐浓度为0.4%时的存活率几乎接近于0;菌株D-14、D-2在3个时间段的存活率都比较高,存活率均达到了70%以上;菌株S-7在模拟胃液中培养1 h与2 h后,存活率也均在70%以上,3 h后的存活率下降到了50%左右;菌株D-14降解亚硝酸盐的能力及疏水性最好,菌株D-14、D-2、S-7及S-3具有抑菌性。最终得到具有潜在益生性的菌株D-14、D-2、S-7及S-3,再对这4株益生乳酸菌进行16S rDNA测序,结果表明D-14为干酪乳杆菌,D-2为格氏乳球菌,S-7为瑞士乳杆菌,S-3为乳酸明串球菌。后期将对这4株潜在益生乳酸菌的产酶特性进行研究,将其作为益生功能性乳制品研发的潜在益生菌资源。
