高频超声肝实质纹理特征定量评价肝硬化患者肝功能
2019-12-19宋家琳章建全刘士远王硕鸿赵佳琦刁宗平盛建国
宋家琳,刘 翔,章建全,刘士远,王硕鸿,付 静,赵佳琦,刁宗平,盛建国
(1.中国人民解放军海军军医大学附属长征医院超声科,3.影像科,上海 200003;2.上海工程技术大学电子电气工程学院,上海 201620;4.哈佛大学分子与细胞生物学系及脑科学研究中心,美国 剑桥 02138)
约20%~30%慢性乙型肝炎(简称乙肝)患者将发展为肝硬化或肝癌,而肝病初期多无明显症状,延误诊断及治疗。随着人工智能理论日益成熟,计算机辅助诊断技术在医学领域的应用逐渐广泛,尤其是影像学领域[1-5]。2015年WHO发布的《慢性乙型肝炎病毒感染预防、护理和治疗指南》[6]中特别强调,推荐使用简单的非侵入性诊断检测法评估肝病的发展阶段和治疗的恰当性。本研究将计算机辅助诊断技术与高频超声图像相结合,探讨纹理特征参数定量评价乙肝肝硬化患者肝功能的应用价值。
1 资料与方法
1.1 一般资料 收集2014年5月—2018年10月95例于中国人民解放军海军军医大学附属长征医院就诊的乙肝肝硬化患者,男63例,女32例,年龄23~77岁,平均(53.6±11.3)岁;参照Child-Pugh改良分级计分标准对其进行肝功能评分,A级为5~6分,B级为7~9分,C级为10~15分;肝功能A级组37例,年龄28~71岁,平均(47.2±11.0)岁;B级组33例,年龄23~68岁,平均(49.5±12.6)岁;C级组25例,年龄31~77岁,平均(56.1±13.8)岁;均未接受过抗纤维化治疗,并除外合并脂肪肝、酒精性肝病、血吸虫肝病等其他器质性慢性肝病。随机选择经体检、实验室检查、超声或其他影像学检查无肝脏疾病的健康志愿者21名作为对照组,男16名,女5名,年龄22~76岁,平均(51.1±12.6)岁。
1.2 仪器与方法 采用GE Voluson E8超声诊断仪,11L线阵探头,探头频率4~10 MHz。嘱受检者平卧或左侧卧,于剑突下、右侧肋间扫查肝脏,调整图像深度及增益,尽可能清晰显示肝包膜及浅表肝实质,分别存储肝右叶及左叶二维超声图像,每个部位至少存储3张清晰图像,用提取和分析于纹理特征参数。
1.3 肝实质纹理分析及特征参数提取(图1)
1.3.1 肝实质纹理分析 采用Xie等[7]方法定位肝实质区域图像中的缺陷(肝硬化时,肝实质纹理表现为不随机、不规则,将此类区域视为肝实质纹理图像中的“缺陷”)。具体方法如下:①学习纹理基元,使用高斯混合模型(gaussian mixture modeling, GMM)建立纹理基元,用均值μ和协方差矩阵∑表征每个纹理基元ζk。首先对训练集中的肝实质区域图像构建高斯金字塔,在其不同层提取图像块,以获得不同尺度的训练图像,选取15×15像素的图像块,高斯核尺寸3×3像素,标准差0.5,金字塔共4层,每层12个纹理基元;而后将15×15像素的图像块展开为1×255像素的行向量,对其进行主成分分析(principal components analysis, PCA)降维处理,将每个样本图像块处理为1×8像素的行向量,再基于训练集使用期望最大化(expectation maximization, EM)算法学习纹理基元,即求解如下最优化问题:

(1)
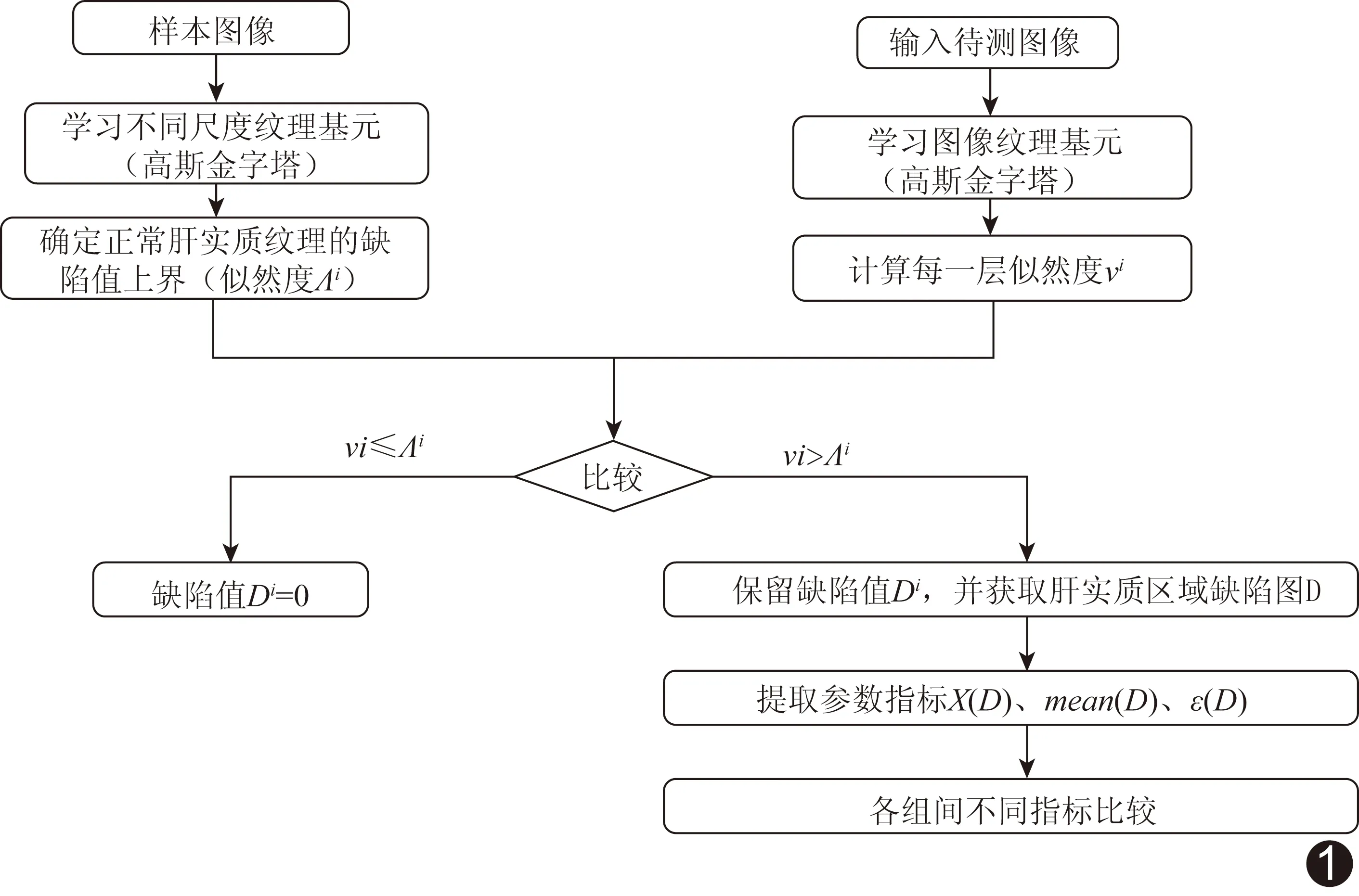
图1 肝实质纹理分析及特征参数提取方法流程图

(2)
再对似然度进行k-means聚类,将金字塔每层的纹理基元聚成r个类,每个类又由其均值ur和标准差σr来表征。找到似然度均值最大的类m,用下式定义该上界(取ζ=5)。若某一样本图像似然度大于该上界,说明该图像可能来自于有缺陷的组织(即肝硬化组织)。
(3)
③定位肝实质缺陷,完成步骤①和②后,测试待诊断图像。对每张测试图像定位包膜线后,取包膜线下方肝实质区域图像,用与①中相同的参数构建金字塔,并从金字塔的每层的每个像素处提取与训练样本相同尺寸的15×15像素的图像块,用公式(2)计算似然度νi(i表示金字塔第i层),然后与步骤②得到的上界比较,计算缺陷值,如下式:
(4)
若似然度ν小于上界,则该图像块来自于正常组织,缺陷值Di为0;若似然度νi大于上界,则保留缺陷值。最后,考虑同一个像素不同尺度下的缺陷值Di,得到肝实质图像中每个像素最终判定的缺陷值,如下式,该值越大,说明该像素所处位置的图像紊乱程度越严重。
(5)
1.3.2 肝实质纹理特征参数提取 以上述方法对肝实质图像分析,获得肝实质区域的缺陷图D(图2)。D中像素值反映该像素位于病变组织部位的概率。基于缺陷图,使用检测以下3项指标量化肝硬化的病变程度:①缺陷图单位面积的局部最大值χ(D),即缺陷图D单位面积的局部极大值,计算方法为缺陷图D的局部极大值除以缺陷图D的面积。单位面积的局部极大值越大,说明肝硬化病变部位越多。②缺陷图的均值mean(D):即缺陷图D所有像素的平均值,平均值越大,说明病变部位越多,紊乱程度越严重。③缺陷图的熵ε(D):即缺陷图D的像素值矩阵的熵值,该值反映图像灰度分布的空间特征(即紊乱程度),熵值越大,说明缺陷图像越紊乱。理论上讲,χ(D)、mean(D)和ε(D)越大,肝硬化病变部位越多,声像图的紊乱程度越严重。

2 结果
4组间年龄(F=0.361,P=0.781)、性别(χ2=0.081,P=0.994)差异均无统计学意义,χ(D)、mean(D)和ε(D)差异均有统计学意义(P均<0.001)。A级组、B级组、C级组χ(D)、mean(D)均大于正常组,A级组、B级组ε(D)均大于正常组;B级组mean(D)、ε(D)大于A级组,ε(D)大于C级组;组间差异均有统计学意义(P均<0.05)。见表1。

图2 不同肝功能分级肝硬化患者的二维高频声像图及相应肝实质区域的缺陷图 A、B.分别为正常对照者的肝实质二维高频声像图和缺陷图; C、D.分别为肝功能A级患者的肝实质二维高频声像图和缺陷图; E、F.分别为肝功能B级患者的肝实质二维高频声像图和缺陷图; G、H. 分别为肝功能C级患者的肝实质二维高频声像图和缺陷图
表1 各组肝实质纹理特征参数比较
注:*:与正常组比较,P<0.05;#:与A级组比较,P<0.05;△:与C级组比较,P<0.05
3 讨论
所有自然图像均由微观世界中的不同图像基元组成,当某种基元规律性或随机性重复出现时,就形成了图像的纹理结构。纹理特征是理解图像的重要信息源。医学图像中也包含纹理特征,且具有规律性、周期性和不变性[8]。超声声像图的基元由组织内众多不可分辨的微小散射体构成,超声波在人体内传播时,遇到小于波长的细微组织会发生散射,散射波之间相互干扰,导致回波幅度波动,形成许多颗粒状结构,其按照一定的规律或周期排列,进而形成超声声像图的纹理[9];当这种规律性消失或周期不再重复出现时,图像纹理结构会发生改变。人眼的分辨力在纹理灰度等级及空间分布方面有明显局限性。计算机纹理分析技术可提供更加丰富、细微的信息,为声像图纹理的量化分析带来了希望。
迄今已有很多学者[10-11]利用计算机技术致力于研究肝硬化、肝纤维化纹理,抽取纹理特征的主要方法为灰度共生矩阵、小波变换及局部二值模式(local binary pattern, LBP)等;但计算机技术本身存在局限性,如人工选取ROI主观性较强,所提取的部分特征不能很好地反映临床实际,分类效果提高不显著等,尚未在临床普及推广。随着人工智能的快速发展,机器学习逐渐得到应用,其为人工智能的核心,是涉及概率论、统计学、逼近论、算法复杂度理论等多学科的交叉学科,通过研究计算机如何模拟或实现人类的学习行为而获取新的知识或技能,重新组织已有知识结构并不断改善自身性能。本研究采用机器学习方法,通过学习表征正常肝实质超声声像图一系列纹理基元后,计算待测试的样本图像中每个像素所在的区域属于正常肝实质图像的概率,如概率过小,即认为该区域属于病变组织。为避开超声声像图中肝脏大血管的影响,单纯分析肝实质回声,并提高分辨率,本研究使用高频探头扫查肝脏并存储图像,分析图像中所有肝实质纹理,不再提取ROI,以尽可能避免人工选取的主观性,实现客观分析。
本研究中提取的表示图像纹理特征的3个参数χ(D)、mean(D)和ε(D)能够反映图像的紊乱程度。正常组、A级组和B级组中,除A级组与B级组数χ(D)差异无统计学意义外,其他2个参数3组间两两比较差异均有统计学意义,说其可提示肝硬化患者早期肝功能不全,根据mean(D)和ε(D)可以进行分级别诊断,但其敏感度和特异度有待进一步观察。理论上讲,参数数值越大,图像紊乱程度越高,肝硬化程度越严重,患者肝功能越差,但实际结果却并非如此。本研究发现,随着肝功能级别程度增加,3个参数呈现出先逐渐增大、而后减小的趋势,C级组的数值虽较正常组增大χ(D)、mean(D),但均较B级组数值小。究其原因,可能为重度肝功能不全时,肝脏体积不同程度缩小,超声波对距离缩小的异常像素点难以分辨。由此可见,肝硬化时肝实质超声声像图的紊乱程度与患者肝功能状态并不完全一致,提取的纹理参数能够实现对肝功能A级、B级患者的定量评估,但对于肝功能C级患者仅依靠肝实质一个方面的参数显然是不够的,还需结合肝包膜、肝内血管走行、腹腔积液等特征来综合评估。
既往有研究[12-13]提取肝包膜的几何特征,即连续性和平滑性,可较准确地诊断不同程度肝硬化。通过动物实验,将可进一步观察肝实质纹理特征参数评估不同程度肝硬化的可行性。Wang等[14]初步整合肝包膜几何特征与肝实质纹理特征,通过尝试不同分类器,筛选出非侵入性评估肝硬化的量化参数;Sugimoto等[15]则基于CEUS微血管成像评价肝内血管分支形态变化对肝纤维化分期的影响,并提出3个与门静脉形态改变有关的特征,虽然达到90%置信度,但仅基于临床医生主观指导,且样本小。通过机器学习研究肝硬化患者肝内血管的拓扑结构将是今后的方向和重点。
