对比细针穿刺细胞学检查、测定穿刺洗脱液甲状腺球蛋白及BRAF基因诊断甲状腺乳头状癌颈部淋巴结转移的效能
2019-12-19陈荣荣王兴田陈大伟武心萍王玉乔
陈荣荣,王兴田,陈大伟,武心萍,王玉乔
(1.徐州医科大学附属医院超声科,江苏 徐州 221000;2.南京中医药大学沭阳附属医院超声科,江苏 沭阳 223600;3.南京中医药大学附属中西医结合医院超声科,江苏 南京 210028)
近年来,甲状腺癌已成为头颈部最常见的恶性肿瘤,甲状腺乳头状癌(papillarythyroid carcinoma, PTC)是其主要病理类型,且易经淋巴道转移,术前超声检查或术后超声复查时常可发现颈部可疑转移淋巴结,早期准确评估淋巴结转移可为临床诊疗提供可靠依据。《甲状腺癌诊疗规范(2018年版)》[1]指出,对此类可疑淋巴结可行细针穿刺(fine needle aspirate, FNA)术,对穿刺标本常规行细针穿刺细胞学检查(fine needle aspirate cytology, FNAC),FNAC检测PTC转移淋巴结具有较高特异度,但敏感度不高[2],而测定FNA洗脱液中甲状腺球蛋白(FNA-thyroglobulin, FNA-Tg)可增加发现PTC转移淋巴结的敏感度。BRAF基因是甲状腺癌的分子标记物,对其进行检测可提高PTC转移淋巴结的检出率[3-4]。本研究比较FNAC、FNA-Tg和BRAF基因对超声疑似PTC转移淋巴结的诊断效能。
1 资料与方法
1.1 一般资料 回顾性分析2018年2月—2019年2月95例于南京中医药大学沭阳附属医院及附属中西医结合医院接受甲状腺改良根治术并经病理证实为PTC 患者,男25例,女70例,年龄14~76岁,平均(41.2±12.9)岁;于甲状腺改良根治术前(n=67)或术后(n=28)接受超声检查。纳入标准(符合以下任意征象):①淋巴结趋于圆形(短轴增大,与长径比值趋近于1);②淋巴门回声消失或皮髓质分界不清;③淋巴结内出现微钙化、部分囊性变或呈高回声;④异常血流分布[5-6]。对可疑淋巴结行FNA,对穿刺标本均采用FNAC、FNA-Tg、BRAF基因3种方式进行检测,最终经手术切除可疑淋巴结获得病理诊断结果。本研究经过南京中医药大学沭阳附属医院及附属中西医结合医院伦理委员会同意,患者均无穿刺禁忌证,术前签订知情同意书。
1.2 仪器与方法
1.2.1 超声引导下FNA 采用GE Logic E9或Hitachi HI Vision Preirus超声诊断仪,探头频率9~15 MHz。检查时嘱患者仰卧,垫高其颈肩以充分暴露颈部,经超声探查确定可疑淋巴结位置。颈前区消毒、铺巾,于超声引导下以22G注射器针头穿刺可疑淋巴结,负压抽吸病灶组织3~5次,重复穿刺进针2~3次,以获取足量样本用于诊断。
1.2.2 FNAC检测 将抽取组织推出适量于防脱玻片上,待其稍干后放入无水乙醇内固定,HE染色后,由3位病理科医师协同阅片并做出诊断,意见不一致时请上级主任医师会诊,以出现核沟、核内假包涵体、毛玻璃样核、多核巨细胞及砂粒体等细胞者为阳性标本[7],余为阴性标本。
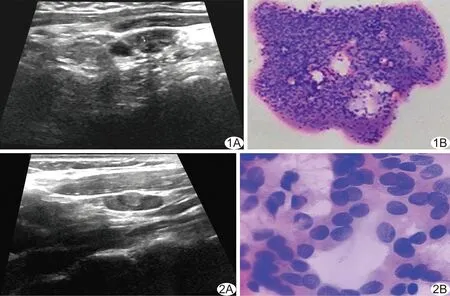
图1 患者女,65岁,PTC,颈部反应性增生淋巴结 A.声像图示左颈部Ⅲ区淋巴结,淋巴门显示不清,边缘见2处低回声暗区; B.穿刺涂片:血液背景中见大量淋巴细胞,考虑反应性增生淋巴结(HE,×100) 图2 患者女,48岁,PTC,颈部转移淋巴结 A.声像图示右侧颈部Ⅱ区淋巴结,淋巴门显示不清,内见高回声团凸出淋巴结轮廓; B.穿刺涂片示镜下见成团细胞,拥挤重叠排列,核大、浓染,内见纵形核沟样结构,考虑符合甲状腺乳头状癌(HE,×200)
1.2.3 FNA-Tg测定 将针管及针尖放入1ml生理盐水内反复抽吸冲洗,对冲洗后的液体采用电化学发光免疫分析法测定Tg值[8-9]。绘制FNA-Tg诊断转移淋巴结的ROC曲线,获得其截断值。
1.2.4 BRAF基因检测 取新鲜穿刺细胞,提取DNA样本,按人类BRAF基因V600E突变检测试剂盒(厦门艾德生物公司,荧光PCR法)操作说明,将洗脱液及盒内各试剂加入PCR反应管内后放入实时PCR仪器,收集信号并进行分析,判断样本基因是否突变,突变者为阳性[4]。
1.3 统计学分析 采用SPSS 20.0及Medcalc 18.2统计分析软件。符合正态分布的定量资料以±s表示。以病理结果为金标准,绘制3种方法的ROC曲线,得到FNA-Tg值诊断淋巴结转移的截断值及3种方法的AUC,以Z检验比较AUC差异,计算3种检测方法的敏感度、特异度、阳性预测值、阴性预测值及准确率。P<0.05为差异有统计学意义。
2 结果
95例患者共118枚可疑淋巴结,其中23例有2枚可疑淋巴结,72例有1枚可疑淋巴结;术后病理证实86枚为转移淋巴结,32枚为反应性增生淋巴结或正常淋巴结。见图1、2。
3种检测方法与病理结果对照见表1。FNAC诊断转移淋巴结的敏感度、特异度、阳性预测值、阴性预测值及准确率分别为63.95%(55/86)、100%(32/32)、100%(55/55)、50.79%(32/63)及73.73%(87/118)。FNA-Tg值诊断转移淋巴结的截断值为41.65 ng/ml,敏感度、特异度、阳性预测值、阴性预测值及准确率分别为91.86%(79/86)、100%(32/32)、100%(79/79)、82.05%(32/39)及94.07%(111/118)。BRAF基因检测方法诊断转移淋巴结的敏感度、特异度、阳性预测值、阴性预测值及准确率分别为80.23%(69/86)、100%(32/32)、100%(69/69)、65.31%(32/49)及85.59%(101/118)。
FNAC、FNA-Tg及BRAF基因检测诊断转移淋巴结的AUC分别为0.820(P=0.026)、0.991(P=0.005)及0.874(P=0.027),FNAC与FNA-Tg(Z=6.345,P<0.001)、FNA-Tg与BRAF基因(Z=4.248,P<0.001)检测AUC差异均有统计学意义,FNAC与BRAF基因检测差异无统计学意义(Z=1.651,P=0.099),见图3。

表1 3种检测与术后病理结果对比(枚)
3 讨论
PTC早期易经淋巴道转移。高分辨率超声可较早发现颈部疑似转移淋巴结,其典型征象包括:①淋巴结肿大、形态趋于圆形;②淋巴结局部或整体回声增高、淋巴结内囊性变、淋巴结内钙化灶;③淋巴门结构消失、皮髓质分界不清;④淋巴结血流分布呈周围型或混合型,但仅凭以上任一征象均不能完全确定为转移淋巴结[5-6]。超声引导下FNA能明确淋巴结性质,尤其对于颈侧区淋巴结,有利于避免因二次颈侧区淋巴结清扫带来的创伤及术后并发症,如神经损伤、颈部运动障碍等。

图3 FNAC、FNA-Tg、BRAF基因检测3种方法诊断PTC颈部转移淋巴结的ROC曲线
作为最直观的证据,穿刺标本FNAC检查特异度高,但受操作者熟练程度、淋巴结囊性变等因素干扰,敏感度及准确率并不理想,本研究中其敏感度为63.95%,特异度为100%,与既往研究[4]报道相似。
Tg由甲状腺滤泡上皮细胞大量合成并释放到甲状腺滤泡腔内[10]。PTC肿瘤细胞也可合成Tg,肿瘤细胞转移至淋巴结时,其分泌Tg形成的聚集胶质小囊增加反射界面,在声像图上表现为回声增高;肿瘤细胞破坏淋巴结组织可形成囊性变。测定FNA-Tg可得到增高的Tg值。本研究中FNA-Tg诊断转移淋巴结的截断值为41.65 ng/ml,与既往研究[11-12]报道的10 ng/ml有所差异,分析可能原因:①纳入样本数量及良恶性构成比不同;②既往研究多以甲状腺改良根治术后患者为观察对象,本研究同时纳入术前及术后患者;③不同操作者熟练程度不同;④仪器不同造成的系统误差;⑤分化类型不同的甲状腺癌细胞FNA-Tg值也有差异,分化较差的甲状腺癌细胞FNA-Tg值可呈低水平[2];⑥不同超声表现的可疑淋巴结FNA-Tg值存在差异,FNA-Tg法对于存在囊性变淋巴结的敏感度较高[11]。本研究中FNA-Tg诊断转移淋巴结的敏感度为91.86%,特异度为100%,与既往研究结果[11-12]相差不大,提示测定FNA-Tg可有效提高可疑淋巴结的检出率。
BRAF蛋白是参与丝裂原活化蛋白激酶(MARK)信号通路的酶,V600E是PTC患者BRAF基因最常见的突变,约占98.0%。有研究[13-14]发现BRAF基因突变与PTC预后相关,是PTC临床和转移行为的风险因素,且BRAF基因检测用于PTC疑似淋巴结的诊断效能已得部分研究证实。本研究中检测BRAF基因诊断转移淋巴结的敏感度为80.23%,特异度为100%,与既往文献[4]报道相似。
以上3种检测方法原理不同,其对PTC疑似转移淋巴结的诊断效能尚不明确。本研究FNA-Tg检测对疑似PTC转移淋巴结的诊断效能高于其他2种方法,且其操作简单、价格低廉,推荐以其作为参考依据之一。
本研究的局限性:①样本量较小;②纳入病例均为住院接受手术治疗者,恶性病变居多,样本存在偏倚。
