9%吡唑醚菌酯微囊悬浮剂的制备与性能研究
2019-12-18王仁飞范文娟秦敦忠张小祥
王仁飞,范文娟,王 丹,秦敦忠,张小祥
(南京林业大学化学工程学院,南京 210037)
吡唑醚菌酯(pyraclostrobin)是德国巴斯夫公司于1993年开发的甲氧基丙烯酸酯类杀菌剂[1]。但其存在水解和光解等问题,在实际应用时会造成有效成分的流失。同时,吡唑醚菌酯原药存在多种晶型,制备成高含量悬浮剂或与其他原药复配时,容易产生物理不稳定现象,如结底、析晶、膏化等。因此,根据市场应用情况需要研究一种环保、稳定的吡唑醚菌酯剂型。微囊悬浮剂将有效成分包覆进高分子壁材内,能防止有效成分分解,并能提高制剂的物理稳定性[2-3]。
关于吡唑醚菌酯微囊悬浮剂的研究主要有以下几种。王岩等[4]以脲醛树脂为壁材,采用原位聚合法制备吡唑醚菌酯微囊悬浮剂。该工艺制备复杂,壁材中使用大量甲醛,对周围环境和人体健康产生危害。王宁等[5]以丙烯酸丁酯和N-异丙基丙烯酰胺的共聚物为囊壁材料,通过乳液聚合法制备了吡唑醚菌酯微囊悬浮剂,但所制备的微囊包封率偏低,仅为78.30%。管磊等[6]以聚氨酯为壁材,采用界面聚合法制备20%吡唑醚菌酯微囊悬浮剂。闫宪飞[7]以三聚氰胺甲醛树脂为囊壁材料,通过原位聚合法制备了吡唑醚菌酯微囊悬浮剂。芮佳佳等[8]以聚己内酯为壁材,丙酮为溶剂,通过溶剂提取法制备吡唑醚菌酯微胶囊剂和悬浮剂的混合剂型,该方法使用大量的有机溶剂,容易对环境产生不良影响。
本研究采用界面聚合法,制备了以聚脲为壁材的9%吡唑醚菌酯微囊悬浮剂。考察了囊芯溶剂种类、乳化剂种类、芯壁比、固化温度、固化时间等因素对微囊粒径和稳定性的影响。对所制备的微囊悬浮剂进行性能表征测定,并以斑马鱼作为试验对象,对制剂毒性进行研究。
1 材料与方法
1.1 试验材料和仪器
97%吡唑醚菌酯原药,河北深泰化工有限公司;30%吡唑醚菌酯悬浮剂,江苏精禾界面科技有限公司;二苯基甲烷二异氰酸酯(MDI),山东西亚化学工业有限公司;二元胺,国药集团化学试剂有限公司;溶剂油150#、溶剂油100#,江苏华伦化工有限公司;二甲苯、无味煤油,南京道宽华工科技有限公司;油酸甲酯,苏州丰倍生物科技有限公司;乳化剂SP-7125、SP-7123、OP-10、By125,分散剂SP-7270,江苏擎宇化工科技有限公司;有机硅消泡剂,南京立人高分子材料有限公司;卡松,南京古田化工有限公司;黄原胶,上海万照精细化工有限公司;甘油,济南创世化工有限公司。
高剪切分散乳化机(FM200A),上海弗鲁克仪器有限公司;电动搅拌器(YDK-75-6),金坛杰瑞尔电器有限公司;隔水式培养箱(GHP-9080),上海精恒仪器制造有限公司;冰箱(BCD-258WDPM),青岛海尔股份有限公司;光学显微镜(BM2000),南京江南永新光学有限公司;扫描电子显微镜(EM-30Plus),韩国库赛姆公司;激光粒度分布仪(Bettersize2600),丹东百特仪器有限公司;液相色谱仪(LC-20AD),岛津公司;红外光谱仪(VERTEX 80V),德国布鲁克(Bruker)公司。
1.2 吡唑醚菌酯微囊悬浮剂的制备及原理
制备步骤:称取一定量的吡唑醚菌酯原药溶解在溶剂中,待完全溶解后加入油性单体MDI,并充分搅拌形成油相;然后将油相倒入水相中,进行高速剪切得到水包油乳液;将此混合液转移到四口烧瓶中继续搅拌,边搅拌边缓慢滴加水性单体二元胺水溶液,继续搅拌,并进行保温固化,制得吡唑醚菌酯微囊。在制得的微囊中加入分散剂、增稠剂、防腐剂等助剂形成微囊悬浮剂。
吡唑醚菌酯微囊悬浮剂制备工艺流程见图1。
1.3 性能表征的测定
参照文献[9-10]中关于微囊悬浮剂的各项性能指标,对制得的9%吡唑醚菌酯微囊悬浮剂样品进行性能表征测定。
1.3.1 形貌观察和粒径测定
通过光学显微镜和扫描电子显微镜观察制剂的微观形貌并拍照;用激光粒度分布仪测定制剂的粒径分布和平均粒径。
1.3.2 悬浮率的测定
用标准硬水将待测试样配制成适当浓度的悬浮液。在规定条件下,于量筒中静置一段时间,测定底部25 mL悬浮液中有效成分质量分数,计算其悬浮率。试样中有效成分悬浮率w(%)按下式计算。
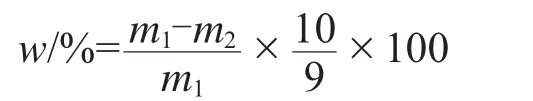
式中:m1为配制悬浮液所取试样中有效成分质量,g;m2为留在量筒底部25 mL悬浮液中有效成分质量为换算系数。
1.3.3 红外光谱分析

图1 吡唑醚菌酯微囊悬浮剂制备工艺流程
红外光谱分析采用溴化钾压片法和液体涂膜法,采用VERTEX 80V型红外光谱仪对吡唑醚菌酯原药、MDI、吡唑醚菌酯微囊悬浮剂进行表征分析。红外光谱仪扫描范围为500~4 000 cm-1,分辨率为4.0 cm-1。
1.3.4 pH值的测定
称取1 g待测微囊悬浮剂,于100 mL烧杯中,加入100 mL水,搅拌,静置,将冲洗干净的玻璃电极和饱和甘汞电极插入试样溶液中,测定pH值,重复3次,以其平均值为该试样值。
1.3.5 贮存稳定性的测定
(1)热贮稳定性。将待测样品装入安瓿瓶中,密封后放置于(54±2)℃的恒温烘箱中,静置14 d后取出,冷却至室温。分别检测记录外观、流动性、粒径、有效成分含量、悬浮率等指标有无变化,若贮存前后相同或有轻微变化,视为热贮稳定性合格。
(2)冷贮稳定性。将待测样品装入安瓿瓶中,密封后置于(0±2)℃下冷贮7 d后取出,恢复至室温。分别检测记录外观、流动性、粒径、有效成分含量、悬浮率等指标有无变化,若贮存前后相同或有轻微变化,视为冷贮稳定性合格。
1.3.6 制剂释放速率的测定
取少量微囊悬浮剂,稀释40倍后涂抹在载玻片上,通过显微镜观察不同时间下微囊的形貌变化。
1.3.7 制剂毒性的测定
将9%吡唑醚菌酯微囊悬浮剂和30%吡唑醚菌酯悬浮剂稀释至0.08 mg/L,以斑马鱼作为研究对象,在两种稀释液中各放入5条大小接近、健康活泼的斑马鱼个体用于试验。观察并记录不同时间内供试鱼的中毒症状和死亡条数,判断斑马鱼死亡的标准是用玻璃棒敲击鱼的尾部无反应。
2 结果与分析
2.1 囊芯溶剂的筛选
吡唑醚菌酯原药为类白色固体,直接加热至65℃时就能使其融化,但其黏度较大,需要通过溶剂调节成黏度合适的均一油相才能被包覆。制备吡唑醚菌酯微囊时要求囊芯溶剂对原药有较高的溶解度,溶剂对制剂的黏度要合适而且还应性质稳定,不与其他物质反应[11]。本实验的吡唑醚菌酯和溶剂质量比为3∶7,加热至50℃后原药溶解,比较不同温度下溶剂对吡唑醚菌酯的溶解情况。由表1可知,无味煤油与吡唑醚菌酯不能形成均相液体,不适合做囊芯溶剂。油酸甲酯、溶剂油100#、溶剂油150#和二甲苯在常温时,对吡唑醚菌酯溶解度相似,但从0℃冷贮溶解稳定性可以看出,溶剂油150#和二甲苯析晶需要的时间更长,说明溶解度更高。因溶剂油150#比二甲苯更环保,故选用溶剂油150#为囊芯溶剂。

表1 吡唑醚菌酯在不同溶剂中的溶解稳定性
2.2 乳化剂种类的筛选
乳化剂是一种亲水亲油的两性分子,亲水基和亲油基分别位于乳化剂两侧,在乳化过程中能够降低水油两相间的界面张力,使乳滴在相互碰撞时不易聚集[12]。由表2可知,使用不同乳化剂制备的微囊形貌差异较大。以SP-7125为乳化剂时微囊形貌规整,大小均匀。因此,选择SP-7125作为制备吡唑醚菌酯微囊的乳化剂。

表2 乳化剂种类对微囊制备的影响
2.3 芯壁比对微囊稳定性的影响
芯壁比是指芯材和壁材油溶性单体MDI的质量比。由表3可知,当芯壁比大于100∶3时,微囊贮存稳定性差,有晶体析出。这可能是由于芯壁比过大致使芯材不能被完全包覆。当芯壁比为100∶5时,固化阶段反应过于迅速,体系黏度不断增大,最终导致膏化。当芯壁比为100∶3和100∶4时,制剂稳定性合格,但从原料成本考虑,最终确定芯壁比为100∶3。

表3 芯壁比对微囊制备的影响
2.4 固化温度对微囊贮存稳定性的影响
固化温度直接影响囊壁材料的反应速率。由表4可知,当固化温度为55℃时容易产生浮油。这是由于低温固化聚合反应速度慢,囊壁材料交联程度不够,所形成的聚脲相对分子质量较低,不能及时形成致密的网状结构。温度在60~75℃时,囊形完好。固化温度高于75℃时微囊形貌发生变化,微囊之间彼此黏连,这是由于高温固化时反应过于激烈,反应不均导致。因此,优选温度区间为60~75℃,结合吡唑醚菌酯熔点为65℃,固化温度选用65℃。

表4 固化温度对微囊制备的影响
2.5 固化时间对微囊贮存稳定性的影响
固化时间对微囊的贮存稳定性具有重要影响。由表5可知,固化时间小于6.5 h时,微囊贮存稳定性差,冷贮有晶体出现。这主要是因为囊壁反应未完全,囊壁交联度不够,造成破囊。延长固化时间能够提高稳定性,当固化时间等于或超过6.5 h时,此时制备的微囊贮存稳定性皆合格。因此,优选固化时间为6.5 h。

表5 固化时间对微囊制备的影响
结合图2可知,异氰酸酯基团在2 270 cm-1处有很强的吸收峰,而65℃固化6.5 h后形成的吡唑醚菌酯微囊吸收峰在此处消失,表明体系中MDI和二元胺反应完全。囊壁材料在3 440 cm-1处有单峰吸收,说明异氰酸酯基团与氨基基团之间发生了反应,生成了聚脲。598 cm-1和935 cm-1处的吸收峰是吡唑环骨架上次甲基振动产生的,吡唑醚菌酯原药和吡唑醚菌酯微囊的红外谱图相比,吡唑醚菌酯原药特征吸收峰强度在微囊中有明显减弱。聚脲囊壁材料和吡唑醚菌酯原药的特征峰都出现在了吡唑醚菌酯微囊的图谱中,且没有新的吸收峰出现,表明吡唑醚菌酯原药被包封于微囊中。
综合以上结果,选择65℃固化6.5 h,得到的微囊样品最稳定,且囊球彼此间分散均匀。
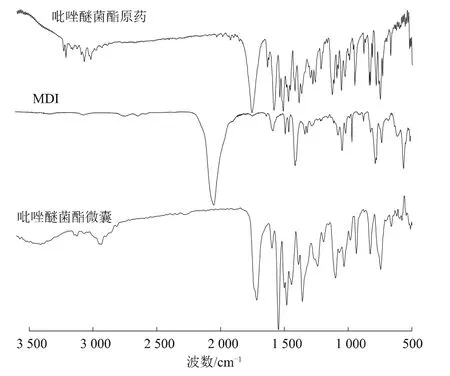
图2 红外谱图
2.6 微囊及微囊悬浮剂的检测与表征
根据以上实验结果,确定吡唑醚菌酯微囊悬浮剂配方(表6)。

表6 吡唑醚菌酯微囊悬浮剂配方
2.6.1 制剂控制项目指标检测
制剂各性能指标检测结果显示,9%吡唑醚菌酯微囊悬浮剂的各项性能指标符合标准[10],并且制剂贮存稳定性合格,检测结果见表7。

表7 吡唑醚菌酯微囊悬浮剂性能评价
2.6.2 吡唑醚菌酯微囊悬浮剂形貌分析
通过光学显微镜和扫描电子显微镜观察微囊的形貌。图3(a)为吡唑醚菌酯微囊的光学显微镜图,可以看出微囊分布比较均匀且无明显的粘连现象。图3(b)为吡唑醚菌酯微囊的电镜拍摄图,可以清晰地看出微囊形貌圆整,表面光滑。

图3 吡唑醚菌酯微囊形貌
2.6.3 自然晾干条件下吡唑醚菌酯微囊悬浮剂释放速率
将制备的9%吡唑醚菌酯微囊悬浮剂稀释40倍后,涂抹于载玻片上,25℃下自然晾干,通过光学显微镜观察不同时间内微囊的形貌变化。由图4可知,所制备的吡唑醚菌酯微囊悬浮剂自然晾干30 min时,微囊形貌仍然为光滑球型。自然晾干60 min时微囊形貌发生明显变化,吡唑醚菌酯原药流出。其释放较为迅速,因此所制备的吡唑醚菌酯微囊悬浮剂为速释型。

图4 吡唑醚菌酯微囊悬浮剂在自然晾干条件下不同时间段的光学显微镜图片(400倍)
2.6.4 吡唑醚菌酯微囊悬浮剂在水中的释放速率
将制备的9%吡唑醚菌酯微囊悬浮剂稀释40倍后,静置一段时间,移出上层清液,通过显微镜观察9%吡唑醚菌酯微囊悬浮剂在水中浸泡后微囊的形貌变化。由图5可知,所制备的吡唑醚菌酯微囊悬浮剂在水中静置180 min时,其形貌均无明显变化,因此所制备的吡唑醚菌酯微囊悬浮剂在水溶液中释放较为缓慢。
2.6.5 吡唑醚菌酯微囊悬浮剂对斑马鱼的活性影响
将9%吡唑醚菌酯微囊悬浮剂与30%吡唑醚菌酯悬浮剂稀释至相同倍数,并将斑马鱼放置在稀释液中,观察斑马鱼的游动情况,结果见表8。斑马鱼在30%吡唑醚菌酯悬浮剂溶液中5 min时出现中毒现象,30 min时斑马鱼全部死亡;而斑马鱼在9%吡唑醚菌酯微囊悬浮剂溶液中90 min后才出现中毒现象,240 min时彻底死亡。因此通过微囊化技术制备的制剂能够明显降低吡唑醚菌酯对斑马鱼的毒性。

图5 吡唑醚菌酯微囊悬浮剂在水中不同时间段的光学显微镜图片(400倍)

表8 吡唑醚菌酯制剂对斑马鱼活性的影响
3 结论
本研究以聚脲为囊壁材料,通过界面聚合法制备9%吡唑醚菌酯微囊悬浮剂。确定最佳配方及制备条件:囊芯溶剂选用150#溶剂油,乳化剂选用SP-7125,用量为水相质量的2.5%;芯壁比为100∶3;固化温度65℃,固化时间6.5 h。所得微囊表面光滑,形态圆整,平均粒径2.5 μm,包封率大于90%,贮存稳定性合格。与悬浮剂相比,所制备的9%吡唑醚菌酯微囊悬浮剂能够明显降低对斑马鱼的毒性。
