沉默Notch-1基因影响人膀胱癌RT4细胞生物学行为的体外实验研究
2019-12-18郑克文陈洪德卢湧湧吴可明邓哲宪翁志梁余志贤
郑克文,潘 悦,黄 航,陈洪德,卢湧湧,吴可明,邓哲宪,翁志梁,余志贤,陈 伟
膀胱癌是泌尿系统最常见的恶性肿瘤之一,严重威胁着人类的生命健康。据统计,世界范围内,每年新发膀胱癌患者数逾30万,在人类常见肿瘤中位居前列[1]。非肌层浸润性膀胱癌的治疗主要以手术联合术后膀胱灌注化疗为主。由于膀胱癌发病率高且术后复发率高,因此,研究膀胱癌发生发展相关的基因并寻找潜在的治疗靶点迫在眉睫。Notch-1广泛存在于各种细胞生物学行为过程中,参与多种细胞的增殖分化。研究显示,膀胱癌细胞中Notch1的表达量与其恶性程度呈正比[2-3],抑制Notch-1的表达可以抑制膀胱癌细胞的增殖[4]。但Notch-1基因对于膀胱癌细胞的具体作用机制目前尚不清楚。因此,本文以人膀胱癌RT4细胞为研究对象,通过沉默Notch-1,观察其对RT4细胞增殖、侵袭、凋亡及上皮间质转化等生物学行为的影响,为临床治疗膀胱癌提供潜在靶点及相应的理论依据。
1 材料与方法
1.1 实验材料 人膀胱癌RT4细胞(中国科学院上海细胞库);TEMED、丙烯酰胺(Amreso公司);BCA蛋白浓度测定试剂盒、RIPA裂解液、PMSF、磷酸酶抑制剂(上海碧云天公司);PLVX-shRNA2载体(美国Addgene公司);Trizol试剂,限制性内 切 酶EXORI、BamHI(美 国Thermo Fisher公司);逆转录试剂盒、SYBR Green PCR试剂盒(大连Takara公司);兔单抗E-cadherin、N-cadherin、Vimentin、Bcl-2(美国CST公司);兔多抗Bad、兔单抗Bid(英国Abcam公司);Transwell小室(美国BD公司);细胞凋亡检测试剂盒、细胞周期检测试剂盒(南京凯基生物有限公司)。
1.2 细胞的复苏、培养 将人膀胱癌RT4细胞从-80℃冰箱取出后,按照“慢冻速溶”原则进行复苏,将细胞置于事先升温至37 ℃ 的水浴锅中使其融化,融化时间不超过1 min,然后将细胞分别培养于含有10%胎牛血清的RPMI-1640培养基(100 U/mL青霉素和0.1 mg/L的链霉素),并置于37℃,5% CO2恒温培养箱中进行培养。
1.3 质粒的构建及转染 本试验所用干扰序列于吉玛生物合成,序列如下:Notch1-shRNA上游序列:GATCCCCAACATCCAGGACAACATTTCAA GAGAATG TTGTCCTGGATGTTGGTTTTTTCT CGAGG,下 游 序 列:AATTCCTCGAGAAAA AACCAACATCCAGGACAACATTCTCTTG AAATGTTGTCCTGGATGTT GGG;shRNANc上 游 序 列:GATCCTTCTCCGAACGTGTC ACGTTTCAAGAGAACGTGACACGTCGGA GAATTTTTTCTCGAGG,下游序列:AATTCCTC GAGAAAAAATTCTCCGAACGTGTCACGTTCT CTTG AAACGTGACACGTCGGAGAAG。序列退火成双链后,连接克隆到经EXORI、BamHI酶切的PLVX-shRNA2载体上。然后转化到感受态的大肠杆菌DH5α后,挑单克隆提取质粒并行测序分析,验证得到正确克隆的质粒。取对数生长期细胞于24孔板中,调整细胞浓度,使每个孔中的细胞数约为4×105个,在细胞融合度为70%~80%时进行转染。按照Lipofectamine 2000转染说明书对RT4细胞进行转染操作,转染8 h后更换含有氨苄青霉素(30 μg/mL)的培养基,继续于含5%CO2的37 ℃恒温培养箱中培养,48 h后取出培养板,收集细胞进行后续实验,并用RT-PCR法分别检测T24细胞中Notch-1的表达。实验共分为2组,分别为Notch-1阴性对照组(shRNA NC),Notch-1干扰组(Notch-1 shRNA)。
1.4 MTT检测细胞增殖变化 取对数生长期细胞,调整细胞密度到5×104个/mL,接种于96孔板中,每孔100 μL细胞悬液,置于5% CO2,37℃的恒温培养箱中培养过夜,然后向每孔中加入10 μL的MTT检测液,37 ℃培养4 h,吸弃培养基,加入150 μL的DMSO震荡10 min,然后将96孔板置于酶标仪中,于568 nm波长处测定各孔的吸光度。
1.5 Transwell法检测细胞侵袭能力变化 将转染成功后继续培养48 h的各组细胞分别用0.25%的胰蛋白酶进行消化收集,1000 r/min离心5 min,弃上清,用预冷的PBS清洗2次,然后在无血清培养基中对细胞进行重悬,采用细胞计数板进行计数,然后在24孔板中加入含有10% FBS的培养基,在Transwell小室上室底部中央垂直加入100 μL终浓度为1 mg/mL的Matrigel,待Matrigel凝固后在Transwell上室分别加入200 μL的细胞悬液,5% CO2,37 ℃培养箱中培养24 h,然后取出Transwell,用PBS小心清洗小室,用10%甲醇溶液对细胞进行固定30 min,然后切下膜,滴入5%结晶紫染液,室温静置20 min后,显微镜下进行观察拍照。
1.6 流式细胞术检查细胞凋亡的变化 取转染继续培养48 h后的各组细胞,用0.25%胰酶消化,充分吹打混匀细胞悬液并收集至流式专用管中;取约105个重悬细胞,1200×g,4℃离心5 min,弃上清;加入1 mL预冷PBS进行重悬,1200×g,4 ℃离心5 min,弃上清,重复两次;按照AnnexinVAPC/7-AAD细胞凋亡检测试剂盒说明书进行检测,将细胞重悬于50 µL binding buffer,加入5 µL 7-AAD,轻轻混匀,4 ℃,避光孵育15 min;再加入450 µL binding buffer,混匀,加入1 μL Annexin V-APC混匀,室温下避光反应15 min,然后进行流式细胞仪上机检测。
1.7 RT-PCR检测E-cadherin、N-cadherin、vimentin、Bcl-2、Bad、Bid mRNA表达情况 转染后,继续培养48 h,采用Trizol法提取各组细胞的总RNA,然后根据逆转录试剂盒说明书反转录成相应的cDNA。利用Real-time PCR检测E-cadherin、N-cadherin、Vimentin、Bcl-2、Bad、Bid mRNA表达水平(引物序列见表1),PCR反应程序:50 ℃,2 min;95 ℃,10 min;95 ℃,30 s;60 ℃,30 s,40个循环;65 ℃,5 min;95 ℃,50 s。以GAPDH作为内参,结果采用2-△△Ct法进行分析。

表1 引物序列表
1.8 Western blot检 测E-cadherin、N-cadherin、Vimentin、Bcl-2、Bad、Bid蛋白表达情况 转染后继续培养细胞48 h,然后收集并提取各组细胞的蛋白,采用BCA蛋白浓度检测试剂盒对所提取的蛋白进行浓度测定。然后取20 μg蛋白与4 μL 2×SDS上样缓冲液混合均匀,100 ℃变性10 min,上样,电泳,转膜后,用5%脱脂奶粉制成的封闭液进行封闭2 h,加入稀释后的 一 抗(Bcl-2:1∶1000;Bad:1∶500;Bid:1∶1000;Vimentin:1∶1000;E-cadherin:1∶500;N-cadherin:1∶1000;GAPDH:1∶1000),4 ℃孵育过夜,PBS洗膜后,加入HRP标记的二抗羊抗兔IgG(1∶50000),室温孵育1 h,然后用ECL化学发光检测,以目的蛋白光密度值/内参蛋白光密度值作为目的蛋白的光密度值,重复3次独立试验。
1.9 统计学分析 采用统计学软件SPSS 25.0进行数据分析,实验数据采用±s表示,组间比较采用独立样本t检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 Notch-1 shRNA载体构建 如图1所示,构建的Notch-1 shRNA载体经测序分析表明插入的序列及位点正确,目的基因Notch-1的干扰载体质粒构建成功。

图1 Notch-1 shRNA载体质粒测序鉴定
2.2 两组细胞Notch-1的表达变化 为了研究Notch-1在人膀胱癌RT4细胞中的作用,我们采用质粒转染的方法抑制了RT4细胞中Notch-1的表达,然后采用RT-PCR检测两组细胞中Notch-1的表达。结果如图2所示,与RT4+shRNA NC组相比,RT4+Notch-1 shRNA组的Notch-1 mRNA表达量明显下降(t=10.004,P<0.001)。
2.3 沉默Notch-1对膀胱癌RT4细胞增殖率的影响 结果如图3所示,与RT4+shRNA NC组相比,RT4+ Notch-1 shRNA组细胞增殖率明显降低(t=4.629,P=0.010)

图2 两组细胞Notch-1的表达水平变化

图3 两组细胞增殖率变化
2.4 沉默Notch-1对人膀胱癌RT4细胞的侵袭能力的影响 如图4所示,与阴性对照组(RT4+shRNA NC)相 比,Notch-1干 扰 组(RT4+Notch-1 shRNA)的迁移细胞数目明显减少(t=8.193,P=0.001)。
2.5 沉默Notch-1促进膀胱癌RT4细胞的凋亡 为了研究沉默Notch-1对人膀胱癌细胞凋亡的改变,我们采用流式细胞术对人膀胱癌RT4细胞进行了检测。结果如图5所示,与RT4+shRNA NC组相比,RT4+Notch-1 shRNA组的细胞凋亡率显著上升(t= -18.441,P<0.001)。
2.6 沉默Notch-1对膀胱癌RT4细胞E-cadherin、N-cadherin、Vimentin、Bcl-2、Bad、Bid mRNA表达的影响 如图6所示,与RT4+shRNA NC组比 较,RT4+Notch-1 shRNA组 中E-cadherin(t=-13.457,P<0.001)、Bad(t= -12.521,P<0.001)、Bid(t= -9.231,P<0.001)的mRNA表达量显著升 高,N-cadherin(t=6.505,P<0.001)、Vimentin(t=9.135,P<0.001)、Bcl-2(t=10.651,P<0.001)mRNA表达量显著降低。
2.7 沉默Notch-1对膀胱癌RT4细胞E-cadherin、N-cadherin、Vimentin、Bcl-2、Bad、Bid蛋 白 的影响 我们对人膀胱癌RT4细胞的凋亡及侵袭迁移相关蛋白表达水平进行了检测,结果如图7显示,与阴性对照组相比,干扰组E-cadherin(t=-5.610,P=0.005)、Bad(t= -6.983,P=0.002)、Bid(t= -8.871,P=0.001)蛋白表达量显著升高,N-cadherin(t=10.132,P=0.001)、Vimentin(t=5.630,P=0.005)、Bcl-2(t=6.973,P=0.002)蛋白表达量显著降低。

图4 两组迁移细胞数量变化(×200)

图5 两组细胞凋亡率的变化

图6 两组细胞E-cadherin、N-cadherin、Vimentin、Bcl-2、Bad、Bid mRNA表达水平变化
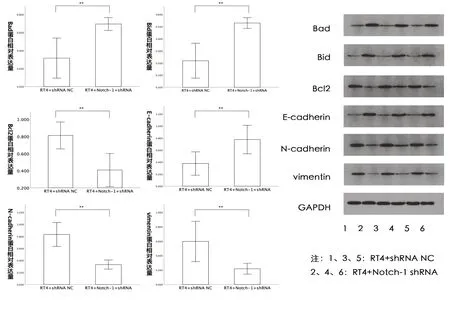
图7 两组细胞E-cadherin、N-cadherin、Vimentin、Bcl-2、Bad、Bid蛋白表达量变化
3 讨论
Notch信号通路大量存在于哺乳动物的体内,参与着体内众多的生命活动调节:维持细胞的分化、增殖和凋亡的动态平衡[5-6]。Notch信号通路由Notch受体、Notch配体及细胞内效应器分子所组成,Notch受体包括4种受体,分别为Notch-1、Notch-2、Notch-3、Notch-4、Notch配体 包 括JAG1、JAG2、DLL1、DLL3和DLL4。Notch信号通路的异常可以诱导多种肿瘤的发生,其中,Notch-1的异常表达在肿瘤组织中最常被发现。Notch-1可以通过影响相邻细胞之间的信息传递来维持干细胞的特性。Notch-1还可以通过影响细胞的增殖、分化和凋亡来参与各种类型肿瘤的发生发展[7-8]。李伟等[9]研究发现,Notch-1能够促进乳头状癌细胞增殖、侵袭和转移。郝俊龙等[10]发现,抑制Notch-1的表达能够抑制骨肉瘤细胞的生长。Shi等[3]研究发现,在膀胱癌中,Notch-1的表达量随着膀胱癌的病理分级升高而逐渐增加,肿瘤的生长与凋亡密切相关。Bcl-2家族蛋白在细胞凋亡过程中起着关键作用,Bcl-2基因是一种原癌基因,能够改变线粒体外膜的通透性,抑制细胞色素C释放到细胞质,从而阻止Caspase的活化级联,进而抑制细胞凋亡[11]。当Bcl-2呈高表达时,则抑制凋亡的发生;当Bcl-2呈低表达时,则促进凋亡[11]。Bid蛋白是Bcl-2家族中唯一含有1个BH-3结构域的重要的前凋亡分子,Bid 是促凋亡蛋白。在静息状态下,Bid以非激活状态分布在胞浆中,在细胞发生凋亡的过程中,全长的Bid通过多种蛋白酶被切割形成tBid,tBid转位到线粒体发挥凋亡功能[12]。Bad是Bcl-2相关死亡启动子,也是参与细胞凋亡的重要调控蛋白[12]。在本研究中,Notch-1抑制组细胞的增殖率和迁移数量显著降低,表明抑制Notch-1能抑制人膀胱癌RT4细胞增殖和迁移活动。Notch-1 shRNA组中凋亡相关蛋白Bad、Bid的表达量显著升高,抗凋亡蛋白Bcl-2的表达量显著降低,提示抑制Notch-1可以促进膀胱癌细胞的凋亡,这与以上Notch-1抑制细胞凋亡的结论相符。
上皮间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞在某些因素的刺激下,失去极性和细胞间的紧密连接,从而获得浸润性和游走性迁移的能力。生理情况下,上皮细胞发生EMT转化可以修复受伤的正常组织。在肿瘤的发生发展过程中,EMT发挥着重要的作用。转移是肿瘤死亡的主要原因,EMT是转移级联反应中的一个起始和重要事件,在转移级联反应中上皮癌细胞失去极性和细胞接触,细胞间相互作用及黏附力减弱,癌细胞的迁移能力增强,伴随着E- cadherin等蛋白的表达下降,E- cadherin表达的降低目前已被认为是EMT最显著的特征,可使癌细胞获得易于侵袭的特性,Vimentin、N-cadherin等蛋白的表达升高,使得癌细胞获得促进迁移和侵袭的间充质特征[13]。研究发现,Notch-1可以通过介导各种EMT相关基因的表达从而诱导EMT的发生[14-15]。E-cadherin、N-cadherin和Vimentin蛋白是EMT相关蛋白。E-cadherin广泛分布于胞膜和胞浆中,可维持上皮细胞间的紧密连接,对维持细胞的形态稳定具有重要的作用[16],N-cadherin则主要是介导神经组织及成纤维细胞之间的黏附,Vimentin广泛分布于细胞间质之间。Kang等[17]研究发现,抑制Notch-1基因可以通过促进E-cadherin的表达、抑制Vimentin的表达,从而减轻肺癌细胞的EMT[18]。研究发现Notch还可以通过促进N-cadherin的表达从而促进癌细胞发生EMT。因此,为了进一步研究Notch-1 shRNA是否通过抑制膀胱癌细胞EMT从而发挥其作用,我们分别采用RT-PCR和Western blot对EMT相关蛋白进行了检测。在本实验中,E-cadherin表达量显著升高,N-cadherin、Vimentin表达量显著降低。而E-cadherin与肿瘤的转移、侵袭关系密切,且其表达量与癌症患者的生存率呈正比[19-20],N-cadherin和Vimentin蛋白则具有促进细胞黏附和信号传导的作用[21],提示抑制Notch-1的活性可以抑制EMT相关蛋白的表达,从而抑制膀胱癌细胞的侵袭转移。
综上所述,抑制Notch-1的表达能够抑制人膀胱癌细胞的侵袭迁移,促进细胞凋亡,其机制可能与诱导Bad、Bid、E-cadherin,抑制Bcl-2、N-cadherin、Vimentin的表达有关。
