甲状腺乳头状癌患者术后首次131I治疗前血清psTg水平、psTg/TSH对清甲效果的预测效能
2019-12-17刘欣迪李智勇朱辉周青朱远唐梁思成
刘欣迪,李智勇,朱辉,周青,朱远,唐梁思成
(徐州医科大学附属医院,江苏徐州221002)
分化型甲状腺癌(DTC)是最常见的甲状腺恶性肿瘤,其中以甲状腺乳头状癌(PTC)最为多见,占85%~90%[1,2],部分患者在诊断时已发生颈部淋巴结转移或者远处转移,目前临床多采用手术治疗为基础联合术后选择性放射性碘(131I)治疗和TSH抑制治疗[3]方法。2015版美国甲状腺协会(ATA)指南[4]指出甲状腺球蛋白(Tg)水平在术后评估及131I个体化治疗决策中具有重要意义。虽然目前我国对术后131I治疗前刺激状态下的Tg(psTg)水平与131I治疗效果的关系进行了初步研究[5],但尚无明确的最佳psTg界值用以131I清甲效果的评估。此外,TSH是影响Tg水平的重要因素,国内关于psTg/TSH对131I清除残余甲状腺组织(清甲)疗效影响的研究报道尚少。本研究探讨了PTC患者首次131I治疗前血清psTg水平、psTg/TSH对其清甲效果的预测效能,现报告如下。
1 资料与方法
1.1 临床资料 2018年1~6月徐州医科大学附属医院收治PTC患者 80例,均经病理检查证实,均接受甲状腺全切术。其中男16例、女64例,年龄(45.7±11.5)岁。纳入标准:①组织学证实为PTC;②均接受甲状腺全切术,且术后首次予以131I清甲治疗;③符合131I清甲治疗标准。排除标准:①其他类型的甲状腺癌患者;②存在131I禁忌证,且术后无法完成随访者;③甲状腺癌合并其他甲状腺疾病者;④131I清甲治疗前TSH水平<30 mIU/L;⑤TgAb>115.00 kIU/L或未检测相应TgAb的患者。
1.2 血清Tg、TSH、TgAb的测定 分别于131I治疗前24 h和131I治疗后6个月采用电化学发光免疫分析法(ECLIA)(试剂由瑞士罗氏公司提供)测定Tg、TSH、TgAb水平。正常参考值:Tg:1.40~78.00 μg/L,TSH:0.27~4.20 mIU/L,TgAb:0.00~115.00 kIU/L。Tg测量值若超过其上下界则分别记为500.00 μg/L和0.04 μg/L,TSH测量值若超过其上下界则分别记为100.00 mIU/L和0.005 mIU/L。
1.3131I清甲治疗131I清甲治疗前检查包括:99mTcO4-甲状腺显像、胸部CT、颈部超声,psTg、TSH、TgAb水平的测定;参照ATA相应指南[4]进行131I治疗准备。患者甲状腺全切术后1~2个月行131I清甲治疗,治疗前3周停服左甲状腺素片,使患者TSH≥30 mIU/L。维持低碘饮食1~2周,在此期间患者避免使用含有碘的药物或者造影剂。根据指南相关内容和患者的自身情况,对其予以经验性131I清甲治疗,剂量为1.11~7.40 GBq。具体如下:3.70 GBq用于常规消融残留甲状腺组织;若131I清甲治疗前psTg水平较低时,予以剂量为1.11 GBq~2.96 GBq;若psTg水平过高,予以剂量为5.55~7.40 GBq。所有患者于131I清甲治疗48 h后予以左甲状腺素片治疗。在131I治疗后5 d予以131I全身显像。
根据2014版131I治疗分化型甲状腺癌指南[6],对于首次131I清甲治疗的患者,清甲治疗后6个月对清甲是否成功进行评估。清甲成功的判断标准:①停服左甲状腺素片2周后sTg<1 μg/L;②根据131I全身显像,在甲状腺床区无放射性浓聚灶。根据131I清甲治疗后6个月随访的sTg和131I全身显像结果将清甲疗效分为成功组和非成功组。
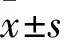
2 结果
成功组50例,男9例、女41例,年龄(44.7±10.3)岁,原发灶直径(1.30±1.00)cm,伴有颈部淋巴结转移37例、不伴有淋巴结转移13例。血清TSH 78.97(37.94~100.00)mIU/L、TgAb 16.58(10.00~61.56)kIU/L。非成功组30例,男7例、女23例,年龄(45.30±9.70)岁,原发灶直径(1.06±0.90)cm,伴有颈部淋巴结转移22例、不伴有淋巴结转移8例,血清TSH 76.57(33.00~100.00)mIU/L、TgAb 13.48(10.00~39.73)kIU/L。两组年龄、性别、原发灶直径、TSH、TgAb、颈部淋巴结转移情况差异均无统计学意义(P均>0.05)。
成功组psTg水平、psTg/TSH分别为8.12 μg/L、0.107,非成功组psTg水平、psTg/TSH分别为28 μg/L、0.313,两组psTg水平、psTg/TSH比较,P均<0.05。
血清psTg水平、psTg/TSH对PTC患者131I清甲效果的最佳预测界值分别为8.96 μg/L、0.118,ROC下面积分别为0.786、0.851,敏感性分别为67.5%、80.2%,特异性分别为81.8%、80.9%,Youden指数分别为0.513 5、0.571 4。血清psTg/TSH对应的ROC下面积和Youden指数均大于psTg,但差异无统计学意义;血清psTg/TSH对PTC患者131I清甲效果预测的敏感性高于psTg水平(χ2=4.157,P=0.041),见图1。
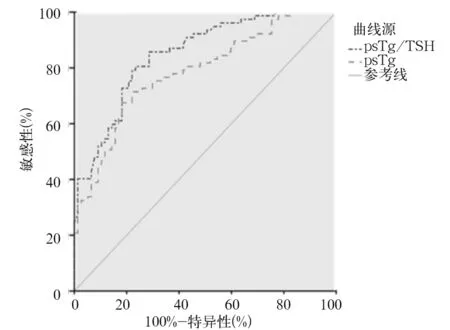
图1 血清psTg水平、psTg/TSH预测131I清甲治疗PTC效果的ROC
3 讨论
Tg是甲状腺产生的特异性蛋白,其主要由甲状腺滤泡上皮细胞分泌,在TSH等激素的作用下参与甲状腺激素的合成与释放。PTC来源于甲状腺滤泡细胞,因此其Tg分泌活跃。在甲状腺全切术后评估及131I清甲随访过程中Tg的监测通常有2种形式,包括TSH升高(≥30 mU/L)状态下测定的Tg和TSH在抑制状态下的抑制性Tg。本研究的psTg和sTg水平均为TSH在升高状态下测定的。Tg的监测以及131I清甲治疗的效果易受术后TgAb水平、原发病灶大小等[7~9]因素影响,为了使本研究的数据更具有说服力,本次入组的两组研究对象以上影响因素均无统计学差异。2009版ATA指南[10]已经将Tg水平作为131I治疗前风险评估及指导治疗决策的指标之一,2015版ATA指南再次强调了psTg水平对131I治疗的影响[4,11]。近几年国内外关于psTg水平在预测131I治疗效果的研究报道有很多[4,11,12],但仍无明确的最佳psTg水平预测界值点用以131I治疗效果的预测。
本研究得到的131I清甲成功率为62.6%,与夏俊勇等[13]报道的清甲成功率相近,但高于刘晔等[14]报道的131I清甲成功率43.0%,考虑原因可能与其研究中有53.0%的患者手术方式为腺叶切除有关。本研究得到的psTg水平预测PTC患者中131I清甲效果的最佳预测界值为8.96 μg/L,低于Zubair等[15]研究报道的最佳预测界值18.00 μg/L和马晓君等[16]课题组最新研究报道的最佳预测界值20.00 μg/L,笔者认为可能与本研究入组的研究对象的手术方式有关。有研究[17,18]报道,Tg水平易受残余甲状腺组织的影响,残余甲状腺组织越多,Tg水平就可能越高,而本研究入组的研究对象均为甲状腺全切术后,一定程度上消除了大量残余甲状腺组织这一影响因素对Tg的影响。也有一些研究报道的psTg水平预测界值范围为3.8~10 μg/L,本研究结果在其范围之内。此外,由于在不同研究报道中对清甲成功的定义有所差异,这也导致了研究结果的不同。本研究清甲成功的血清学sTg定义标准为小于1 μg/L,此标准对131I清甲成功的判定更为严格。因此笔者认为本研究得到的血清psTg水平预测界值可作为131I清甲效果的预测指标。
由于TSH是正常甲状腺或PTC细胞产生和释放Tg最重要的刺激因子,因此为了尽可能减少TSH对Tg分泌的影响,本研究进一步探讨了血清psTg/TSH预测131I清甲效果的效能,结果显示血清psTg/TSH在预测131I清甲成功方面优于血清psTg水平,提示血清psTg/TSH对术后131I清甲效果的预测效能更高。本研究得到的血清psTg/TSH最佳预测界值为0.118,低于近期一项研究结果0.35[15],考虑与前面所述psTg水平有差异的原因相同。因此,本研究得到血清psTg/TSH最佳预测界值亦可作为131I清甲效果的有效预测指标。
综上,本研究发现,首次131I治疗前血清psTg水平、psTg/TSH影响131I清甲治疗的效果,血清psTg水平、psTg/TSH越低,131I清甲成功的可能性越大;反之,清甲效果越差。血清psTg水平、psTg/TSH均可作为131I清甲成功的有效预测指标,血清psTg/TSH的敏感性更高。但是,本研究的样本量偏小,研究对象也具有地域局限性,需要扩大样本及研究范围去进一步证实本研究结论。
