热胁迫下水仙花叶片的转录组分析
2019-12-14宋姣敏徐小萍陈裕坤陈桂信赖钟雄
宋姣敏 徐小萍 陈裕坤 陈桂信 赖钟雄


摘 要 为研究水仙响应高温胁迫过程中相关基因的表达及响应热应激的分子机制,本研究以漳州水仙花为材料,使用BGISEQ-500测序技术,对高温(30、35 ℃)处理及正常生长条件(15 ℃)的水仙叶片进行转录组学的测序分析。使用Trinity软件对15(对照)、30、35 ℃(高温胁迫)处理24 h的水仙叶片测序数据进行从头组装,利用BLAST软件进行基因比对注释,通过DEGseq和PossionDis检测差异表达基因,并对差异表达基因进行GO和KEGG富集分析。结果表明:本次水仙花叶片测序共获得112 160条总长度为128 733 815 bp、平均长度为1147 bp的Unigene,其N50以及GC含量分别为1770 bp和42.33%。Nr比对注释匹配度最高的物种为石刁柏,利用KOG数据库进行比对,5560条Unigene序列分布于25个功能区域。差异表达基因GO富集显示与光合系统及膜系统相关的GO term被显著富集,KEGG分析顯示次生代谢物的生物合成、苯丙烷类生物合成、代谢途径、光合作用、糖胺聚糖降解、乙醛酸和二羧酸代谢、光合作用-天线蛋白、单萜类生物合成等8条代谢途径在3个比较组中均显著性富集,硫胺素代谢途径是唯一在高温胁迫条件下均显著富集的代谢途径。本研究注释了大量相关基因序列,通过本研究为改善水仙花植物的耐热性及耐热性品种的培育提供了丰富的数据资源和分子基础。
关键词 水仙;高温胁迫;转录组;差异表达基因中图分类号 S682.2+1 文献标识码 A
Analyses of Leaf Transcriptome under Heat Stress in Narcissus
SONG Jiaomin, XU Xiaoping, CHEN Yukun, CHEN Guixin*, LAI Zhongxiong*
College of Horticluture / Horticultural Plant Bioengineering Institute, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract To explore the pathways of response to heat stress and mechanism of heat-tolerance ofNarcissus tazetta var. chinensis, we used the BGISEQ-500 sequencing technology andde novotranscriptome assembly to gain a comprehensive overview of the transcriptome of the leaves under heat temperature (30 ℃, 35 ℃) and normal growth conditions (15 ℃). The data of RNA-Seq treated 24 h at 15, 30, 35 ℃ werede novoassembled using Trinity software. Gene annotation was performed using BLAST software, and differentially expressed genes were detected by DEGseq and PossionDis. A total of 112 160 unigenes were generated with a toal length of 128 733 815 bp, average length of 1147 bp and N50 of 1770 bp. For annotation functional,Narcissuswas highly similar to Asparagus officinalis species. On the basis of clusters of euKaryotic Orithologous Groups (KOG) analysis, 5560 unigene sequences were distributed over 25 functional regions. Gene Ontology (GO) enrichment of DEGs showed significant enrichment of GO term associated with photosynthetic systems and membrane systems. KEGG analysis showed significant enrichment of the pathways about the biosynthesis of secondary metabolites, phenylpropanoid biosynthesis, metabolic pathways, photosynthesis, glycosaminoglycan degradation, glyoxylic acid and dicarboxylic acid metabolism, photosynthesis-antenna proteins, monoterpenoid biosynthesis, etc. And the thiamine metabolc pathway was the only one that was significantly enriched under high temperature stress conditions. The study annotated a large number of related gene sequences, and would provide abundant data resources and molecular basis for improving the heat tolerance and heat tolerance ofNarcissus.
Keywords Narcissus; high temperature stress; transcriptome; differentially expressed gene
DOI10.3969/j.issn.1000-2561.2019.10.011
中国水仙别名雅蒜、天葱、丽兰等,是中国的十大传统名花之一,也是漳州市的市花,属石蒜科(Amaryllidaceae)水仙属(Narcissus)植物。不仅具有极高的观赏价值,还具有较高的经济价值[1]。中国水仙的生长发育期需要凉爽的气候,尤其是生长前期温度以12~20 ℃为宜,生长后期以20~24 ℃为宜,可耐0~2 ℃的低溫[2],主要用于春节前后水养观赏,是较受欢迎的春节花卉之一。
然而,水仙栽培存在切花上市时间迟、花期集中、供花期短等问题。因此,调节花期、延长上市时间是生产上迫切需要解决的问题。暖冬现象带来的气温普遍较高影响了花球的质量[3]。研究显示,温度越高,水仙花的开花周期(指从种球开始栽培到开花所需要的时间)越短,水仙花的盛开时间越短[4]。随着全球气候日益变暖,气温逐渐升高的气候变化特点日益突出[5],探究水仙在温度胁迫中的应对机制,筛选水仙热胁迫基因,提高水仙的抗高温能力以培育具有耐热性的品种是减轻温度升高对水仙生长与观赏价值产生严重影响的有效方法。
目前关于温度对水仙生命活动的影响主要集中在温度与水仙种球休眠的关系研究[6-9],尚未有与休眠相关的基因克隆[10]和耐热性相关的研究。叶片作为植物最基本最主要的活动场所,是植物对不同环境反应最敏感的器官,因此本研究以水仙花的叶片为测序材料,构建不同温度处理下的水仙花叶片转录组数据库,为探究水仙响应高温胁迫过程中相关基因的表达及响应热应激的分子机制,筛选与水仙耐热相关的基因,改善水仙花植物的耐热性及耐热品种的培育提供了丰富的数据资源和分子基础。
1 材料与方法
1.1材料
本实验转录组文库分析以金盏银台为研究对象,购置3年生的商品球,大小为一级(周长22~23 cm)。
选取健壮的水仙鳞茎球,剥去鳞茎球外层干枯鳞片,上盆后置于温室内培养(光照时间12 h,温度16 ℃),待水仙长至约株高20 cm时挑选生长一致的植株,转移至不同温度(15、30、35 ℃)的光照培养箱中培养24 h;分别采集不同温度下培养的水仙叶片,在液氮中速冻,置于?80 ℃冰箱保存备用。以15 ℃处理做对照,30、35 ℃ 2个高温胁迫处理,每个处理温度设置3个生物学重复。
1.2方法
1.2.1 水仙叶片RNA提取 采用离心柱型多糖多酚RNA提取试剂盒(Bio Teke Corporation)提取水仙叶片的总RNA后,超微量紫外分光光度计检测RNA的浓度和纯度,结合琼脂糖凝胶双向电泳检测总RNA的质量,所提取的总RNA置于超低温冰箱(?80 ℃)保存备用。
1.2.2 水仙叶片转录组测序的cDNA文库构建 总RNA经过Agilent 2100 Bioanalyzer质量检测后,委托深圳华大基因公司进行转录组测序分析。
1.3转录组测序数据分析
1.3.1 测序质量分析 在原始数据Raw reads中去除掉包含接头adaptor reads、低质量reads及N>5%的reads基础上,获得clean reads用于后续的数据分析,并储存于格式为fastq的数据文件中。
1.3.2 数据组装 由于水仙花目前还没有相应的参考基因组序列,故采用de novo组装的方式,通过Trinity软件对去除PCR重复的clean reads进行组装,然后使用Tgicl软件进行聚类去冗余得到Unigene,对每个样品的Unigene再次使用Tgicl进行聚类去冗余得到最终的Unigene用于后续分析,详细步骤参见宋志丹[11]对沙冬青的研究。
1.3.3 转录组数据信息注释 对最终获得的Unigene序列进行基因功能注释和表达量信息注释。将Unigene序列与Blast数据库比对,获得Unigene的注释信息,通过与Blastn[12]数据库比对获得Unigene的Nt注释,得到相关的核酸信息,通过与Blastx[12]或Diamond[13]比对获得Unigene的Nr、KOG、KEGG以及SwissProt信息,得到最高序列相似性的蛋白,从而得到该Unigene的蛋白功能注释信息;通过与Blast2GO[14]以及Nr注释结果进行GO注释,使用InterProScan5[15]进行InterPro比对。通过与各数据库的比对,获得相关性最高的Unigenes注释信息。
1.3.4 基因表达量及差异表达基因分析 我们使用Bowite2将clean reads比对到Unigene,然后使用RSEM(进行表达量水平估计)计算各样品的基因表达量,利用FPKM值表示对应的Unigene表达丰度,计算公式:
式中,cDNA Fragments:比对到某一转录本的片段数目;Mapped fragments (Millions):表示比对到转录本上的片段总数;Transcript length (kb):转录本长度(kb)。
根据差异基因的表达量(FPKM)利用DEGseq方法计算每个Unigene代表的基因在不同样本间的差异表达倍数。以|log2Fold change|≥1,且q-value≤0.001为阀值,筛选出水仙在不同温度24 h胁迫下的样品两两比较(T15_vs_T30、T15_vs_T35、T30_vs_T35)的全部差异基因。对差异表达基因的pathway进行富集分析,筛选出富集到并且与本研究相关的信号通路。并通过GO功能分析确定差异表达基因行使的主要生物学功能。
2 结果与分析
2.1转录组组装结果与质量评估
各样品的过滤结果见表1,数据过滤后的reads占总reads数的比例在97.25%~98.04%之间,各样品的Q20均在97%。以上结果说明测序结果良好,可用于后续分析。PCA分析显示每个处理间的重复性较好(图2)。
将各样品过滤后的reads进行de novo组装及聚类去冗余,共得到112 160个叶片Unigene,总长度、平均长度、N50以及GC含量分别为128 733 815 bp、1147 bp、1770 bp和42.33%。长度分布见图3,分布在300~500 nt和600~1000 nt,数量分别达到了38 428条(34.26%)和24 424条(21.78%),长度≥3000 nt的序列仅有6255条占8.40%。水仙叶片的Unigene以小片段为主,本次测序的Uningene组装结果可信度较高,准确性较好,可供后续研究。
2.2Unigene的功能注释
将All_Unigene序列(112 160条)直接比对到Nt、Nr、KOG、Swissprot、KEGG、Interpro和GO七大数据库中进行注释(E-value<1.0e-5),结果如表2所示。被七大数据库任意一个比对注释上的Unigene序列有75 873条,占比67.65%;被所有数据库比对后皆能被注释上的Unigene序列有8889条,其比例仅有7.93%。
比对到Nr和SwissProt数据库的序列分別为72 647条(占Unigene总数的64.77%)、53 132条(占Unigene总数的47.37%)。
2.2.1 Unigene的Nr分析 从Nr注释基因匹配的物种分布情况来看,与石刁柏(Asparagus officinalis)物种类似的Unigene序列占比最大,高达60.58%,其次为油棕(Elaeis guineensis)、海枣(Phoenix dactylifera)、香蕉(Musa acuminatasubsp.malaccensis)、菠萝(Ananas comosus)等物种见图4。
2.2.2 Unigene的KOG分析 利用KOG数据库对组装得到的112 160条Unigene序列进行KOG直系同源分类(图5)。共有56 660条(50.52%)Unigene序列被成功注释并进行功能分类统计后分配到25个KOG类别。在25个KOG类别中,仅“一般功能预测(General function prediction only)”的群集代表最大的群体,有14 489条,其次是“信号转导机制(Signal transduction mechanisms,6789条)”、“翻译后修饰、蛋白质周转、分子伴侣(Posttranslational modification, protein turnover, chaperones, 6436条)”和“转录(Transcription, 5135条)”,涉及“碳水化合物的运输和新陈代谢(Carbohydrate transport and metabolism, 3314条)”、“RNA加工和修饰(RNA processing and modification, 3269条)”及“细胞内运输,分泌和囊泡运输(Intracellular trafficking, secretion, and vesicular transport)”的功能基因也比较丰富,只有一小部分Unigenes被指定为“核结构(Nuclear structure, 357条)”、“细胞外结构(Extracellular structures, 212条)”或“细胞运动(Cell motility, 55条)”。此外有5359条Unigene序列的属于功能未知(Function unknown)集群。以上结果说明:水仙的热应激反应引起了“信号转导机制”等众多基因的表达,推测这些基因在水仙热应激反应中可能起着重要的调节作用;此外,水仙响应高温胁迫的转录组中包括信号转导、胁迫响应等相关的众多基因,表明水仙对热胁迫的应激反应是一个非常复杂的过程,有大量的调节因子参与其中。
2.3基因表达水平分析
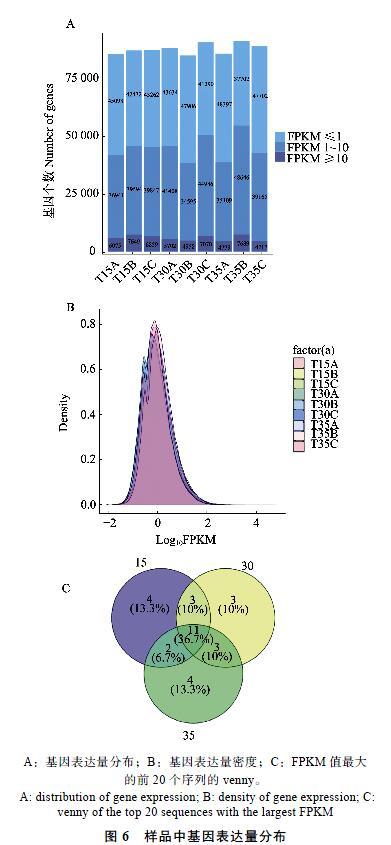
参照Audic和Claverie(1997)的FPKM方法计算测序后组装得到Unigene的表达水平,统计结果见图6。在各样品中,转录本的表达丰度集中在FPKM值≤1、1
以|log2Fold change|≥1,且q-value≤0.001为阀值,筛选DEG,对3个比较组中|log2Fold change|值最大的前20条序列进行分析发现,与对照组(15 ℃温度处理)相比,2个高温处理组中差异表达倍数较大的前20条序列中,都含有HSP基因,且都表现为上调表达,尤其是在T15_vs_T35组合中,上调表达的HSP基因高达9条,占45%,且全是sHSPs(Small heat shock protein),主要涉及HSP18.1及HSP17.4两类。且有2个sHSPs基因在正常温度条件下表达量很低或者不表达,而在受到24 h的高温胁迫后最高表达,说明水仙花的HSP18.1、HSP17.4基因不仅在响应高温胁迫中高度表达,也存在于正常生长的细胞中。Changle等[16]在对拟南芥中2个过氧化物酶体sHSPs表达的研究中认为拟南芥AtHSP15.7基因在正常条件下几乎检测不到,但在热胁迫30 min后迅速表达,并证明了AtHsp15.7特异性地由植物过氧化物酶体基质蛋白中的热应激诱导。因此,在水仙热胁迫中HSP家族发挥重要的作用,尤其是sHSPs,目前关于HSP18.1、HSP17.4基因在水仙植物中是如何参与热应激的未见报道。
A: RNA processing and modification; B: Chromatin structure and dynamics; C Energy production and conversion; DCell cycle control, cell division, chromosome partitioning; E: Amino acid transport and metabolism; F: Nucleotide transport and metabolism; G: Carbohydrate transport and metabolism; H: Coenzyme transport and metabolism; I: Lipid transport and metabolism; J: Translation, ribosomal structure and biogenesis; K: Transcription; L: Replication, recombination and repair; M: Cell wall/membrane/envelope biogenesis; N: Cell motility; O: Posttranslational modification, protein turnover, chaperones; P: Inorganic ion transport and metabolism; Q: Secondary metabolites biosynthesis, transport and catabolism; R: General function prediction only; S: Function unknown; T: Signal transduction mechanisms; U: Intracellular trafficking, secretion, and vesicular transport; V: Defense mechanisms; W: Extracellular structures; Y: Nuclear structure; Z: Cytoskeleton.
A:基因表達量分布;B:基因表达量密度;C:FPKM值最大的前20个序列的venny。
A: distribution of gene expression; B: density of gene expression; C: venny of the top 20 sequences with the largest FPKM
2.4水仙响应高温胁迫差异表达基因的GO和KEGG分析
2.4.1 显著差异表达基因的GO功能富集 图7显示了差异表达基因在GO数据库中显著富集的GO term(P-value<0.001)。在细胞组分方面,T15_vs_T30和T15_vs_T35两个组合之间,GO富集程度较显著的GO term均有15条,且二者显著富集的GO term种类term种类也相同,都包含了光合膜、光系统、类囊体膜、类囊体、叶绿体、质体等与光合作用密切相关的GO term;而在T30_vs_T35组合中,除光系统Ⅱ及光系统得到最显著富集外,还有细胞外区域、光系统Ⅱ氧气进化复合物、膜的外部组分、膜、氧化还原酶复合物也得到了显著富集。在生物过程方面,3个比较组中显著富集程度最高的均是光合作用,此外在T15_vs_T30组合中细胞碳水化合物代谢过程、碳水化合物代谢过程、多糖代谢过程也得到了显著富集;在T15_vs_T35组合中叶绿素生物合成、含卟啉的化合物生物合成过程和小分子分解代谢过程被显著富集;在T30_vs_T35组合中细胞壁组织或生物发生和细胞壁组织被显著富集。说明高温胁迫影响水仙的光合作用、碳代谢及能量代谢,且35 ℃高温胁迫时植物的细胞已经被破坏。在分子功能方面,3个组合中差异基因数量都是最多的,且T15_vs_T30及T15_vs_T35两个组合都在叶绿素结合、四吡咯结合、辅因子结合得到显著富集,而T30_vs_T35与前2个组合的差异表达基因的显著富集差异较大,除四吡咯结合外还包括作用于成对供体的氧化还原酶活性与一对供体的氧化导致一分子氧还原两分子水、O-甲基转移酶活性、酶抑制剂活性等。上述结果说明,在高温胁迫下,水仙植物的光合作用及呼吸作用被抑制,35 ℃高温处理下植物体内的活性氧增加,并且这些差异表达的基因在响应热胁迫时存在表达差异。
2.4.2 差异表达基因的KEGG富集分析 水仙叶片高温处理下的差异表达基因可富集到135条pathway中,其中T15_vs_T30组合有8015个基因、T15_vs_T35组合有14 618个基因、T30_vs_T35组合有5105个基因。定义q-value≤ 0.05的pathway作为差异表达基因显著性富集的pathway,T15_vs_T30、T15_vs_T35、T30_vs_T35三个组合中分别有23、39及32条Pathway被显著性富集。
对差异表达基因前20条KEGG富集途径,按富集因子进行散点图绘制(图8)。在T15_vs_T30组合中,蛋白质在内质网中的加工处理途径是富集程度最高的,其次是精氨酸代谢途径,在T15_vs_T35组合中富集程度最高的是苯丙烷类的生物合成;花生四烯酸代谢、鞘糖生物合成-神经节系列在T30_vs_T35组合中也得到了较高富集。此外,仅硫胺素代谢途径在T15_vs_T30及T15_vs_T35组合中均富集到前20;化合物的生物合成、氨基酸的生物合成、光合生物中的碳固定仅在T15_vs_T35组合中富集到了前20;同时,次生代谢物的生物合成、苯丙烷类生物合成、糖胺聚糖降解、代谢途径、光合作用、单萜类生物合成、光合作用-天线蛋白质、乙醛酸和二羧酸代谢等途径在3个比较组中均被富集到了前20。这些结果说明:次生代谢物的生物合成、苯丙烷类生物合成、糖胺聚糖降解、代谢途径、光合作用、单萜类生物合成、光合作用-天线蛋白质、乙醛酸和二羧酸代谢等途径在水仙响应高温胁迫过程中起关键作用,能量转换及苯丙烷类、萜类化合物很可能参与缓解高温胁迫;表明硫胺素代谢对响应30、35 ℃高温可能起着重要作用;35 ℃的高温对水仙的光合作用,碳代谢、萜类化合物及氨基酸的生物合成影响显著。
纵坐标为GO条目,横坐标为GO条目的基因富集数,只显示了GO三大本体中P<0.001的GO条目。
Y-axis is the GO term, X-axis is the number of GO term gene enrichment, which shows part ofontology GO that the GO term ofP<0.001.
3 討论
温度是植物正常生长发育不可或缺的外界条件之一,当外界条件高于植物生长适宜温度时,便会影响植物的正常生命活动,像光合作用、呼吸作用、激素以及其他次级代谢物的产生等,使植物生长缓慢,严重时会造成植物死亡。本研究以不同程度高温胁迫的水仙叶片建库,进行转录组测序,共获得112 160条总长度为128 733 815 bp的Unigene序列。在112 160个Unigene序列中,有75 873个(约67.65%)Unigene序列成功注释,这为改善水仙花植物的耐热性及耐热品种的培育提供了丰富的数据资源。对差异表达基因进行分析显示,在高温胁迫下显著差异表达的基因共有25 852条,其中包括|log2Fold change|≥2,且q-value≤0.001的极显著差异基因10 568条,说明有很多基因参与了水仙的高温胁迫应答反应。且相对表达量最高的前20条基因均注释为HSP基因,这说明在水仙的热胁迫过程中HSP基因发挥着重要的作用。HSPs的产生可保护机体蛋白质免遭损伤,或通过修复已受损伤的蛋白质,以维持许多细胞蛋白在非正常环境条件下行使正常的功能[17]。
对Unigene序列进行功能注释分析发现,在热胁迫条件下,与结合、催化活性等相关的基因较为活跃,差异表达基因的GO功能富集分析显示,30、35 ℃的高温胁迫使水仙细胞的细胞膜系统遭到破坏,与15 ℃对照相比,30、35 ℃高温处理下与光合膜、类囊体膜相关的GO term都得到了显著富集,此外与光系统、类囊体、叶绿体、质体相关的GO term也得到了富集,说明叶绿体的结构可能发生了改变,致使依赖于叶绿体的生命活动受阻,如光合作用[18-19]。有研究显示高温胁迫对植物细胞最大伤害的是叶绿体类囊体膜上的碳代谢基质和光化学反应系统[20-21],而光合作用及呼吸作用的变化会引起氧化胁迫及有害活性氧(ROS)物质积累[22-24]。本研究中,与光合作用途径中的光反应及碳水化合物的代谢过程被显著富集。此外,多糖代谢、氧化还原复合物、辅因子结合等也得到了显著富集,同时,谷胱甘肽代谢途径在T15_vs_T35组合中被显著富集。推测水仙花在受到高温胁迫时,光合作用被抑制,谷胱甘肽作为非酶促反应活性氧清除机制在水仙的热胁迫中发挥着重要的调节作用。此外花生四烯酸代谢、鞘糖生物合成-神经节系列、苯丙烷类的生物合成、糖胺聚糖降解途径也可能参与了水仙的热胁迫反应。
硫胺素代谢途径在15 ℃(T15_vs_T30、T15_vs_T35)相关的组合中富集程度都比较高,在高温下与硫胺素代谢途径相关的酶基因都显著表达。这表明硫胺素代谢途径在水仙花响应30、35 ℃高温胁迫的过程中起着重要的作用。硫胺素(维生素B1)是大多数生物体中必不可少的辅助因子,可作为转酮醇酶(TK)、丙酮酸脱氢酶(丙酮酸脱氢酶)和α-酮戊二酸脱氢酶复合物(α-酮戊二酸脱氢酶)[25]等多种酶类的辅酶,这些酶类在糖酵解、戊糖磷酸循环及三羧酸循环等碳水化合物转化过程中发挥着关键作用[26-27]。前人研究表明,硫胺素可以作为一种抗氧化剂,应对氧化胁迫刺激,细胞内硫胺素或者是TPP含量可以增加植物的耐氧化性能,而硫胺素的缺乏会引起氧化胁迫[28-29]。周俊等[30]认为硫胺素可以提高线粒体的氧化状态,且这一功能具有浓度依赖性。杜驰等[31]认为盐穗禾的HcThi1基因表达受盐胁迫的诱导HcThi1能够参与盐穗木盐胁迫应答响应。THI1可同时靶向线粒体和叶绿体[32]。这些研究结果都说明硫胺素代谢在植物抗性方面发挥着作用。本研究中只有硫胺素代谢途径在T15_vs_T30、T15_vs_T35这2个组合中都得到了显著富集,且戊糖和葡糖醛转化、乙醛酸和二羧酸代谢等多种与碳代谢相关的途径在3个组合中都得到了显著富集。说明硫胺素代谢途径可能在水仙花的热胁迫过程中发挥重要作用。
參考文献
[1] 庄晓英, 邹清成, 卢 钢, 等. 冷处理对中国水仙鳞茎及其不定芽分化过程中生理生化代谢的影响[J]. 核农学报,2007(1): 25-29.
[2] Hanks G R. Variation in the growth and development ofnarcissus in relation to meteorological and related factors[J].Journal of Horticultural Science, 1996, 71(4): 517-532.
[3] 林小苹, 张凌霞. 不同贮藏温度对水仙花球生长发育的影响[J]. 福建热作科技, 2008(2): 5-7.
[4] 林 莉, 黄卫国, 黄清玉. 气象因素对水仙花生长的影响及其在生产上的应用[J]. 福建热作科技, 2016, 41(1): 34-36.
[5] Djanaguiraman M, Prasad P V V, Boyle D L, et al.High-temperature stress and soybean leaves: leaf anatomyand photosynthesis[J]. Crop Science, 2011, 51(5): 2125.
[6] Li X F, Shao X H, Deng X J, et al. Necessity of high temperaturefor the dormancy release of Narcissus tazetta var.chinensis[J]. Journal of Plant Physiology, 2012, 169(14):1340-1347.
[7] Wurr D, Hanks G R, Fellows J R. The effects of bulb storagetemperature, planting date and soil temperature on thegrowth and development of Narcissus bulb units[J]. TheJournal of Horticultural Science and Biotechnology, 2001,76(4): 465-473 .
[8] 李小方, 王 洋, 邓新杰, 等. 温度、GA3 和乙烯对中国水仙休眠的解除[J]. 植物生理学通讯, 2009, 45(10): 953-957.
[9] 丁安琪. 温度对中国水仙休眠进程相关生理和基因表达的影响[D]. 福州: 福建农林大学, 2016.
[10] 许 静. 中国水仙休眠调控相关基因NFT1 和NEIN3 的功能研究[D]. 上海: 华东师范大学, 2013.
[11] 宋志丹. 沙冬青转录组、小RNA 组及低温应答基因表达谱研究[D]. 长沙: 中南林业科技大学, 2012.
[12] Altschul S F, Gish W, Miller W, et al. Basic local alignmentsearch tool[J]. Journal of Molecular Biology, 1990, 215(3):403-410.
[13] Buchfink B, Xie C, Huson D H. Fast and sensitive proteinalignment using DIAMOND[J]. Nature Methods, 2015,12(1): 59.
[14] Conesa A, Terol J, Robles M. Blast2GO: a universal tool forannotation, visualization and analysis in functional genomicsresearch[J]. Bioinformatics, 2005, 21(18): 3674-3676.
[15] Quevillon E, Silventoinen V, Pillai S, et al. InterProScan:protein domains identifier[J]. Nucleic Acids Research, 2005,33: 116-120.
[16] Changle M, Martin H, Lavanya B, et al. Identification andcharacterization of a stress-inducible and a constitutive smallheat-shock protein targeted to the matrix of plant peroxisomes[J]. Plant Physiology, 2006, 141(1): 47-60.
[17] Sangster T A, Queitsch C. The HSP90 chaperone complex,an emerging force in plant development and phenotypicplasticity[J]. Current Opinion in Plant Biology, 2005, 8(1):86-92.
[18] Sharkey T D, Zhang R. High temperature effects on electronand proton circuits of photosynthesis[J]. Journal of IntegrativePlant Biology, 2010, 52(8): 712-722.
[19] Todorov D T, Karanov E N, Smith A R, et al. Chlorophyllaseactivity and chlorophyll content in wild and mutantplants of Arabidopsis thaliana[J]. Biologia Plantarum (Prague),2003, 46(1): 125-127.
[20] Wang J Z, Cui L J, Wang Y, et al. Growth, lipid peroxidationand photosynthesis in two tall fescue cultivars differingin heat tolerance[J]. Biologia Plantarum, 2009, 53(2):237-242.
[21] Marchand F L, Mertens S, Kockelbergh F, et al. Performanceof high Arctic tundra plants improved during but deterioratedafter exposure to a simulated extreme temperatureevent[J]. Global Change Biology, 2005, 11(12): 2078-2089.
[22] Apel K, Hirt H. REACTIVE OXYGEN SPECIES: Metabolism,oxidative stress, and signal transduction[J]. Annual Reviewof Plant Biology, 2004, 55: 373-399.
[23] Camejo D, Jiménez A, Alarcón J J, et al. Changes in photosynthetic parameters and antioxidant activities followingheat-shock treatment in tomato plants[J]. Functional PlantBiology, 2006, 33(2): 177-187.
[24] Tian R G, Guo P Z, Yan H Z. Physiological changes in barleyplants under combined toxicity of aluminum, copper andcadmium[J]. Colloids and Surfaces B: Biointerfaces, 2007,57(2): 182-188.
[25] Beltramo E, Berrone E, Tarallo S, et al. Effects of thiamineand benfotiamine on intracellular glucose metabolism andrelevance in the prevention of diabetic complications[J].Acta Diabetologica, 2008, 45(3): 131-141.
[26] 杨卓刚, 刘晓晴. 高等生物丙酮酸脱氢酶复合体活性调节机制[J]. 生命的化学, 2008(3): 304-306.
[27] Chatterjee A, Schroeder F C, Jurgenson C T, et al. Biosynthesisof the thiamin-thiazole in eukaryotes: identification ofa thiazole tautomer intermediate[J]. Journal of the AmericanChemical Society, 2008, 130(34): 11394-11398.
[28] Ribeiro D T, Farias L P, de Almeida J D, et al. Functionalcharacterization of the thi1 promoter region from Arabidopsisthaliana[J]. Journal of Experimental Botany 2005,56(417): 1797-1804.
[29] Tunc-Ozdemir M, Miller G, Song L, et al. Thiamin confersenhanced tolerance to oxidative stress in Arabidopsis[J].Plant Physiology, 2009, 151(1): 421-432.
[30] 周 俊, 孫爱珍, 曾礼漳, 等. 硫胺素通过提高线粒体氧化状态促进植物快速响应外界胁迫的研究[J]. 激光生物学报, 2012, 21(4): 340-345.
[31] 杜 驰, 张 冀, 张富春. 盐胁迫下盐穗木HcThi1 基因的表达分析[J]. 基因组学与应用生物学, 2016, 35(1):206-212.
[32] Chabregas S M, Luche D D, Farias L P, et al. Dual targetingproperties of the N-terminal signal sequence of Arabidopsisthaliana THI1 protein to mitochondria and chloroplasts[J].Plant Molecular Biology, 2001, 46(6): 639-650.
