香蕉苯丙氨酸解氨酶基因家族的全基因组鉴定及表达分析
2019-12-14杨会晓孙媛媛贾彩红金志强徐碧玉王卓
杨会晓 孙媛媛 贾彩红 金志强 徐碧玉 王卓

摘 要 苯丙氨酸解氨酶(Phenylalanine ammonia-lyase, PAL)是催化苯丙烷代谢途径第1步反应的限速酶,广泛地参与植物生长发育过程中的各种生理活动。本研究通过生物信息学分析,从香蕉A基因组数据库中利用BLASTp筛选出53个可能的MaPAL编码蛋白序列。在NCBI分析蛋白保守结构域,发现仅有8个基因具有典型的PAL家族基因的特性。聚类分析结果表明香蕉MaPAL家族的8个基因可以分为Class I 和Class II两类。转录组数据表明,所有MaPAL基因在果实发育阶段高表达,MaPAL5参与果实采后成熟过程。在干旱、低温、盐处理的香蕉幼苗叶片中,MaPAL1、MaPAL2、MaPAL3、MaPAL4和MaPAL5成员均显著上调表达,MaPAL6号成员显著下调表达,这些成员参与香蕉响应上述非生物胁迫过程。8个MaPAL成员在枯萎病菌处理下均显著下调表达,表明在感病品种巴西蕉根系中,MaPAL基因的表達全部被Foc TR4抑制。本研究结果为分析MaPAL基因家族在香蕉果实品质形成和响应逆境中的作用提供了理论依据。
关键词 香蕉;苯丙氨酸解氨酶;系统进化分析;表达分析;基因家族中图分类号 S668.1 文献标识码 A
Identification and Expression Analysis of Phenylalanine Ammonia-lyase Gene Family in Banana
YANG Huixiao1,2, SUN Yuanyuan1,2, JIA Caihong1, JIN Zhiqiang1,2, XU Biyu1, WANG Zhuo1*
1. Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Tropical Biotechnology, Ministry of Agriculture and Rural Affairs, Haikou, Hainan 571101, China; 2. College of Horticulture, Nanjing Agricultural University, Nanjing, Jiangsu 210095, China
Abstract Phenylalanine ammonia-lyase gene (PAL) is one of the key enzymes associated with plant growth and stress resistance in the secondary metabolism pathway. In this study, we used four L-phenylalanine ammonia-lyase genes inArabidopsis thalianaas qurry and acquired 53 candidate PAL gene sequences by BLASTp in banana A genome database. And then we used conserved domain search of NCBI, only 8 gene members were found containing typical PAL domain in the protein sequence. In the phylogenetic tree, eight PALs could be classified into 2 groups, Class I and Class II. The transcriptome data showed that allMaPALgenes were highly expressed at fruit development stages. AndMaPAL5was differential expression in banana fruit postharvest stages. Under the drought, low temperature and salt stresses,MaPAL1, MaPAL2,MaPAL3,MaPAL4andMaPAL5members were up-regulated andMaPAL6was down-regulated. All 8MaPALswere down-regulated under the Foc TR4 infection. The results suggested that allMaPAL genes played important roles in banana fruit development and ripenning, responding to abiotic and biotic stresses. This study would provide a theoretical basis for further exploration the function of MaPALs in banana fruit ripening and under stresses.
Keywords banana; phenylalanine ammonia-lyase; phylogenetic analysis; expression analysis; gene family
DOI10.3969/j.issn.1000-2561.2019.10.007
香蕉是多年生草本植物,是重要的热地亚热带经济作物。其果实富含淀粉和黄酮类物质,是人们重要的粮食和营养来源[1]。在香蕉生长过程中,幼苗会经常受到各种非生物和生物胁迫的影响,如干旱、低温、盐[2-3]和枯萎病[4],严重地影响香蕉果实的产量和品质。尤其是香蕉枯萎病,由于抗病育种无法满足香蕉产业的需求,且没有有效的化学防治手段,造成香蕉栽培面积不断地减少[5]。在香蕉中,次级代谢物质与果实的品质形成、抗非生物胁迫和抗枯萎病的关系密切[6-7]。苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL, EC 4.3.1.5)催化保守的L-苯丙氨酸转化为反式肉桂酸,它是苯丙烷类代谢的第一个关键酶和限速酶[8]。PAL蛋白广泛存在于植物、真菌、酵母和藻类中。在植物基因组中,PAL编码1个小的多基因家族,分子量一般在220~330 ku,是一种酸性蛋白[9]。在植物中,多种次级代谢产物如花青素、木质素、激素、类黄酮和植物抗毒素等的合成都是源于苯丙烷类合成途径,PAL是该途径的第一个关键酶[10]。PAL基因的表达受各种环境胁迫的影响,如病原菌侵染、紫外线、伤害和光照等的诱导[11-12]。此外,PAL在植物防御系统中起着重要作用,参与信号分子水杨酸的生物合成,水杨酸是植物系统获得抗性所必需的有机酸[13-14]。截至目前,PAL基因在多种植物中被发现,例如葡萄(Vitis vinifera L.)[15]、大豆(Glycine max (Linn.) Merr.)[16]、陆地棉(Gossypium hirsutum Linn.)[17]、甜瓜(Cucumis meloL.)[18]、玉米(Zea maysL.)[19]、苹果((Malus domestica)[20]、沙棘(Hippophae rhamnoidesLinn.)[21]和核桃(Juglans regia L.)[22]等。在香蕉中,前期研究发现PAL参与香蕉果实抗冷[23],抗Mycosphaerella fijiensis侵染[24];在香蕉感染枯萎病菌后,PAL酶活性升高,且與香蕉的抗病性呈正相关[25]。截至目前,在香蕉中还未见PAL基因家族的全基因组分析的报道。
香蕉A基因组测序于2012年完成并公布测序结果[26],为在全基因组水平上对PAL基因家族进行分析鉴定、进化分析以及相关基因功能研究提供了数据支持。本研究通过生物信息学方法研究香蕉全基因组中的PAL基因家族的分类、系统进化关系、基因结构、基因表达等,以期明确PAL基因家族在香蕉果实发育和采后成熟,响应非生物和生物胁迫中可能发挥的作用,为深入研究香蕉苯丙氨酸解氨酶的功能奠定理论基础。
1 材料与方法
1.1材料
以文献报道的拟南芥4个PAL的数据[27],在拟南芥数据库(http://www.arabidopsis.org/)中下载AtPAL的蛋白序列。以搜索到的拟南芥的AtPAL蛋白序列为查询序列(Query),在香蕉A基因组数据库(http://banana-genome.cirad.fr/)中,通过Blastp 搜索出香蕉的可能的PAL蛋白序列和相关基因注释文件。
1.2方法
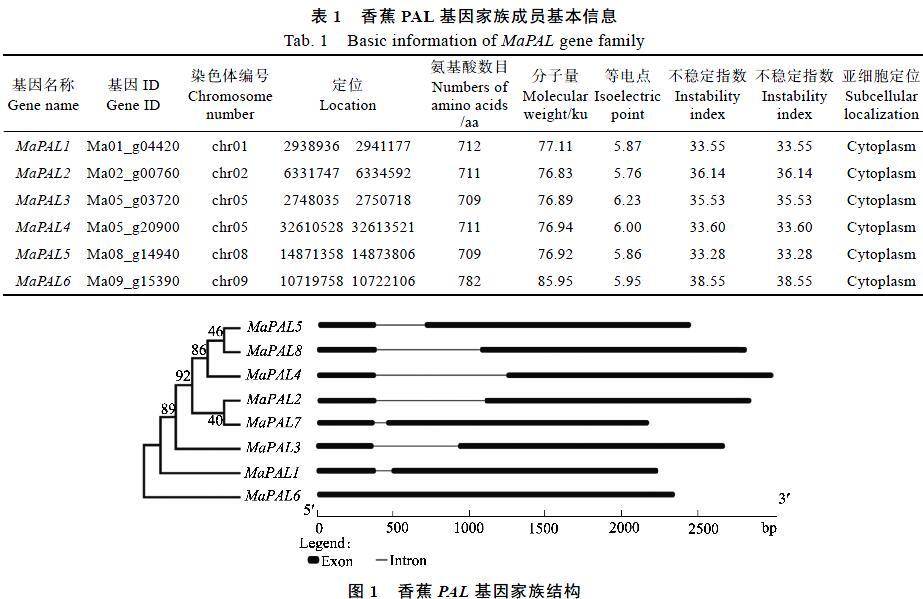
1.2.1 香蕉PAL基因的氨基酸序列属性分析 利用ExPASy Proteomics Server(http://www. expasy.org/)的ProtParam tool软件在线分析蛋白的基本理化性质,包括蛋白的等电点、不稳定系数、分子量、脂肪指数和疏水性等。采用Plant-mPLoc Server (http://www.csbio.sjtu.edu.cn/bioinf/ plant- multi/#)在线预测分析MaPAL蛋白亚细胞定位情况。利用Gene Structure Display Server(GSDS)[28]软件分析内含子和外显子组成。
利用DNAMAN软件对MaPAL蛋白进行多重序列比对,依据比对结果鉴定MaPAL基因的旁系同源对[29]。旁系同源对基因必须满足以下2个条件:(1)2个基因序列比对,短基因序列与长基因序列的覆盖率大于70%;(2)2个基因蛋白序列的一致性大于70%[30]。
80DAF-0DPH(断蕾80 d-采后成熟0 d),8DPH(采后成熟8 d)、14DPH(采后成熟14 d)进行了转录组分析(图4)。MaPAL1、MaPAL2、MaPAL3、MaPAL6、MaPAL7和MaPAL8在果实发育阶段(0DAF、20DAF)表达量较高;但这些成员在果实采后成熟阶段几乎不表达。MaPAL4基因在果实发育和采后成熟2个阶段一直是高水平表达(RPKM>10),而且该成员在采后的表达达到显著差异表达(Log2RPKM>1),表明该成员可能在香蕉果实发育和采后成熟中起着重要作用。MaPAL5在果实发育和采后成熟过程都不表达,表明该成员可能不参与香蕉果实发育和采后成熟过程。
2.4MaPAL在香蕉响应胁迫处理的表达分析
如图5所示,在低温处理条件下,MaPAL1、MaPAL3、MaPAL4、MaPAL5、MaPAL7和MaPAL8显著上调表达;MaPAL2和MaPAL6显著下调表达。在干旱条件下,MaPAL3、MaPAL4、MaPAL1、MaPAL5和MaPAL7显著上调表达,MaPAL2、MaPAL6和MaPAL8显著下调。在盐胁迫下,MaPAL2、MaPAL3、MaPAL4、MaPAL1、MaPAL5、MaPAL7和MaPAL8显著上调表达,MaPAL6显著下调表达。在3种非生物胁迫条件下,我们发现MaPAL3、MaPAL4、MaPAL5、MaPAL1、MaPAL7和MaPAL6均显著上调和下调,参与香蕉响应上述3种非生物胁迫。在枯萎病处理中,所有8个MaPAL基因全部下调表达,其中MaPAL5下调最明显。表明巴西蕉在遭受Foc TR4侵染后,全面抑制了MaPAL基因的表达。上述结果也表明PAL基因家族成员参与香蕉响应逆境的过程。
3 讨论
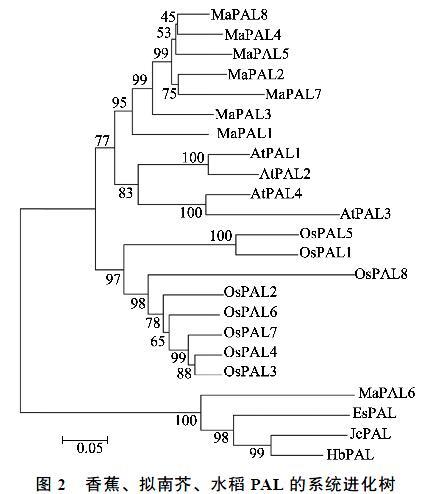
PAL是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢途径第一步反应的酶,是苯丙烷类代谢的关键酶和限速酶,苯丙烷类代谢途径的产物在植物生长发育和响应逆境过程中发挥着重要作用[33]。本研究对香蕉基因组中的PAL基因进行鉴定,并且进一步探讨了MaPAL蛋白的理化性质、基因结构、系统进化关系及其在果实发育、采后成熟、响应非生物和生物胁迫中的表达模式。本文在香蕉A基因组中共鉴定出8个MaPAL基因,与水稻(9个)[34]、杨树(5个)[35]和拟南芥(4个)[36]基因组中的PAL数量相差不大,表明PAL在植物中确实以小基因家族的形式存在[37-38]。在氨基酸长度、分子量及等电点方面8个MaPAL都与其他植物的PAL蛋白类似[39-41]。理化性质分析结果显示,8个MaPAL都是酸性蛋白质,与之前报道的PAL是一种酸性蛋白的结果一致[42]。序列比对发现,MaPAL结构高度保守,都含有1个由Ala-Ser-Gly组成的高度保守的亚甲基咪唑酮(MIO)亲电基团[43],这是PAL基因家族的特征序列。本研究预测所有的PAL均位于细胞质类,与前人的报道一致[37, 44],说明香蕉PAL基因在细胞质内发挥作用。在进化方面,MaPAL基因能分为两类,其中MaPAL1、MaPAL2、MaPAL3、MaPAL4、MaPAL5、MaPAL7和MaPAL8分為一个亚支,这些成员间具有较高的同源性;而MaPAL6单独与其他木本植物的PAL分为一亚支。这与其他物种结果类似[45]。上述特征表明MaPAL1~8确实属于香蕉PAL基因家族的成员。
果實的发育和成熟过程是香蕉品质形成的重要过程。次级代谢物质在该过程大量生成和转化[6]。PAL作为苯丙烷代谢和类黄酮生物合成途径的关键酶,在植物的发育过程中起着关键作用,覆盆子[46]和苹果[20]的PAL均参与果实的发育过程。本研究发现在果实发育过程中大部分的MaPAL基因都表达量较高,说明次级代谢物质的合成在这些香蕉果实发育时间点是很活跃的。而在果实采后成熟过程中MaPAL4成员高表达且显著差异表达,说明这个成员可能在采后成熟过程中起着重要作用。
植物在遭受干旱、低温和盐等非生物学胁迫时,会迅速积累ROS,造成氧化损伤[47]。类黄酮等物质在苯丙烷代谢途径中合成,具有较强的抗氧化活性,能清除ROS,保护植物。在植物遭受逆境因素(如高温、盐害、紫外线等)均能促使PAL基因表达量变化;番茄[48]、黄瓜[49]和半夏[50]的PAL基因在非生物胁迫中显著上调表达[51]。本研究发现,大部分的MaPAL基因都参与香蕉响应低温、干旱和盐的胁迫;其中有5个成员以相同的方式响应上述3种非生物胁迫处理,表明MaPAL参与香蕉响应非生物胁迫过程,且在功能上可能具有一定的冗余,这与拟南芥4个PAL结果类似[27]。
PAL基因参与植物响应病原菌过程[8,24, 52-53],PAL酶活往往作为植物抗病的标志酶[25]。在拟南芥中,pal1/pal2/pal3/pal4的4敲除突变体表现发育不良和不育的表型,同时易感丁香假单胞菌(Pseudomonas syringae)[27]。巴西蕉作为香蕉的主要栽培品种,易感枯萎病[4-5]。本研究中,接种枯萎病的巴西蕉根系中MaPAL基因的表达显著被抑制(图5),说明MaPAL基因参与香蕉响应枯萎病菌侵染的过程。酚酸类物质参与香蕉抗枯萎病的过程[7],在感病品种中抑制MaPAL基因的表达可以减少次级代谢物质的合成,影响抗病物质的合成。上述结果说明MaPAL基因可能在香蕉抗枯萎病中起着重要作用。
4 结论
基于香蕉A基因组的序列信息,获得8个MaPAL家族成员信息, 并完成系统进化分析。MaPAL家族基因在果实发育时期表达量较大, 而在果实成熟中只有MaPAL4差异表达;在响应非生物胁迫时,大部分MaPAL成员都参与香蕉响应低温、干旱和盐胁迫的过程;8个MaPAL基因在感病香蕉品种接种Foc TR4后表达均被抑制。说明MaPAL基因在香蕉响应逆境中起着重要作用。本研究结果为今后在香蕉中开展MaPAL调控次级代谢物质合成的遗传调控研究奠定了基础。
参考文献
[1] Aurore G, Parfait B, Fahrasmane L. Bananas, raw materialsfor making processed food products[J]. Trends in Food Science& Technology, 2009, 20(2): 78-91.
[2] Mahajan S, Tuteja N. Cold, salinity and drought stresses: anoverview[J]. Archives of Biochemistry and Biophysics, 2005,444(2): 139-158.
[3] Munns R. Genes and salt tolerance: bringing them together[J]. New Phytologist, 2005, 167(3): 645-663.
[4] Ploetz R C, Pegg K G. Fungal diseases of the root, corm andpseudostem[M]//Diseases of Banana, Abaca and Enset. Wallingford:CABI Publishing, 2000: 143-159.
[5] Ploetz R C. Fusarium wilt of banana[J]. Phytopathology,2015, 105(12): 1512-1521.
[6] Pandey A, Alok A, Lakhwani D, et al. Genome-wide expressionanalysis and metabolite profiling elucidate transcriptionalregulation of flavonoid biosynthesis and modulationunder abiotic stresses in banana[J]. Scientific Reports, 2016,6: 31361.
[7] Van den Berg N, Berger D K, Hein I, et al. Tolerance inbanana to Fusarium wilt is associated with earlyup‐regulation of cell wall‐strengthening genes in the roots[J].Molecular Plant Pathology, 2007, 8(3): 333-341.
[8] Hahlbrock K, Scheel D. Physiology and molecular biologyof phenylpropanoid metabolism[J]. Annual Review of PlantPhysiol and Plant Molecular Biology, 1989, 40(1): 347-369.
[9] Ohl S, Hedrick S A, Chory J, et al. Functional properties of aphenylalanine ammonia-lyase promoter from Arabidopsis[J].The Plant Cell, 1990, 2(9): 837-848.
[10] Dixon R A, Paiva N L. Stress-induced phenylpropanoidmetabolism[J]. The Plant Cell, 1995, 7(7): 1085-1097.
[11] Jorrin J, Dixon R A. Stress responses in alfalfa (Medicagosativa L.): II. Purification, characterization, and induction ofphenylalanine ammonia-lyase isoforms from elicitor-treatedcell suspension cultures[J]. Plant Physiology, 1990, 92(2):447-455.
[12] Leyva A, Jarillo J A, Salinas J, et al. Low temperature inducesthe accumulation of phenylalanine ammonia-lyase andchalcone synthase mRNAs of Arabidopsis thaliana in alight-dependent manner[J]. Plant Physiology, 1995(108):39-46.
[13] Nugroho L H, Verberne M C, Verpoorte R. Activities ofenzymes involved in the phenylpropanoid pathway in constitutivelysalicylic acid-producing tobacco plants[J]. PlantPhysiology and Biochemistry, 2002, 40(9): 755-760.
[14] Chaman M E, Copaja S V, Argando?a V H. Relationshipsbetween salicylic acid content, phenylalanine ammonia-lyase(PAL) activity, and resistance of barley to aphid infestation[J]. Journal of Agricultural and Food Chemistry, 2003,51(8): 2227-2231.
[15] 孙润泽, 张 雪, 成 果, 等. 葡萄苯丙氨酸解氨酶基因家族的全基因组鉴定及表达分析[J]. 植物生理学报, 2016,52(2): 195-208.
[16] 侯鹏, 粱冬, 张卫国, 等. 苯丙氨酸解氨酶基因家族在大豆中的时空表达研究[J]. 作物杂志, 2016(2): 57-62.
[17] 杨郁文, 李 双, 黄俊宇, 等. 陆地棉苯丙氨酸解氨酶家族基因的鉴定及分析[J]. 分子植物育种, 2017, 15(4):1184-1191.
[18] 孙宇蛟, 陈 欣, 崔浩楠, 等. 葫芦科PAL 基因家族生物信息学分析及甜瓜PAL4 基因克隆[J]. 分子植物育種,2018, 16(15): 4910-4920.
[19] 邓路长, 崔丽娜, 杨 麟, 等. 玉米苯丙氨酸解氨酶家族基因的鉴定与纹枯病的抗病分析[J]. 分子植物育种, 2019,17(3): 891-897.
[20] 张丽之, 樊 胜, 安 娜, 等. 苹果全基因组PAL 基因家族成员的鉴定及表达分析[J]. 浙江农业学报, 2018, 30(12):2031-2043.
[21] 吴亚楠, 李 贺, 苏 倩, 等. 沙棘PAL 家族基因的生物信息学分析[J]. 黑龙江农业科学, 2019(4): 15-17.
[22] Yan F, Li H Z, Zhao P. Genome-Wide Identification andtranscriptional expression of the PAL gene family in commonwalnut (Juglans regia L.)[J]. Genes, 2019, 10(1): 46.
[23] Chen J, He L, Jiang Y, et al. Role of phenylalanine ammonia‐lyase in heat pretreatment‐induced chilling tolerance inbanana fruit[J]. Physiologia Plantarum, 2008, 132(3):318-328.
[24] Alvarez J C, Rodriguez H A, Rodriguez-Arango E, et al.Characterization of a differentially expressed phenylalanineammonia-lyase gene from banana induced during Mycosphaerellafijiensis infection[J]. Journal of Plant Studies,2013, 2(2): 35.
[25] Wang Z, Li J Y, Jia C H, et al. Molecular cloning and expressionof four phenylalanine ammonia lyase genes frombanana interacting with Fusarium oxysporum[J]. BiologiaPlantarum, 2016, 60(3): 459-468.
[26] DHont A, Denoeud F, Aury J M, et al. The banana (Musaacuminata) genome and the evolution of monocotyledonousplants[J]. Nature, 2012, 488(7410): 213-217.
[27] Huang J, Gu M, Lai Z, et al. Functional analysis of theArabidopsis PAL gene family in plant growth, development,and response to environmental stress[J]. Plant Physiology,2010, 153(4): 1526-1538.
[28] Hu B, Jin J, Guo A Y, et al. GSDS 2.0: an upgraded genefeature visualization server[J]. Bioinformatics, 2014, 31(8):1296-1297.
[29] Fan S, Zhang D, Xing L, et al. Phylogenetic analysis of IDDgene family and characterization of its expression in responseto flower induction in malus[J]. Molecular Geneticsand Genomics, 2017, 292(4): 755-771.
[30] Yang S, Zhang X, Yue J X, et al. Recent duplications dominateNBS-encoding gene expansion in two woody species[J].Molecular Genetics and Genomics, 2008, 280(3): 187-198.
[31] Tamura K, Stecher G, Peterson D, et al. MEGA6: molecularevolutionary genetics analysis version 6.0[J]. Molecular Biologyand Evolution, 2013, 30(12): 2725-2729.
[32] 孔建強, 王 伟, 郑晓东, 等. 青蒿P450cDNA 基因的克隆及生物信息学分析[J]. 中国中药杂志, 2007, 32(21):2227-2231.
[33] Harakava R. Genes encoding enzymes of the lignin biosynthesispathway in Eucalyptus[J]. Genetics and Molecular Biology,2005, 28(3): 601-607.
[34] Yu X Z, Fan W J, Lin Y J, et al. Differential expression ofthe PAL gene family in rice seedlings exposed to chromiumby microarray analysis[J]. Ecotoxicology, 2018, 27(3):325-335.
[35] Shi R, Sun Y H, Li Q, et al. Towards a systems approach forlignin biosynthesis in Populus trichocarpa: transcript abundanceand specificity of the monolignol biosynthetic genes[J].Plant and Cell Physiology, 2010, 51(1): 144-163.
[36] Cochrane F C, Davin L B, Lewis N G. The Arabidopsisphenylalanine ammonia lyase gene family: kinetic characterizationof the four PAL isoforms[J]. Phytochemistry, 2004,65(11): 1557-1564.
[37] Achnine L, Blancaflor E B, Rasmussen S, et al. Colocalizationof L-phenylalanine ammonia-lyase and cinnamate4-hydroxylase for metabolic channeling in phenylpropanoidbiosynthesis[J]. The Plant Cell, 2004, 16(11): 3098-3109.
[38] Olsen K M, Lea U S, Slimestad R, et al. Differential expressionof four Arabidopsis PAL genes; PAL1 and PAL2 havefunctional specialization in abiotic environmental-triggeredflavonoid synthesis[J]. Journal of Plant Physiology, 2008,165(14): 1491-1499.
[39] Cramer C L, Edwards K, Dron M, et al. Phenylalanine ammonia-lyase gene organization and structure[J]. Plant MolecularBiology, 1989, 12(4): 367-383.
[40] Schomburg D, Salzmann M. Phenylalanine ammonia-lyase[M]//Enzyme Handbook 1. Berlin, Heidelberg:Springer, 1990: 999-1003.
[41] Reichert A I, He X Z, Dixon R A. Phenylalanine ammonia-lyase(PAL) from tobacco (Nicotiana tabacum): characterizationof the four tobacco PAL genes and active heterotetramericenzymes[J]. Biochemical Journal, 2009, 424(2):233-242.
[42] 崔建東, 李 艳, 牟德华. 苯丙氨酸解氨酶(PAL)的研究进展[J]. 食品工业科技, 2008, 29(7): 306-308.
[43] Ritter H, Schulz G E. Structural basis for the entrance intothe phenylpropanoid metabolism catalyzed by phenylalanineammonia-lyase[J]. The Plant Cell, 2004, 16(12): 3426-3436.
[44] Santiago L J M, Louro R P, De Oliveira D E. Compartmentationof phenolic compounds and phenylalanine ammonia-lyase in leaves of Phyllanthus tenellus Roxb. and theirinduction by copper sulphate[J]. Annals of Botany, 2000,86(5): 1023-1032.
[45] 盖江涛, 沈建凯, 王 鹏. 主要作物中PAL 基因家族的鉴定和序列分析[J]. 江苏农业科学, 2016, 44(6): 45-49.
[46] Kumar A, Ellis B E. The phenylalanine ammonia-lyase genefamily in raspberry. structure, expression, and evolution[J].Plant Physiology, 2001, 127(1): 230-239.
[47] Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410.
[48]Guo J, Wang M H. Characterization of the phenylalanine ammonia-lyase gene (SlPAL5) from tomato (Solanum lycopersicumL.)[J]. Molecular Biology Reports, 2009, 36(6): 1579-1585.
[49] 董春娟, 李 亮, 曹 宁, 等. 苯丙氨酸解氨酶在诱导黄瓜幼苗抗寒性中的作用[J]. 应用生态学报, 2015, 26(7): 2041-2049.
[50] 王彤彤, 何志贵, 韩蕊莲, 等. 干旱胁迫对半夏氮代谢相关酶活性的影响[J]. 浙江农业科学, 2018, 59(7): 1138-1141.
[51] Treutter D. Significance of flavonoids in plant resistance and enhancement of their biosynthesis[J]. Plant Biology, 2005, 7(6): 581-591.
[52] Mauch-Mani B, Slusarenko A J. Production of salicylic acid precursors is a major function of phenylalanine ammonia-lyase in the resistance ofArabidopsistoPeronospora parasitica[J]. The Plant Cell, 1996, 8(2): 203-212.
[53] Shadle G L, Wesley S V, Korth K L,et al. Phenylpropanoid compounds and disease resistance in transgenic tobacco with altered expression of L-phenylalanine ammonia-lyase[J]. Phytochemistry, 2003, 64(1): 153-161.
