龙眼MSIL全基因组鉴定及表达分析
2019-12-14许小琼陈晓慧申序徐小萍林玉玲赖钟雄
许小琼 陈晓慧 申序 徐小萍 林玉玲 赖钟雄
摘 要MSIL(Muliticopy suppressor of IRA homolog1-Like)基因是WD重復蛋白的一个亚家族,在植物生长发育过程中发挥重要的作用。为了解龙眼MSIL(DlMSIL)基因家族的生物学功能,本研究基于基因组和转录组数据,采用生物信息学分析法对DlMSIL基因成员进行鉴定,并进行蛋白质结构及理化性质分析、系统发育进化树构建、启动子顺式作用元件分析、龙眼体胚阶段和不同组织器官表达情况以及GA3处理下的定量表达分析。结果表明:DlMSIL基因家族含有6个成员属于WD40和CAF1C_H4-bd超家族,可分为3类;DlMSIL蛋白编码393~551 aa,等电点为4.68~7.62,该家族成员均不属于分泌蛋白;基因家族成员的内含子数目在4~14之间;DlMSIL启动子序列包含大量非生物胁迫响应元件及MYB结合位点,推测DlMSIL基因家族可能参与多种非生物胁迫反应;DlMSIL可能参与不同胚胎的发育过程和不同组织器官的形态建成。GA3处理下的表达分析显示高浓度时,DlMSI1a与DlMSI1c的表达受到了一定的抑制,而DlMSI4a的表达量呈现先下降后上升再下降的趋势,推测DlMSIL可能参与激素响应途径。本研究表明,DlMSIL基因家族成员可能参与胚胎发育、激素信号通路以及非生物胁迫反应等多种生物学功能,体现了龙眼MSIL基因家族功能具有多样性。
关键词 龙眼;体胚;MSIL;生物信息学分析;qPCR中图分类号 S667.2; Q943.2 文献标识码 A
Genome-wide Identification and Expression Analysis of MSILGene FamilyDuring Somatic Embryogenesis in Dimocarpus longan Lour.
XU Xiaoqiong, CHEN Xiaohui, SHEN Xu, XU Xiaoping, LIN Yuling, LAI Zhongxiong*
Institute of Horticultural Bioengineering, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China
Abstract TheMSIL (Multicopy suppressor of IRA homolog1-Like) gene is a subfamily of WD repeat proteins and plays an important role in growth and development of plants. In order to understand the biological function of the longanMSIL(DlMSIL) gene family, biological analysis was used to identifyDlMSILgene membersand the protein structure physical and chemical properties, promoter cis-acting element, expression of longan somatic embryo stage and different tissues and organs, and quantitative expression under GA3treatment were analyzed, based on genome and transcriptome data. TheDlMSIL gene family was consisted of six members belonging to the WD40 and CAF1C_H4-bd superfamily, which could be divided into three categories. The DlMSIL protein encoded 393–551 amino acids, and the isoelectric point was between 4.68 and 7.62. It was secreted protein. The number of introns of the gene family members was between 4 and 14. TheDlMSILpromoter sequence contained many abiotic stress response elements andMYBbinding sites, suggesting that theDlMSILgene family maight be involved in some abiotic stress responses. TheDlMSILmaight be involved in the morphogenesis of different embryonic development processes and different tissues and organs. The expression analysis of GA3treatment showed that the relative expression ofDlMSI1aandDlMSI1cwas inhibited with the increase of the concentration at high concentration, while the expression ofDlMSI4adecreased first, then increased and then decreased. It is speculated thatDlMSILmay be involved in the hormone response pathway. The study shows that the members of theDlMSILgene family may be involved in various biological functions such as embryonic development, hormone signaling pathways and abiotic stress responses, reflecting the diversity of longanMSILgene family functions.
Keywords Dimocarpus longanLour.; somatic embryo;MSIL(Multicopy suppressor of IRA homolog1-like gene); bioinformatics analysis; qPCR
DOI10.3969/j.issn.1000-2561.2019.10.006
WD重复蛋白是一种调控蛋白超家族,具有丰富的多样性。迄今为止,在进行WD40蛋白的研究历程中,发现其广泛存在于真核生物,而在原核生物中很少出现[1]。据研究表明,WD40结构域通常以Trp-Asp结尾,并由40~60个保守的氨基酸残基组成[2]。WD40重复序列主要通过介导蛋白之间的相互作用来参与信号转导、mRNA剪接、组蛋白修饰和细胞周期调控等重要过程[3]。该超家族的成员在植物特异性发育过程中扮演着重要的角色,它们通过上游信号通路或下游效应因子来实现其功能特异性[4]。例如,在拟南芥中,AGB1(含有7个WD40重复蛋白)功能的丧失会导致果实缩短[5],下胚轴和根的细胞分裂模式发生改变[6]。综上所述,可见WD40超家族参与多种生物学功能的发生过程。
MSIL蛋白是WD重复蛋白大家族中的亚家族,也是形成参与染色质组装、基因转录调节和细胞分裂等各种生物途径的蛋白复合物的一部分[7]。大多数MSIL基因家族成员包含了7个WD40重复蛋白[8]。1989年,Ruggieri等[9]首次在酿酒酵母IRA1多拷贝抑制因子(multicopy suppressor of the iral mutation 1)中将MSI1筛选出来,并确定MSI1蛋白是酿酒酵母RAS介导的cAMP通路的负调控因子。据研究表明,MSIL基因在染色质重塑、细胞分裂和分化、植物开花调控、DNA损伤修复和信号转导等过程中发挥重要的生物学功能[8]。拟南芥中,该基因家族共有5个成员(AtMSI1-5)[8],其中,AtMSIL1是染色质组装因子-1(CAF-1)、组蛋白去乙酰化酶、多冠抑制复合体-2(PRC2)等多种复合物的亚基,分别参与染色质的组装、脱落酸(ABA)机制的微调、春化反应等过程,与拟南芥的营养状况和生殖发育密切相关[10-12];此外,K?hler等[13]还证明了AtMSIL1在拟南芥种子发育的过程中不可缺少。在拟南芥中,不仅AtMSI1扮演著重要的角色,AtMSI4在拟南芥生长发育的过程中也发挥着不可忽视的作用。例如,Pazhouhandeh等[14]通过研究表明,AtMSI4可以结合纤环泛素连接酶和CLF-PRC2复合物调控拟南芥的开花过程。此外,AtMSI4对植物的生长发育起促进作用,并参与某些生物和非生物的胁迫反应[15]。而关于AtMSI2、AtMSI3在拟南芥中发挥什么样的功能,目前研究较少,因此其生物学功能尚不能确定。此外,周群丰[16]对水稻MSIL的研究表明水稻MSIL基因可以控制细胞的分裂分化,而OsMSI1对DNA甲基化及组蛋白H3K27甲基化修饰有重要的影响。MSIL不仅在植物中发挥作用,在哺乳动物中也是必不可少的,如MSIL可形成MSIL-pRB复合物参与抑制E2F转录因子的靶基因的转录过程[17]。综上所述,MSIL基因家族有着丰富多样的生物学功能,在植物和动物的生长发育过程中发挥着不可忽视的作用。因此,有必要对龙眼MSIL基因家族进行进一步的分析,了解其在龙眼生长发育过程中发挥的作用。
龙眼(Dimocarpus longan Lour.)是一种常绿果树,属于无患子科。原产于亚洲温带和热带,在我国广泛种植于南部和东南亚地区[18]。龙眼胚胎发育状况影响其种子大小、果实品质及果实产量[19],因此,对龙眼胚胎发育调控进行研究是十分有必要的。在进行龙眼胚胎发育的研究过程中,本实验室提供的龙眼基因组[20]带来了巨大的便利。目前,对于龙眼胚胎发育的研究已经有了一些进展。例如,DlRan参与了生长素类似物(2,4-D)诱导的龙眼体细胞胚胎生长发育的过程[21],龙眼体细胞胚胎形态和结构的建立则需要很多的lncRNA共同参与[22]。对于MSIL基因家族在植物胚胎发育过程中所发挥作用的研究较少,Rossi等[7]通过实验探讨了ZmRbAp基因在胚乳早期分化的作用,发现ZmRbAp1参与了胚乳早期的形成,而且ZmRbAp基因可能有助于生殖器官细胞分裂和形态建成。由此推测,龙眼MSIL基因家族也有类似的生物学功能。因此,本文通过对龙眼基因组进行筛选,共获得6条龙眼MSIL基因即DlMSI1a、DlMSI1b、DlMSI1c、DlMSI2、DlMSI4a、DlMSI4b,并根据转录组对龙眼MSIL基因在不同胚性发生阶段和不同组织器官中的特异性表达进行分析,初步了解在体胚阶段与非体胚阶段龙眼MSIL基因表达的差异性。然后通过对龙眼MSIL基因家族成员的蛋白质理化性质、系统发育进化树、基因结构和蛋白质结构域以及启动子顺式作用元件进行分析,从而对龙眼MSIL基因的生物学功能有了初步的了解。最后,采用荧光定量PCR分析(qPCR)研究龙眼MSIL基因部分成员在不同激素浓度下的表达情况。以期为研究龙眼MSIL基因家族在龙眼体胚及生长和发育过程中的作用机制提供理论依据。
1 材料与方法
1.1材料
实验室构建的龙眼基因组数据库(NCBI登录号:BioProject PRJNA305337)、龙眼转录组数据库(SRA050205),在Uniprot(https://www.uniprot. org/)数据库中下载拟南芥(Arabidopsis thaliana)MSIL家族的基因序列和氨基酸序列,phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)数据库下载水稻(Oryza sativa)、玉米(Zea mays)、苹果(Malus domestica)、大豆(Glycine max)、甜橙(Citrus sinensis)、马铃薯(Solanum tuberosum)、番茄(Solanum lycopersicum)MSIL家族的基因序列和氨基酸序列。
将实验室培养了20 d的生长发育较好的龙眼胚性愈伤组织作为材料,并选出0.5 g的松散、浅黄且颗粒较细的龙眼愈伤组织作为不同激素处理的备用材料。首先选取5个干燥洁净的锥形瓶,然后加入50 mL的MS液体培养基,再分别加入浓度为0、2.5、12.5、62.5 mg/L的赤霉素激素,把选好的愈伤组织接种于配好的液体培养基中,在25 ℃、110 r/min的摇床中,黑暗培养24 h。最后收集上述处理的材料,用液氮速冻后保存在?80 ℃的冰箱中,用于荧光定量分析[23]。
1.2方法
1.2.1DlMSIL家族成员的鉴定和进化树的构建 为鉴定龙眼MSIL基因家族成员,首先采用Conserved Domains Database(CDD;https:// www. ncbi.nlm.nih.gov/Structure/cdd/cdd.shtml)对拟南芥MSIL氨基酸序列的蛋白结构域进行初步分析,再通过TBtools[24]进行绘制,最后根据获得的拟南芥MSIL保守结构域并结合NCBI Blast同源比对结果,进行龙眼MSIL基因家族成员的筛选,筛选过后共获得6条龙眼MSIL候选序列。
通过CDD進行龙眼MSIL候选序列和AtMSI1序列的蛋白结构域分析,再采用TBtools软件对龙眼MSIL候选序列的蛋白结构域进行绘制;利用DNAMAN对龙眼MSIL候选序列和AtMSL1蛋白序列进行同源性对比;采用MEGA 5.05软件对龙眼、拟南芥、水稻、玉米、苹果、大豆、甜橙、马铃薯、番茄的MSIL蛋白家族序列进行序列对比并手动删除同源性相差较大的序列,然后通过邻近法(Neighbor-joining method)构建系统进化树,将自展法系数(Bootstrap)设置为1000次进行重复检验。采用同样的方法,单独对龙眼MSIL基因家族成员进行系统进化树的构建。
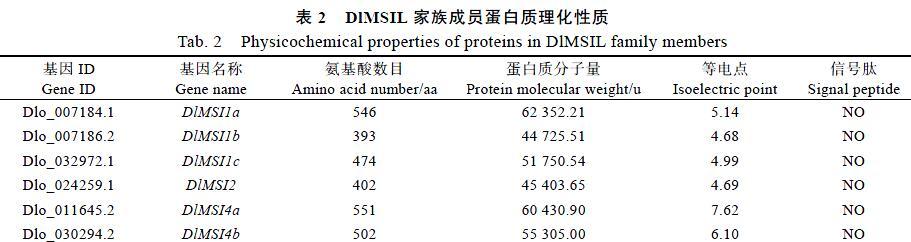
1.2.2DlMSIL基因结构以及蛋白结构域分析 通过GSDS在线分析龙眼MSIL家族成员基因结构中内含子与外显子的数量和位置;通过ExPASy、SignalP4.0在线分析龙眼MSIL家族成员氨基酸序列的等电点(pI)、蛋白质分子量(Mw)、氨基酸数目以及N端信号肽;通过NetNGlyc在线分析DlMSIL家族成员氨基酸序列的糖基化位点(Threshold=0.5);通过MEME对DlMSIL家族成员进行motif分析,然后再通过TBtools将得到的motif结果进行进一步绘制。
1.2.3DlMSIL基因的启动子分析 采用Plant care在线网站分析龙眼MSIL家族成员的启动子特征以及顺式作用元件的特点,然后再采用GraphPad Prism软件对顺式作用元件进行统计分析,从而对DlMSIL家族成员的顺式元件有更加深入的了解。
1.2.4DlMSIL基因家族成员在不同体胚阶段、不同器官及不同激素处理下的特异性表达 利用在龙眼转录组数据库中提取的DlMSIL家族成员在不同体胚发生阶段即非胚性愈伤组织(non-embryonic callus,NEC)、不完全胚性紧实结构(incomplete compact pro-embrogenic cultures,ICpEC)、球形胚(globular embryos,GE)和不同组织器官即种子、根、茎、叶、花蕾、果肉、幼果、果皮以及不同激素(2,4-D、2,4-D-KT、KT、MS)中特异表达的FPKM值,通过TBtools制作热图,以便了解该基因家族成员在不同体胚阶段、不同器官及不同激素处理下的差异性表达。
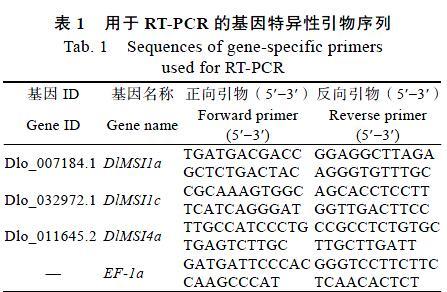
1.2.5DlMSIL基因家族部分成员qPCR引物设计和分析 利用DlMSI1a、DlMSI1c、DlMSI4a3条龙眼MSIL基因家族成员的CDS序列,通过Primer Premier6.0初步寻找其正向与反向引物,再通过DNAMAN进行二次筛选,得到以下符合引物设计原则的引物(表1)。以EF-1a为内参[25],采用Excel并参考单内参系统检验DlMSIL基因家族成员的表达情况,利用IBM SPSS Statistics 24软件进一步了解龙眼EC阶段中DlMSIL1a、DlMSI1c、DlMSI4a在不同浓度的赤霉素浓度处理下的特异性表达。
25.89%、52.69%、23.15%和21.36%,由此可见,DlMSI1b与AtMSI1同源性最高,因此进一步推测DlMSI1b与AtMSI1可能具有类似的功能。
2.4DlMSIL基因家族成员启动子分析
为了进一步了解龙眼MSIL基因家族成员的基因表达调控基本情况,通过Plant Care在线网站对龙眼MSIL基因上游2000 bp的启动子区域进行了顺式元件分析。结果表明,龙眼MSIL基因家族成员均含有CAAT-box和TATA-box,并且CAAT-box均多于TATA-box,这表明该基因家族成员均能正常转录(图5)。
为了更好的了解龙眼MSIL基因家族成員的生物学功能,对该基因家族成员的主要启动子的顺式作用元件进行了分析(图6)。结果表明,龙眼MSIL基因家族成员均含有光响应元件、增强子顺式作用元件及在转录起始位点?30附近的核心启动子响应元件,并且在转录起始位点?30附近的核心启动子响应元件含量最多。大部分龙眼
MSIL基因家族成员具有厌氧诱导响应元件,参与赤霉素、水杨酸的激素应答以及低温胁迫;50%的基因响应茉莉酸甲酯、脱落酸的激素应答以及玉米醇溶蛋白的代谢调控,还含有光胁迫和干旱胁迫下MYB转录因子的结合位点;33.3%的基因具有生长素响应元件和防御与应激响应元件。此外,与黄酮类化合物生物合成相关基因调控的MYB转录因子结合位点只存在DlMSI1a基因中,参与昼夜控制的顺式作用调控元件和在α-淀粉酶启动子中保守的序列只存在于DlMSI4a基因中,只有DlMSI2基因具有MYBHV1结合位点,只有DlMSI4b具有缺氧特异性诱导响应。由此可见,龙眼MSIL基因家族成员具有大量的光响应元件、激素响应元件、胁迫响应元件以及其他参与植物生长调节的顺式响应元件。不同的成员所包含的顺式作用元件及其数量有所不同,这可能导致不同成员产生的光周期效应不同,对不同的胁迫响应具有一定的区别,参与龙眼生长过程中相关的激素应答存在显著差异,并且不同成员对龙眼生长过程中有不同的特异性功能。而特有的顺式调控元件,则可能导致龙眼MSIL基因家族成员之间出现功能特异性的情况。
2.5 DlMSIL基因家族成员在不同体胚阶段和不同器官中特异性表达分析
为了解龙眼MSIL基因在不同体胚阶段和不同器官的特异性表达,利用TBtools制作了热图(图7)。结果显示,不同体胚发生过程中,龙眼MSIL基因在ICpEC阶段中均表现为上调表达;在NEC阶段中只有DlMSI1c上调表达;在EC阶段DlMSI1b、DlMSI1c下调表达,其余龙眼MSIL基因家族成员均上调表达;在GE阶段中只有DlMSI1c下调表达。由此可见,龙眼MSIL基因家族成员在体胚发生阶段总体呈现上调表达的趋势,这可能与龙眼MSIL基因家族成员在体胚发生阶段具有重要功能有关。除此之外,发现DlMSI1c在不同体胚发生过程中与大部分龙眼MSIL基因发生表达的不同,这可能与DlMSI1c基因在体胚发生过程中不同的生物学功能有关。
在不同组织器官中,龙眼MSIL基因家族成员在种子、花、花蕾、果皮均表现为下调表达;在幼果中DlMSI1a、DlMSI1b、DlMSI1c上调表达,DlMSI2、DlMSI4a、DlMSI4b下调表达;在叶子中,只有DlMSI1c上调表达,其余龙眼MSIL基因均下调表达;在果肉中,DlMSI1a、DlMSI4a下调表达,DlMSI1b、DlMSI1c、DlMSI2、DlMSI4b上调表达;在根中,DlMSI1a、DlMSI1b、DlMSI4a下调表达,DlMSI1c、DlMSI2、DlMSI4b上调表达;在茎中,DlMSI1b、DlMSI1c上调表达,其余均下调表达。由此可见,龙眼MSIL基因在组织器官中总体呈现下调表达。
综上所述,从体胚阶段到非体胚阶段龙眼MSIL基因总表达水平呈现一种逐渐降低的趋势,暗示龙眼MSIL基因可能更多参与龙眼植株的体胚阶段。龙眼MSIL基因在体胚发生阶段发挥着重要的作用,其中在不完全胚性阶段均表达,大部分成员在胚性阶段表达,而在非胚性阶段有5个成员不表达,这体现出龙眼MSIL基因在胚性阶段和非胚性阶段的显著差异;在组织器官中,大部分龙眼MSIL基因不表达,尤其在种子、花、花蕾、果皮中均不表达,也可能是由于龙眼MSIL基因较少参与组织器官的形态建成。
2.6 DlMSIL基因家族成员在不同激素下的表达模式分析
为了解DlMSIL基因家族成员在不同激素下的特异性表达,通过TBtools制作了熱图(图8)。结果显示,龙眼MSIL基因家族成员在2,4-D与2,4-D-KT激素处理下,均呈现下调表达;而在KT与MS激素处理下,均呈现上调表达。推测2,4D可能抑制龙眼MSIL基因家族成员的表达,KT与MS则促进龙眼MSIL基因家族成员的表达。
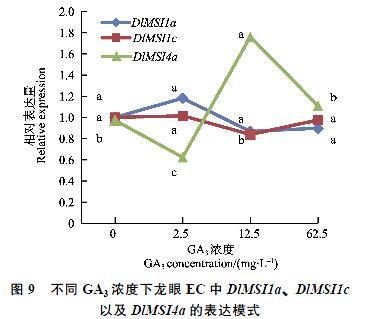
研究龙眼EC阶段中DlMSIL1a、DlMSI1c、DlMSI4a在不同浓度的赤霉素(GA3)中的特异性表达,结果如图9所示。在GA3不同浓度的处理下,DlMSI1a和DlMSI1c在不同GA3浓度处理下的表达均呈现先上升后下降的趋势,由此可见在低浓度处理下对DlMSI1a和DlMSI1c具有上调表达作用,而高浓度处理具有下调表达作用,且在GA3浓度为2.5 mg/L时相对表达量达到最大值,总体表现为下调表达,区别是DlMSI1c的表达随着GA3浓度变化的幅度较小; DlMSI4a的相对表达量呈现为先下降再上升最后下降的趋势,DlMSI4a表达的变化幅度较大,较低的GA3浓度时其表现为下调表达,较高浓度则表现为上调表达。此外,DlMSI4a在GA3浓度为12.5 mg/L时相对表达量达到最大值,因此可以认为在GA3浓度为12.5 mg/L的处理下最利于DlMSI4a进行转录。随着GA3浓度的改变DlMSI4a变化幅度剧烈的表达模式,暗示其受到GA3浓度的调控作用。
3 讨论
3.1 DlMSIL基因家族成员的功能可能具有多样性
CAF1C_H4-bd是CAF1复合物的亚基,而CAF-1是一种保守的杂三聚体蛋白复合物,促进主要的组蛋白H3复制依赖的核小体组装。在DNA复制与损伤修复过程中,CAF-1主要参与染色质的形成[26]。研究发现,在果蝇中,最大的亚基CAF-1 p180是控制异染色质形成和维持表观遗传的重要因素[27]。在拟南芥中,AtMSI1与RDR1结合抑制雌配子中MET1的表达,从而导致印记基因FIS2/FWA不能被甲基化修饰,而影响胚乳的形成[28]。前面我们已经知道,WD40超家族具有多种生物学功能。结合蛋白结构分析,结果显示龙眼MSIL家族成员均属于WD40超家族和CAF1C_H4-bd超家族,且AtMSI1与DlMSI1a、DlMSI1b、DlMSI2的蛋白序列的同源性较高,推测DlMSIL在龙眼的生长与发育过程中可能参与染色质组装、胚乳发育等生物学途径。再结合启动子顺式元件分析,结果显示龙眼MSIL基因家族具有干旱胁迫和光胁迫下MYB转录因子的结合位点,暗示龙眼MSIL基因可能受MYB转录因子调控途径作用,从而增强抵抗逆境胁迫的能力。
3.2 DlMSIL基因家族成员可能在龙眼胚胎发育过程中起着关键作用
迄今为止,已有研究表明MSIL基因家族成员在胚胎生长发育的过程中发挥着不可忽视的作用。如拟南芥AtMSI1同FIE、MEA共同构成FIS复合物,而FIS复合体中的任何一个亚基的缺乏都会导致与受精无关的种子发育和种子败育,K?hler等[13]的研究结果表明AtMSI1对拟南芥种子发育的正确起始和发展过程有着举足轻重的作用。后来,Dumbliauskas等[29]还发现AtMSI1与CUL4-DDB1结合形成控制胚乳形成和维持MEDEA亲本印记过程的蛋白复合物。根据我们对龙眼MSIL基因家族成员在不同胚性发生阶段和不同器官中的特异性表达结果可知,DlMSIL在胚性发生阶段具有明显的上调表达,尤其是在胚胎发育的成熟阶段表现出较高的表达,而在不同器官中DlMSIL的表达显著下调。因此,我们推测DlMSIL基因家族是胚胎生长和发育过程中的关键调节因子。此外,值得注意的是,在体胚发生阶段中,DlMSI1c的表达与大部分DlMSIL基因成员相反,在NEC阶段中其他DlMSIL基因成员表现为下调表达,DlMSI1c则表现为上调表达;在GE阶段中其他DlMSIL基因成员表现为上调表达,DlMSI1c则表现为下调表达。由此推测,在龙眼DlMSIL基因中,只有DlMSI1c参与龙眼胚胎体细胞的发生过程,而其他DlMSIL基因成员则主要参与胚胎的发育过程。
3.3 DlMSIL基因家族成員可能参与多种植物激素信号通路和某些非生物胁迫
DlMSIL基因家族中有50%以上的成员具有赤霉素响应元件。赤霉素是调节植物细胞伸长的主要激素之一,如果缺乏赤霉素会导致植物生长矮小[30]。而周群丰[16]经研究表明油菜素内酯和赤霉素的信号转导过程中受阻可能造成植株矮化。本研究就不同GA3浓度对DlMSI1a、DlMSI1c及DlMSI4a进行了定量表达研究,结果表明,DlMSI1a与DlMSI1c在高浓度时其表达模式表现为抑制作用,而DlMSI4a在不同浓度处理下其表达模式呈现先下降后上升再下降的趋势,表明DlMSI4a的表达容易受到GA3浓度的调控,因此推测DlMSIL可以通过赤霉素信号通路在种子生长和发育过程中发挥作用。除此之外,DlMSIL基因家族还具有脱落酸、茉莉酸甲酯、赤霉素、水杨酸等激素应答响应元件。由此推测,DlMSIL基因成员参与多种激素信号传递。
根据Mehdi等[11]研究表明,MSI1与组蛋白去乙酰化19(HDA19)属于一个复合体,MSI1或HDA19可以都反向调控ABA的敏感性和盐胁迫的耐受性。此外,ABA还是对非生物胁迫的主要介质。因此根据我们对龙眼MSIL基因家族成员启动子顺式作用元件的分析,我们可知该基因家族有50%的成员具有ABA响应元件,从而初步推测龙眼MSIL基因家族部分成员可以调控ABA的敏感性和盐胁迫的耐受性。除此之外,在龙眼MSIL基因家族中,50%及以上成员具有低温应激、厌氧胁迫、光胁迫和干旱胁迫等非生物胁迫响应元件,由此我们猜测龙眼MSIL基因参与植株生长发育过程中的非生物胁迫过程。Kim等[31]通过研究得知,AtMSI4/FVE在调控植物开花和抗寒胁迫方面具有双重作用,这种作用可能为植物提供进化适应性。此外,面对非最佳环境状态时,植物利用大量的转录反应来面对某些非生物胁迫,这些转录调控在很大程度上受染色质控制[32],而MSIL基因家族又是参与染色质组装的蛋白复合物的一部分,并且该基因家族部分成员具有非生物胁迫响应元件,因此,我们猜测龙眼MSIL基因家族部分成员在多种非生物胁迫上发挥着不可忽视作用。
除此之外,龙眼MSIL基因家族成员均含有大量的光响应元件,这说明该基因家族在光响应过程中发挥着举足轻重的作用。不难发现,在龙眼MSIL基因家族中,只有DlMSI4a具有参与昼夜控制的顺式作用调控元件,因此我们推测该成员在调节植物昼夜节律上发挥重要的作用。同时只有DlMSI1c具有与黄酮类化合物生物合成相关基因调控的MYB转录因子结合位点,因此在龙眼生长发育过程中,该成员可能参与种子成熟或者果皮成色阶段。
总之,龙眼MSIL基因家族成员在体胚阶段如何应对多种生物胁迫,如何参与激素响应以及在龙眼生长发育及代谢中如何起作用还需要进一步深入研究。
参考文献
[1] Li Q, Zhao P, Li J, et al. Genome-wide analysis of theWD-repeat protein family in cucumber and Arabidopsis[J].Molecular Genetics and Genomics, 2014, 289(1): 103-124.
[2] Wall M A, Coleman D E, Lee E, et al. The structure of the Gprotein heterotrimer Giα1β1γ2[J]. Cell, 1995, 83(6):1047-1058.
[3] 李 頔, 唐晓凤, 刘永胜. 番茄 MSI2-like 基因的克隆及功能初探[J]. 四川大学学报(自然科学版), 2015, 52(4):871-878.
[4] van Nocker S, Ludwig P. The WD-repeat proteinsuperfamily in Arabidopsis: conservation and divergence instructure and function[J]. BMC Genomics, 2003, 4(1): 50.
[5] Lease K A, Wen J, Li J, et al. A mutant Arabidopsisheterotrimeric G-protein β subunit affects leaf, flower, andfruit development[J]. The Plant Cell, 2001, 13(12):2631-2641.
[6] Ullah H, Chen J G, Temple B, et al. The β-subunit of theArabidopsis G protein negatively regulates auxin-inducedcell division and affects multiple developmental processes[J].The Plant Cell, 2003, 15(2): 393-409.
[7] Rossi V, Varotto S, Locatelli S, et al. The maize WD-repeatgene ZmRbAp1 encodes a member of the MSI/RbApsub-family and is differentially expressed during endospermdevelopment[J]. Molecular Genetics and Genomics, 2001,265(4): 576-584.
[8] Hennig L, Bouveret R, Gruissem W. MSI1-like proteins: an escort service for chromatin assembly and remodeling complexes[J]. Trends in Cell Biology, 2005, 15(6): 295-302.
[9] Ruggieri R, Tanaka K, Nakafuku M,et al.MSI1, a negative regulator of the RAS-cAMP pathway inSaccharomyces cerevisiae[J]. Proceedings of the National Academy of Sciences of the United States of America, 1989, 86(22): 8778-8782.
[10] Kaya H, Shibahara K I, Taoka K I, et al. FASCIATA genesfor chromatin assembly factor-1 in Arabidopsis maintain thecellular organization of apical meristems[J]. Cell, 2001,104(1): 131-142.
[11] Mehdi S, Derkacheva M, Ramstr?m M, et al. The WD40domain protein MSI1 functions in a histone deacetylasecomplex to fine-tune abscisic acid signaling[J]. The PlantCell, 2016, 28(1): 42-54.
[12] Derkacheva M, Steinbach Y, Wildhaber T, et al. ArabidopsisMSI1 connects LHP1 to PRC2 complexes[J]. The EMBOJournal, 2013, 32(14): 2073-2085.
[13] K?hler C, Hennig L, Bouveret R, et al. Arabidopsis MSI1 isa component of the MEA/FIE Polycomb group complex andrequired for seed development[J]. The EMBO Journal, 2003,22(18): 4804-4814.
[14] Pazhouhandeh M, Molinier J, Berr A, et al. MSI4/FVEinteracts with CUL4-DDB1 and a PRC2-like complex tocontrol epigenetic regulation of flowering time inArabidopsis[J]. Proceedings of the National Academy ofSciences of the United States of America, 2011, 108(8):3430-3435.
[15] Kenzior A, Folk W R. Arabidopsis thaliana MSI4/FVEassociates with members of a novel family of plant specificPWWP/RRM domain proteins[J]. Plant Molecular Biology,2015, 87(4-5): 329-339.
[16] 周群豐. OsMSIL 类基因在水稻表观调控中的功能研究[D].武汉: 华中农业大学, 2015.
[17] Ross J F, Liu X, Dynlacht B D. Mechanism of transcriptionalrepression of E2F by the retinoblastoma tumor suppressorprotein[J]. Molecular Cell, 1999, 3(2): 195-205.
[18] Sheu S Y, Fu Y T, Huang W D, et al. Evaluation of xanthineoxidase inhibitory potential and in vivo hypouricemicactivity of Dimocarpus longan Lour. extracts[J].Pharmacognosy Magazine, 2016, 12(46): S206-S212.
[19] Lai Z, Lin Y. Analysis of the global transcriptome of longan(Dimocarpus longan Lour.) embryogenic callus usingIllumina paired-end sequencing[J]. BMC Genomics, 2013,14(1): 561.
[20] Lin Y, Min J, Lai R, et al. Genome-wide sequencing oflongan (Dimocarpus longan Lour.) provides insights intomolecular basis of its polyphenol-rich characteristics[J].GigaScience, 2017, 6(5): 1-14.
[21] Fang Z, Lai C, Zhang Y, et al. Molecular cloning, structuraland expression profiling of DlRan genes during somaticembryogenesis in Dimocarpus longan Lour.[J]. SpringerPlus,2016, 5(1): 181.
[22] Chen Y, Li X, Su L,et al. Genome-wide identification and characterization of long non-coding RNAs involved in the early somatic embryogenesis in Dimocarpus longanLour. [J]. BMC Genomics, 2018, 19(1): 805.
[23] 陳晓慧, 白 玉, 陈 旭, 等. 龙眼体胚发生过程中DCL基因的分子特性及表达分析[J]. 西北植物学报, 2017, 37(11): 2120-2129.
[24] Chen C, Chen H, He Y,et al. TBtools, a Toolkit for Biologists integrating various biological data handling tools with a user-friendly interface[J]. BioRxiv, 2018: 289660.
[25] Lin Y L, Lai Z X. Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J]. Plant Science, 2010, 178(4): 359-365.
[26] Winkler D D, Zhou H, Dar M A,et al. Yeast CAF-1 assembles histone (H3-H4)2tetramers prior to DNA deposition[J]. Nucleic Acids Research, 2012, 40(20): 10139-10149.
[27] Huang H, Yu Z, Zhang S,et al. Drosophila CAF-1 regulates HP1-mediated epigenetic silencing and pericentric heterochromatin stability[J]. Journal of Cell Science, 2010, 123(16): 2853-2861.
[28] Jullien P E, Mosquna A, Ingouff M,et al. Retinoblastoma and its binding partner MSI1 control imprinting inArabidopsis[J]. PLoS Biology, 2008, 6(8): e194.
[29] Dumbliauskas E, Lechner E, Jaciubek M,et al. TheArabidopsisCUL4–DDB1 complex interacts with MSI1 and is required to maintainMEDEAparental imprinting[J]. The EMBO Journal, 2011, 30(4): 731-743.
[30] Tong H, Xiao Y, Liu D,et al. Brassinosteroid regulates cell elongation by modulating gibberellin metabolism in rice[J]. The Plant Cell, 2014, 26(11): 4376-4393.
[31] Kim H J, Hyun Y, Park J Y,et al. A genetic link between cold responses and flowering time throughFVEinArabidopsis thaliana[J]. Nature Genetics, 2004, 36(2): 167-171.
[32] Banerjee A, Roychoudhury A. Epigenetic regulation during salinity and drought stress in plants: Histone modifications and DNA methylation[J]. Plant Gene, 2017, 11: 199-204.
