高效液相色谱法同时测定食品中纳他霉素和脱氢乙酸的含量
2019-12-14刘斯琪
刘斯琪
(四川省食品药品检验检测院,四川 成都 610000)
0 引 言
纳他霉素(natamycin)又名匹马霉素,是一种多烯大环内酯类抗菌素,对霉菌、酵母等真菌有显著抑制性。因其高效的广谱抗菌性,且不影响食品风味,目前在全世界多达30个国家作为天然、安全的食品防腐剂与抗菌剂使用[1]。脱氢乙酸(relative deviation)可有效抑制霉菌、大肠杆菌等微生物生长,是继山梨酸、苯甲酸后作为低毒高效的新一代广谱防腐剂,广泛应用于糕点、饮料等食品中[2-4]。
目前,食品中纳他霉素或脱氢乙酸的检测方法多为单一法检测,主要有高效液相色谱法、气相色谱法、液相色谱-质谱法、分光光度法、电化学法等[5-6]。GB 2760-2014《食品安全国家标准食品添加剂使用标准》中明确规定[7],在糕点、果蔬汁中纳他霉素最大使用量0.3 g/kg,脱氢乙酸在糕点、果蔬汁中最大使用量0.5 g/kg和0.3 g/kg,且牛奶等乳制品中不允许使用[8]。鉴于常见防腐剂纳他霉素和脱氢乙酸应用性的广泛性,建立一种能同时测定二者含量,可在一定程度减少检测人力、物力、时间成本。本研究选取3种常见食品基质,旨在探索一种纳他霉素和脱氢乙酸的同步前处理和含量检测的分析方法。
1 材料和方法
1.1 仪器与试剂
岛津LC-20A高效液相色谱仪;Mettler Toledo电子天平;heidolph振荡器;Thermo离心机。
甲醇(色谱纯,SIGMA-ALDRICH);超纯水(由Mill-Q纯水器系统制得);纳他霉素标准品(Dr Ehrenstorfer GmbH,91.3%);脱氢乙酸标准品(Chemical Service,99.90%);乙酸 (色谱纯)。
糕点、纯牛奶、果蔬汁饮料购于本地超市。
1.2 标准溶液配制
分别称取经纯度换算后的纳他霉素、脱氢乙酸标准物质,用甲醇溶解并定容至25 mL,配制成1 000 mg/L 的标准储备液,保存于 4 ℃ 冰箱。临用前分别各取母液1 mL,用甲醇稀释至浓度为100 mg/L的中间液。再用甲醇依次稀释,配制成0.05,0.5,1,2,5,10,20 mg/L 的标准曲线溶液。
1.3 样品溶液的制备
称取样品 5 g(精确至 0.01 g),加入 20 mL 甲醇,10 mL浓度为10%乙酸溶液,放入振荡器提取15 min,取出,离心静置(若为牛奶基质,则另加入质量浓度为10%的亚铁氰化钾溶液2滴),取上清液过孔径为0.22 μm有机微孔滤膜,供液相分析使用。
1.4 色谱条件
色谱柱:ZORBAX SB-C18 柱(4.6 mm×150 mm,5 μm);流动相:甲醇∶10% 乙酸溶液(梯度洗脱);柱温:30 ℃;流量:1.2 mL/min;检测波长:305 nm;进样体积:10 μL。
2 结果与分析
2.1 色谱条件筛选
2.1.1 流动相选择
参考相关文献及常用流动相[9-11],选取了甲醇∶水 (50∶50),甲醇∶10% 乙酸 (60∶40),对质量浓度为5.0 μg/mL的标准品进行分离时,发现甲醇∶水流动相所产生的纳他霉素峰形较差,甲醇∶10%乙酸能有较好峰形,因此选用甲醇∶10%乙酸为流动相,结果见图1所示。实验对其比例进行多次调整,结合3种基质杂峰影响,最终以甲醇:10%乙酸梯度洗脱进行分离,具体比例见表1所示,并在筛选中发现3种基质均为阴性,其中糕点基质的杂峰较多,因此后续色谱条件以糕点基质进行条件确定。
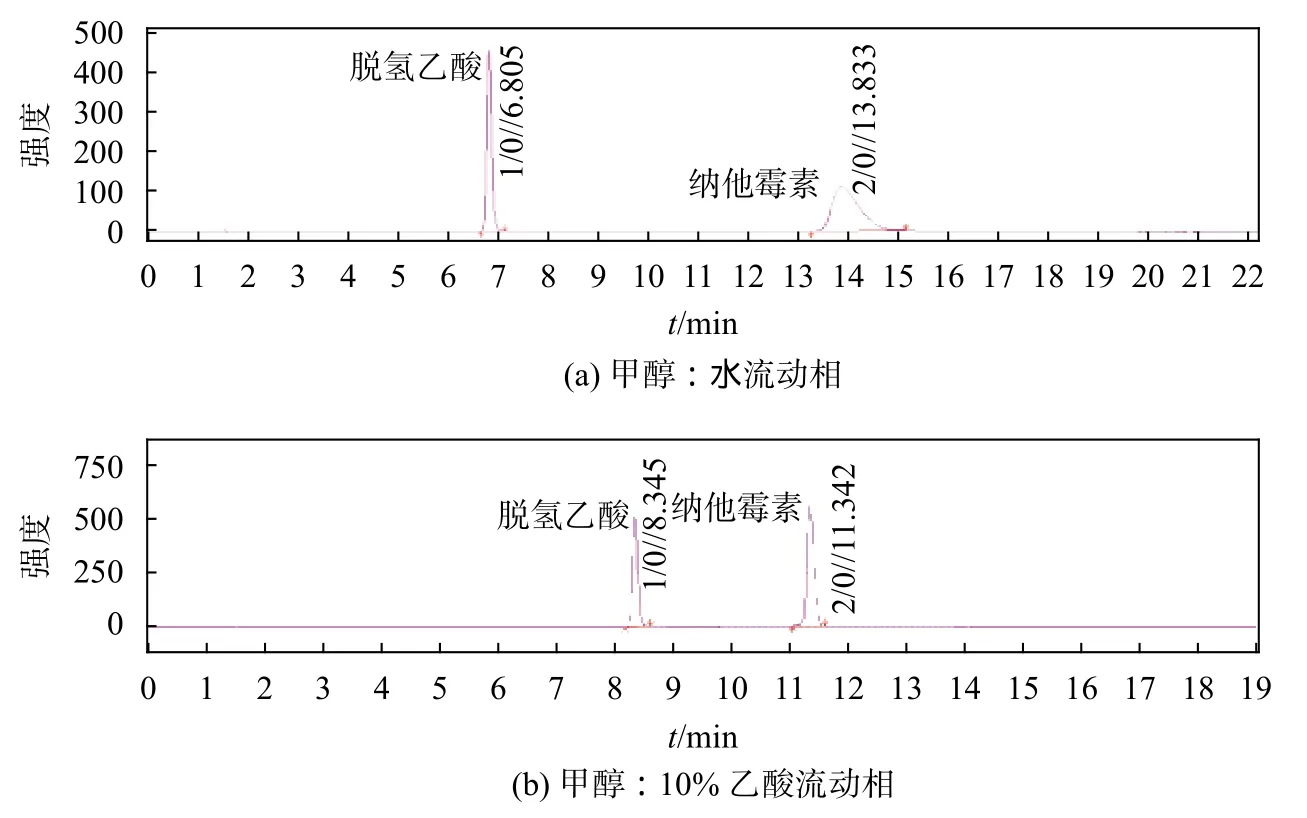
图1 流动相种类筛选

表1 流动相梯度洗脱比例
2.1.2 检测波长的确定
分别以1.2项下所制纳他霉素和脱氢乙酸标准储备溶液稀释后,进行高效液相测定,在190~800 nm范围内进行全波长扫描,通过3D吸收图谱,结合纳他霉素和脱氢乙酸的共有较大吸收,最终设定检测波长为 305 nm。
2.1.3 柱温考察
为考察柱温变化是否显著影响色谱峰分离效果,在2.1.1和2.1.2项下所确定条件,分别设置柱温 25,30,35 ℃ 进行试验,无明显差异,以常用柱温30 ℃为最终实验温度。
2.1.4 流量选择
以2.1.1-2.1.3项下所确定流动相比例、波长和柱温,进行流量筛选。分别以 0.8,1.0,1.2 mL/min试验。流量为0.8 mL/min时,脱氢乙酸与左右相邻峰均有连接,纳他霉素能良好分离;流量为1.0 mL/min时,脱氢乙酸与右侧峰有少许连接,纳他霉素能良好分离;流量为1.2 mL/min时,脱氢乙酸与纳他霉素均能与左右两侧峰有良好分离,且出峰时间最短;因此流量设定为1.2 mL/min。不同流量分离色谱图见图2所示。
2.2 样品制备溶媒筛选
称取样品5 g,参考相关文献,骆健美等人研究发现纳他霉素在甲醇中有一定溶解度[12],魏宝东等人发现其易溶于稀酸溶液[13],pH值对纳他霉素和脱氢乙酸溶解均有影响[14-15],前处理分别采用溶媒甲醇(40 mL)、超纯水(40 mL),甲醇∶水(3∶1),甲醇∶10% 乙酸(3∶1),甲醇∶0.02 mol/L 乙酸铵(3∶1),以纳他霉素和脱氢乙酸回收率对5种溶媒进行筛选,结果趋势如图3所示。
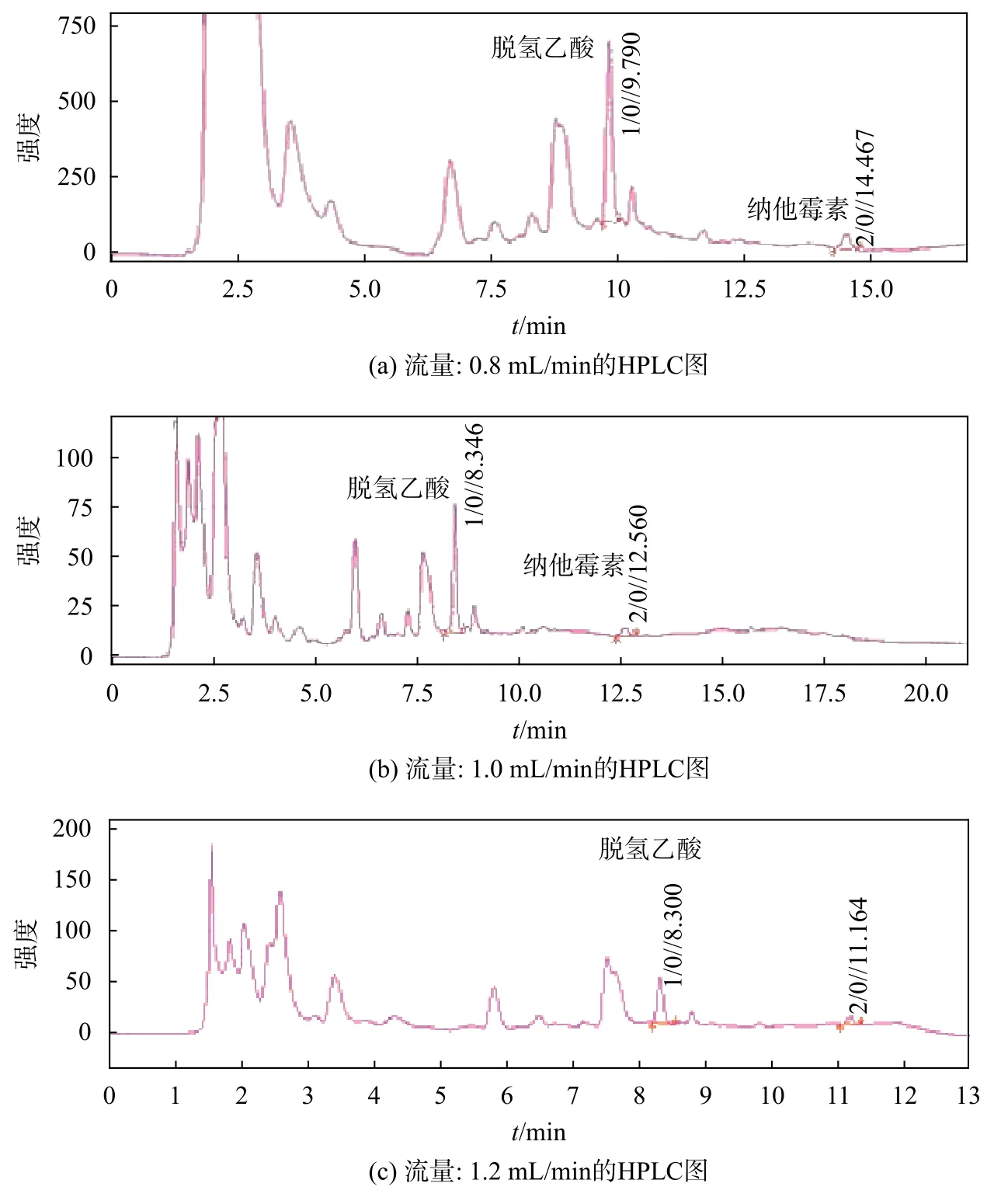
图2 不同流量分离色谱图
由图3结果可知,纳他霉素和脱氢乙酸二者在甲醇:10% 乙酸(3∶1)和甲醇∶0.02 mol/L乙酸铵(3∶1)为溶媒时,提取效果良好,其次为甲醇:水(3∶1)。考虑色谱条件中有10%乙酸,为减少溶液配制提高效率,因此选取甲醇∶10%乙酸(3∶1)为样品提取溶媒。糕点、饮料、纯牛奶3种基质,考察中发现,牛奶经离心处理后依然存在过滤难问题,因此采用加入亚铁氰化钾溶液(质量浓度10%)2滴,对蛋白质进行物理沉淀后再微孔滤膜过滤处理[16]。
2.3 考察不同温度对纳他霉素稳定性的影响
吸取1.2项下所制备的纳他霉素和脱氢乙酸母液,配制成10 μg/mL的标液,平行6份。分别称取糕点、饮料、纯牛奶3种基质,加标量为10 μg,平行6份。将样品按1.3项下处理后(每个条件平行2 份),与 10 μg/mL 的标液分别置于 4 ℃ 冰箱、30 ℃烘箱、50 ℃烘箱中放置6 h,于测定前取出。测定结果表明3种温度影响下,纳他霉素和脱氢乙酸含量稳定,相对偏差均小于10%。且按文中考察方法对3种基质进行制备,检测结果均为阴性,如图4所示。
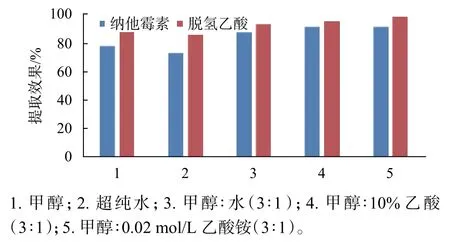
图3 不同提取溶媒的提取效果
2.4 方法线性范围及检出限
吸取1.2项下的纳他霉素和脱氢乙酸混合标准品稀释制备而成的系列标准溶液 (0.05,0.5,1,2,5,10,20 μg/mL)进行测定。以标准溶液质量浓度(X)和峰面积(Y)制作标准曲线并得出其在0.05~20 μg/mL范围的线性方程,结果见表2。

图4 3种阴性基质色谱图
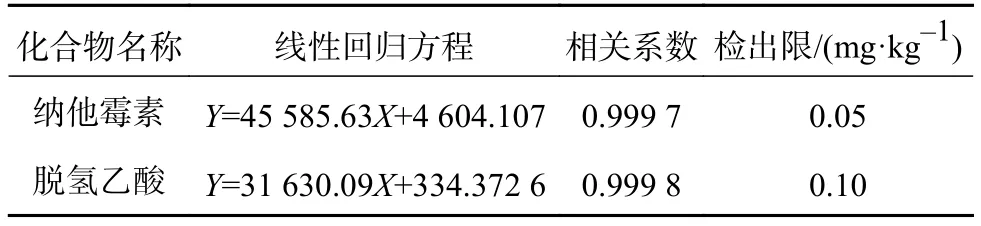
表2 纳他霉素和脱氢乙酸的回归方程、相关系数
再分别以3种基质(糕点、饮料、牛奶),逐级稀释混合标准溶液进行测定,通过3倍信噪比,得出纳他霉素和脱氢乙酸的检出限分别0.05 mg/kg和0.10 mg/kg。
2.5 考察纳他霉素和脱氢乙酸的稳定性
称取以糕点基质为代表的阴性样品,平行2份,加标量为 10 μg 按 1.3 项下制备,进样体积 10 μL,分别在不同时间进行测定,结果见表3,结果符合规定,说明纳他霉素和脱氢乙酸在60 h内能保持稳定。

表3 纳他霉素和脱氢乙酸稳定性试验结果(n=2)
2.6 方法回收率、重复性及精密度
在3种基质(糕点、饮料、牛奶)样品中分别添加脱氢乙酸与纳他霉素在 5,10,50 mg/kg 3 个水平进行加标回收试验,每个水平设置6个平行样,每种基质设置2个空白样,并计算其加标回收率(扣除空白均值),相对偏差(RSD)均小于10%,结果如表4所示。
以糕点为阴性基质代表,平行6份,加标量为10 μg,按1.3项下制备,测定其回收率结果均在90%~100%间,相对偏差(RSD)均小于10%;再以其中一份,平行测定6次,相对偏差(RSD)小于2%,符合相关规定。说明方法有较好的重复性和精密度。
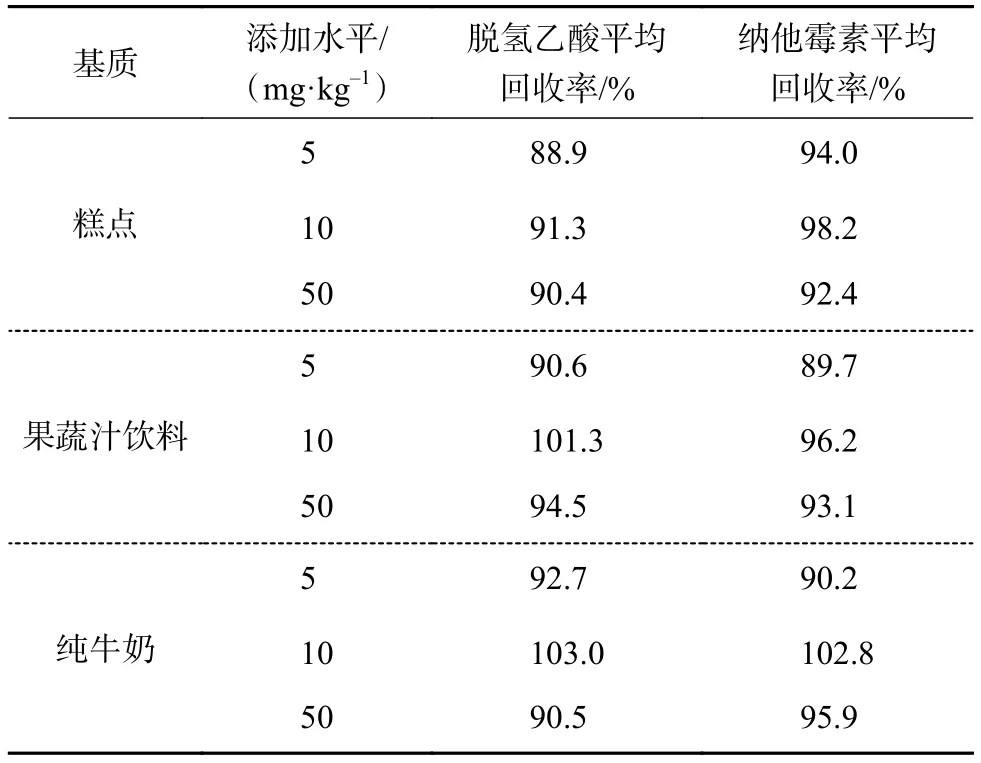
表4 4种基质中纳他霉素和脱氢乙酸的加标回收率(n=6)
3 结束语
本研究选取3种常见食品基质,采用高效液相色谱法建立了同时测定其中纳他霉素与脱氢乙酸的检验方法。该方法与此两种防腐剂国家标准相比,前处理提取方法和流动相均采用甲醇与10%乙酸溶液,操作简便且有良好的线性、回收率和相对标准偏差,缩减了试液配制种类,进一步提高检验效率。且对纳他霉素和脱氢乙酸在不同制备温度环境下的稳定性进行考察,结果稳定;对二者配制浓度为10 μg/mL标液的稳定性进行了60 h内的考察,结果稳定,对食品中纳他霉素和脱氢乙酸同时测定有一定参考意义。但该实验选取的食品基质种类有限,且除此二者外,食品常用多种防腐剂的同时测定,还有待进一步研究。
