黑果枸杞抗氧化能力评价及比较研究
2019-12-14尹民强吴金龙王天琦余琼卫马兆成
尹民强,吴金龙,王天琦,余琼卫,马兆成*
(1.华中农业大学园艺林学学院,园艺植物生物学教育部重点实验室,湖北武汉 430070;2.中国农业科学院郑州果树研究所,河南郑州 450004;3.武汉大学化学与分子科学学院,生物医学分析化学教育部重点实验室,湖北武汉 430072)
氧化损伤是导致衰老、炎症、肿瘤、老年痴呆、糖尿病、免疫性疾病及心脑血管疾病的重要原因。目前,多种人工合成抗氧化剂和天然抗氧化剂已被用于抗氧化研究中[1-4]。其中,黑果枸杞(Lycium ruthenicumMurr.)、宁夏红枸杞(Lycium barbarumL.)、蓝莓(Vaccinium Spp)、黑醋栗(Ribes nigrumL.)、黑葡萄(Vitis viniferaL.)及桑葚(Morus albaL.)由于自身含有丰富的多糖、维生素、花青素、类黄酮等多种抗氧化活性物质[5-8],有很高的保健及药用价值多用作天然抗氧化剂[9-13]。目前,已有大量对上述物质单一品种的抗氧化活性评价研究,但多个品种的抗氧化活性系统评价及比较的研究较为鲜见。鉴于此,本研究以青海黑果枸杞为试验对象,选择宁夏黑果枸杞、宁夏红枸杞、黑醋栗干、吐鲁番黑加仑葡萄干、蓝莓干及桑葚干为对照,对它们的抗氧化能力进行了系统评价及比较分析。
1 材料和方法
1.1 材料
1.1.1 试验材料
本试验选择了市场上7 种不同的干果材料,分别是黑果枸杞1(青海)、黑果枸杞2(宁夏)、宁夏红枸杞(银川)、桑葚干(山东)、黑醋栗干果(黑龙江)、吐鲁番黑加仑葡萄干(新疆)、野生蓝莓果(黑龙江)若干。
1.1.2 试剂及仪器
BCA 蛋白质浓度测定试剂盒,PBS 溶液,生理盐水,ASPEN 公司;羟自由基测试试剂盒,总抗氧化能力(TAOC)测试盒(ABTS 法),总抗氧化能力(T-AOC)测试盒(FRAP 法),抑制与产生超氧阴离子自由基测定试剂盒,南京建成生物工程研究所;DR-200Bs 酶标仪,Diatek 公司;TGL-16c 台式离心机,上海安亭科学仪器厂;TGL-16冷冻离心机,湖南湘仪实验室仪器;IMS-20 制冰机,常熟市雪科电器有限公司;HH-W-600 水浴锅,金坛市江南仪器厂;FD-1A-50 冷冻干燥机,北京博医康仪器有限公司;分光光度计、比色皿等。
1.2 方法
1.2.1 样品处理
每个样品准确称取2 g,分别加入8 mL 的PBS,冰水浴条件下机械匀浆,以充分破碎细胞并释放其中的抗氧化物,4 ℃、12 000 rpm/min 离心5 min,取上清液测定,用完置于-80 ℃冰箱备用。
1.2.2 样品中蛋白质浓度测定
按照BCA 蛋白质浓度测定试剂盒方法,使用BCA蛋白质浓度测定试剂盒对样品中蛋白浓度进行测定。配制工作液:根据蛋白标准品和样品数量,按5 mL BCA 试剂A 加0.1 mL BCA 试剂B(50:1)配制适量BCA 工作液,充分混匀,并按照表1 将标准品稀释至0.025~2 mg/mL。将25 μL 标准品和每种样本的6 个重复分别加入96 孔板微孔中,在各孔中再加入200 μL BCA 工作液,充分混匀,37 ℃孵育30 min。冷却至室温,用酶标仪测定A562,根据标准曲线计算出蛋白质浓度。

表1 蛋白质标准样品稀释方法Table 1 Dilution method of protein standard sample
1.2.3 清除抑制羟自由基能力测定
使用羟自由基测试试剂盒对各个样品的抑制羟自由基能力进行测定。取4 个5 mL 离心管,记为标准空白管、标准管、对照管和测定管,配置4 种溶液。配置方法如下,标准空白管:0.4 mL 蒸馏水;标准管:0.2 mL 蒸馏水+0.2 mL、0.03% H2O2,对照管:0.2 mL 蒸馏水+0.2 mL 底物应用液;测定管:0.2 mL 样本溶液+0.2 mL 底物应用液。然后在所有管中加入0.4 mL 试剂3 应用液,混匀,37 ℃准确计时1 min(要求加完试剂3 就开始计时,每次一管),立即加入2 mL 显色剂终止反应。混匀,室温放置20 min 后,在1 cm 光径、550 nm 条件下,使用蒸馏水调零,然后测定各管吸光度(OD值)。清除自由基能力计算公式见式(1)。

式中,标准品浓度8.824 mmol/L,待测样本蛋白浓度mgprot/mL,取样量0.1 mL
1.2.4 总抗氧化能力测定
分别使用总抗氧化能力(T-AOC)测试盒(ABTS 法)和总抗氧化能力(T-AOC)测试盒(FRAP 法)对不同样品的总抗氧能力进行测定。
ABTS 法:首先每种样品重新准确称取1 g,按质量:体积=1:10(g:mL) 的比例,分别加入10 mL 的生理盐水,冰水浴条件下机械匀浆,以充分破碎细胞并释放其中的抗氧化物,4 ℃、12 000 rpm/min 离心5 min,取上清液测定。然后分别在空白孔、标准孔和测试孔中加入10 μL蒸馏水、10 μL 不同浓度的MTrolox 溶液(标准品Trolox溶液用蒸馏水稀释成0.1、0.2、0.4、0.8、1.0 mmol/L 浓度制作标准曲线)和10 μL 待测样品溶液。接着加入20 μL过氧化物酶与检测缓冲液混合液(过氧化物酶与检测缓冲液按1:9 的比例配制,现用现配)和170 μL ABTS 工作液(按检测缓冲液:ABTS 溶液:过氧化物应用液=76:5:4 的比例配制)。最后室温反应6 min,在波长405 nm 下使用酶标仪读取各孔OD值。并以标准品OD值为横坐标,各OD值对应的标准品浓度为纵坐标制作标准曲线。
在采用Trolox 作为标准品进行总抗氧化能力检测时,样品的抗氧化能力可以用Trolox-Equivalent Anyioxidant Capacity(TEAC)来表示。提取后的溶液与某个摩尔浓度Trolox 的抑制率相同,计算时用该浓度下Trolox 的摩尔浓度另外除以提取物的蛋白浓度,最后以mmol/g 来表示。
FRAP 法:使用1.2.1 的样品。首先配制不同浓度的标准品溶液:称取27.8 mg 本试剂盒提供的FeSO4-7H2O,溶解并定容到1 mL,此时浓度为100 mmol/L,取适量100 mmol/L 的FeSO4-7H2O 溶液用蒸馏水将其稀释到0.15、0.3、0.6、0.9、1.2、1.5 mmol/L。接着分别在空白孔、标准孔及测定孔(每种样品6 个重复)中加入5 μL 蒸馏水、5 μL 不同浓度的标准品溶液、5 μL 样品溶液,最后都加入180 μL FRAP 工作液(试剂盒中将试剂1、2、3 以10:1:1 混匀充分,避光37 ℃孵育,现用现配),37 ℃孵育3~5 min,使用酶标仪读取各孔在波长593 nm 下的OD值。并以标准品OD值为横坐标,各OD值对应的标准品浓度为纵坐标制成标准曲线。
总抗氧化能力用FeSO4标准溶液的浓度来表示,如干果匀浆测定的OD值与3 mmol/L FeSO4的OD值相同,干果匀浆的蛋白浓度是1 mgprot/mL,干果匀浆的总抗氧化能力为3 (mmol/L)/(1 mg/mL),即3 (mmol/L)/gprot。
1.2.5 抑制超氧阴离子能力测定
使用抑制与产生超氧阴离子自由基测定试剂盒(比色法)对样品抑制与产生超氧阴离子自由基能力进行测定。首先在对照管、标准管和测定管(每种样品6 个重复)分别都加入1 mL 的试剂1,0.1 mL 的试剂2、试剂3 及试剂4。接下来在对照管中加入0.05 mL 蒸馏水,在标准管中加入0.05 mL、0.15 mg/mL 的VC 标准品,并在每支样品管中加入0.05 mL 的样品。用旋涡混匀器充分混匀,置于37 ℃恒温水浴40 min,最后在每支管中加入2 mL显色剂,混匀,10 min 后倒入1 cm 光径比色杯中,蒸馏水调零,波长550 mm 处比色。计算公式见式(2)。

式中,标准品浓度0.15 mg/mL,待测样本蛋白浓度gpro/L。
1.2.6 黑果枸杞提取成分稳定性考察
称取黑果枸杞17 g 于小烧杯中,45 ℃下置于真空干燥箱中干燥72 h,然后置于研钵中,加入液氮磨碎成粉末,-20 ℃避光保存。
准确称取50 mg 黑枸杞粉末于1.5 mL 离心管中,以1:15 的液料比加入750 μL、2%甲酸甲醇(即体积比甲酸:甲醇=2:98),室温下避光浸提24 h。8 000 r/min 离心10 min,取上清液进入高效液相色谱(HPLC)检测。
液相色谱条件:色谱柱为Pntulips SBP-C18(4.6 mm×250 mm<i.d.>,5 μm)。流动相A 为甲醇,B 为含0.5%甲酸水溶液。梯度淋洗程序,0~3 min:80%~70% B;3~13 min:70%~60% B;13~25 min:60%~50% B;25~35 min:50%B;35~40 min:50%~80%B;40~60 min:50%~80%B。流速为0.8 mL/min,柱温30 ℃,检测波长为525 nm,进样量为10 μL。
1.3 数据处理
使用Excel 2016 和Numbers(Apple)统计及处理数据,使用Graphpad Prism 7.0(GraPhpad Software)作图。然后使用SPSS 25(IBM)进行显著性差异分析。
2 结果与分析
2.1 不同干果羟自由基清除能力的对比
羟自由基氧化性极强,是造成组织脂质过氧化、核酸断裂和蛋白分解的主要原因,因此羟自由基的清除能力是衡量一种物质抗氧化活性的重要指标[3,4]。表2 显示了不同品种干果中的蛋白浓度和清除自由基能力,由表可以看出,试验用各种干果均有不同的羟自由基清除能力,其中两种黑果枸杞和野生蓝莓果的羟自由基清除能力都达到了1.45 U/mgprot 以上,黑果枸杞1 的清除能力尤为突出,是所有测试品种中最高的,达到(1.620±0.114)U/mgprot。而同一属的宁夏红枸杞的羟自由基清除能力最弱。
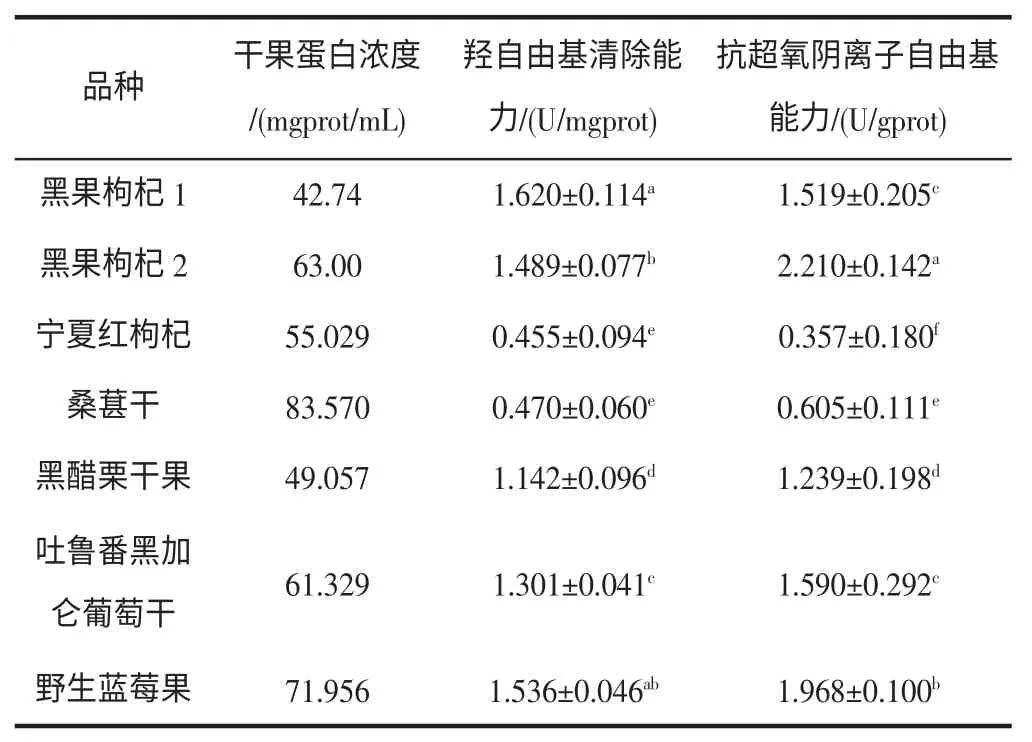
表2 不同品种干果中的蛋白浓度和清除自由基能力Table 2 Protein concentration and free radical scavenging ability of different dried fruit
2.2 不同干果的抗超氧阴离子自由基能力对比
超氧阴离子和羟自由基一样,都具有较高的化学反应活性,是造成氧胁迫的重要原因[5]。本研究对7 种干果的抗超氧阴离子自由基的能力进行了评价(见表2),由表可知,黑果枸杞2 的抗超氧阴离子能力最强,达到了(2.210±0.142) U/gprot,其次是野生蓝莓果,达到了(1.968±0.100) U/gprot,然后是吐鲁番黑加仑葡萄干、黑果枸杞1、黑醋栗干果和桑葚干,最弱的是宁夏红枸杞。
2.3 不同干果的总抗氧化能力评价
通过ABTS 法和FRAP 法测定7 种干果的总抗氧化能力,结果如图1 所示。其中ABTS 法测得的总抗氧化能力从高到低依次为黑果枸杞1>黑醋栗干果>吐鲁番黑加仑葡萄干>黑果枸杞2>野生蓝莓果>宁夏红枸杞>桑葚干。而使用FRAP 法测得的总抗氧化能力与之有所不同,这7 种干果对Fe3+的还原能力依次是黑果枸杞1>吐鲁番黑加仑葡萄干>黑果枸杞2>野生蓝莓果>黑醋栗干果>宁夏红枸杞>桑葚干。从以上结果不难看出,黑果枸杞1 的总抗氧化能力在7 种干果中是最强的,而宁夏红枸杞和桑葚干是最弱的。
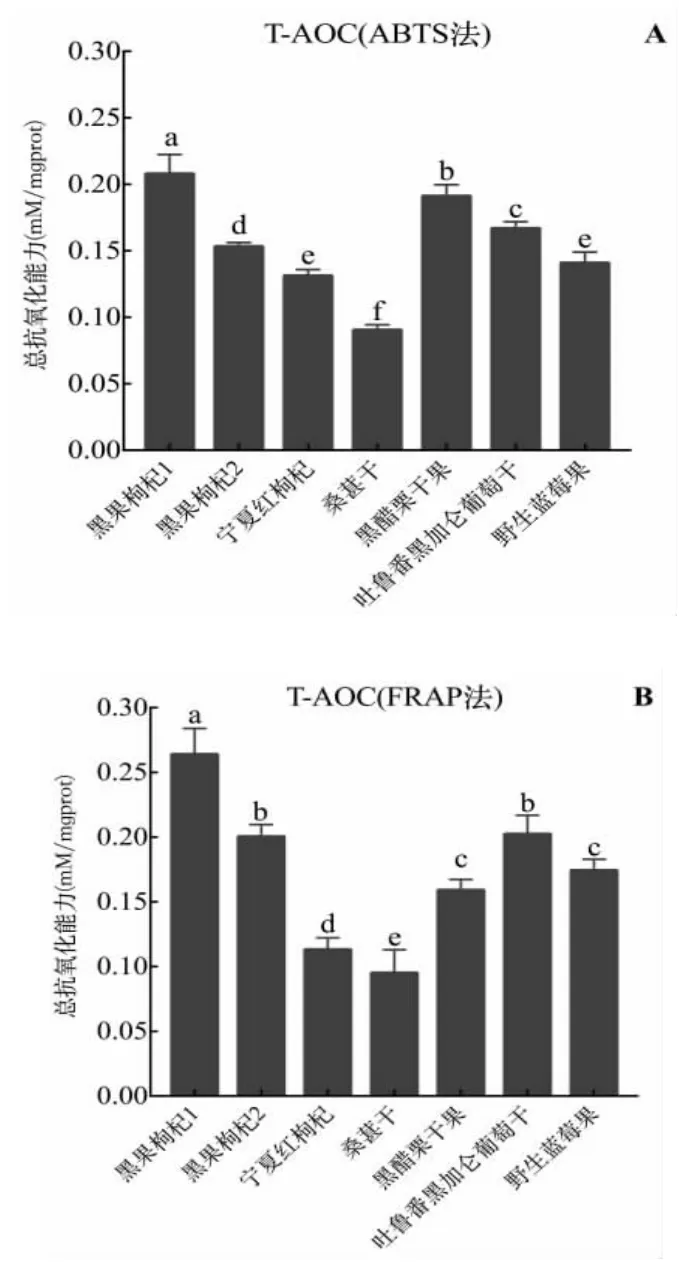
图1 不同干果的总抗氧化能力Fig.1 Total antioxidant capacity of dried fruits
2.4 黑枸杞提取成分稳定性测定
基于黑果枸杞1 的总抗氧化能力在7 种干果中最强,本文继续分析了其提取溶液组成成分的色谱指纹图谱,考察其稳定性。以2%甲酸甲醇(即体积比甲酸:甲醇=2:98)为提取溶剂,将样品分别放置0、2、4、6、8、10 h 后通过HPLC 法检测黑枸杞提取液,得到黑枸杞的指纹图谱,其稳定性结果如图2 所示。由图中可知,黑枸杞的指纹图谱没有明显变化,这说明黑枸杞提取物比较稳定。
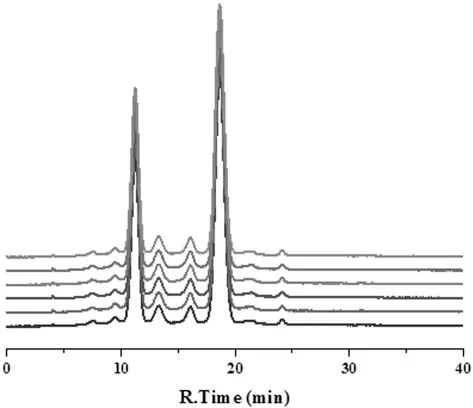
图2 黑枸杞指纹图谱稳定性Fig.2 Fingerprint stability of Lycium ruthenicum Murr
3 结论
本研究测定了7 种干果羟自由基清除能力、抗超氧阴离子自由基能力及总抗氧化能力,结果发现,7 种干果都有良好的抗氧化活性,但差异较大。其中青海黑果枸杞对ABTS 自由基和羟自由基的清除能力最强,而对超氧阴离子的清除能力不及宁夏黑果枸杞、野生蓝莓果和吐鲁番黑加仑葡萄干。在供试的7 种干果中,宁夏黑果枸杞清除超氧阴离子能力最强,但是清除羟自由基和ABTS 自由基的能力不如青海黑果枸杞。
试验还发现不同方法测定所得的总抗氧化能力是不同的。在ABTS 测试中,总抗氧化能力为黑醋栗干果>吐鲁番黑加仑葡萄干>宁夏黑果枸杞>野生蓝莓果。但在FRAP 测试中,总抗氧化活性能力对比则为吐鲁番黑加仑葡萄干>宁夏黑果枸杞>野生蓝莓果>黑醋栗干果。两者差异明显,这说明不同的测定方法对总抗氧化能力的结果有较大影响。可见,为了更好地测定和评价抗氧化能力,建立一套完整的评价体系是必不可少的。
综合4 种抗氧化能力的测定结果,可以得出,青海黑果枸杞在抑制羟自由基能力和总抗氧化能力方面都是最强的,说明青海黑果枸杞的抗氧化能力相对于其他干果来说十分突出,这可能是由于黑果枸杞中含有大量的花色苷,具有很高的药用开发价值[14]。相反,宁夏红枸杞和桑葚干是7 种干果中抗氧化能力最弱的。
