CDK4/6抑制剂治疗三阴性乳腺癌的研究进展
2019-12-13朱秀之王中华
朱秀之,陈 力,纪 磊,高 雨,王中华
复旦大学附属肿瘤医院乳腺外科,上海市乳腺肿瘤重点实验室,复旦大学上海医学院肿瘤学系,上海 200032
三阴性乳腺癌(triple-negative breast cancer,TNBC)是一类雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)均阴性的乳腺癌亚型。目前TNBC缺乏特异性的治疗靶点,相较于其他亚型,其远处复发风险较高,预后较差[1-2]。国内外针对TNBC基因表达谱差异已鉴定出不同的亚群[3-4]。在中国,Liu等[5]采用人转录组芯片技术,将TNBC分为免疫调节亚型(immunomodulatory subtype,IM)、腔内雄激素受体亚型(luminal androgen receptor subtype,LAR)、间充质样亚型(mesenchymal-like subtype,MES)和基底样及免疫抑制亚型(basal-like and immune suppressed subtype,BLIS)4个分型。分子谱研究揭示了TNBC的分子异质性,强调寻找靶向治疗生物标志物的重要性。
哺乳动物中细胞周期分G1、S、G2、M期共4期。细胞周期蛋白和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)在细胞周期进程中发挥重要作用。其中,CDK4/6活化调控G1期到S期的转变[6]。CDK作为细胞周期调控机制的核心部分,是各种恶性肿瘤在发生、发展过程中所必需的,以其为作用靶点的CDK抑制剂是近年来研究抗肿瘤药物的热点。
靶向细胞周期治疗的CDK4/6抑制剂对ER阳性的晚期乳腺癌患者疗效显著[7],有望为TNBC患者提供新的治疗方向。但是由于缺乏统一的靶向患者筛选标准和疗效评价因子,迄今为止,CDK4/6抑制剂在TNBC患者中的疗效并不确切。本文总结TNBC中CDK4/6抑制剂的作用机制及可能相关的联系通路,在基础实验水平和临床试验水平,对药物联合治疗及疗效评价分子进行综述,旨在探讨CDK4/6抑制剂在TNBC治疗中的应用前景及优化手段。
1 CDK4/6抑制剂
1.1 CDK4/6在细胞周期调节中的信号通路
细胞有丝分裂周期是一个高度协调的过程,关键取决于细胞周期检查点控制[8]。CDK4/6是丝氨酸/苏氨酸蛋白激酶,调控着G1期关键检查点,在乳腺癌细胞中磷酸化结合相应的细胞周期蛋白,形成的cyclin D-CDK4/6复合体介导视网膜母细胞瘤(retinoblastoma,Rb)蛋白磷酸化,引发Rb蛋白结构改变,继而释放转录因子E2F。E2F结合于DNA并促进G1期到S期进程的关键基因的转录和增殖蛋白的合成释放,启动DNA复制[9]。
Cyclin D-CDK4/6-INK4-Rb-E2F信号通路受多方面联合调控。根据细胞类型的不同,cyclin D可以是cyclin D1、D2或D3。Cyclin D的正确合成和定位影响CDK4/6的活性[10]。此外,CDK抑制因子2(CDK inhibitor 2,CDKN2)基因家族(如CDKN2A、CDKN2B)编码产生CDK4/6抑制因子INK4家族(如p16INK4a、p15INK4b、p18INK4c、p19INK4d),竞争性结合CDK并抑制cyclin D-CDK4/6复合物的形成[11]。Rb蛋白被CDK4/6在多个位点磷酸化,可联合其他Rb家族成员p107和p130共同抑制细胞在G1早期的扩增。该通路持续激活的原因主要包括CDK4/6的富集、cyclin D1编码基因CCND1的扩增及p16INK4A基因的缺失等。
1.2 CDK4/6抑制剂在乳腺癌中的应用
目前数据显示,乳腺癌中cyclin D-CDK4/6-INK4-Rb-E2F轴异常调节广泛存在,并且可能是乳腺癌发生的早期步骤[12],包括cyclin D1的富集、抑制剂p16的缺失、Rb蛋白磷酸化水平的提高等。有研究显示,在激素受体(hormone receptor,HR)阳性的乳腺癌中,29%~58%存在cyclin D1过表达或扩增,14%~25%存在CDK4过表达;在BLIS中发现CDKN2A的高表达和细胞周期蛋白E1的富集。另外,Rb的低表达、丢失和突变也更常见于BLIS[13]。在乳腺癌、非小细胞肺癌等[14]多种恶性肿瘤中均观察到了p16INK4A基因的缺失以及CCND1、CDK4、CDK6基因的扩增。此外,CDK4/6抑制剂还可能会激发免疫及阻断TNBC细胞的远处转移(肝、肺)[15]。
第一代CDK抑制剂flavopiridol(alvociclib)由于缺乏特异性,呈现出大剂量限制性毒性。对于进展性TNBC患者的UCN-01Ⅱ期临床试验,疗效依旧令人失望而未能成功应用于临床[16]。新一代的CDK4/6抑制剂经过改造以后,具有一定的特异性和可以耐受的不良反应,典型代表有palbociclib、ribociclib、abemaciclib等,目前多种CDK4/6抑制剂临床试验正在进行。2015年2月美国食品药品管理局(Food and Drug Administration,FDA)根据PALOMA1[17]Ⅱ期研究批准palbociclib联合来曲唑一线治疗绝经后HR+/HER2-的晚期乳腺癌;此后又根据PALOMA3研究[18]批准palbociclib联合氟维司群治疗绝经后既往内分泌治疗失败的ER+/HER2-晚期乳腺癌。Abemaciclib于2017年9月正式获得美国FDA批准上市[19]。
2 CDK4/6抑制剂治疗TNBC的基础研究
TNBC作为一种异质性的疾病,其内在丰富的生物学特性决定了对CDK4/6抑制剂的不同疗效。研究发现部分TNBC细胞株对palbociclib表现出一定程度的敏感性,甚至表现为明显的生长抑制,更有研究表明palbociclib疗效与ER或HER2的状态无直接相关[20]。
2.1 CDK4/6抑制剂对TNBC的选择性作用
以往研究发现,Rb基因高表达的TNBC细胞株对CDK4/6抑制剂palbociclib敏感并阻滞于G1期,Rb基因突变或低表达的TNBC细胞株则观察不到细胞周期阻滞现象[21]。Liu等[22]在TNBC研究中也证明在palbociclib治疗中,Rb与雄激素受体(androgen receptor,AR)表达状态都是不可或缺的。随后的临床回顾性研究也发现TNBC患者AR/Rb双强表达与总生存率显著相关,提出AR/Rb双阳性的TNBC患者适合palbociclib治疗。然而现有研究缺乏完整的临床数据来支持Rb和AR之间可能的相关性,关于AR和Rb在TNBC中的具体作用机制还不清楚,需要更深入研究来探讨两者的生物学联系。
Asghar等[23]用palbociclib作用于12个Rb基因野生型的TNBC细胞系,发现TNBC中LAR对CDK4/6抑制剂表现出高度敏感性。Palbociclib敏感的LAR癌细胞通常在有丝分裂后进入CDK2低表达的静止状态,需要CDK4/6磷酸化Rb才可以通过细胞周期限制点[6];相反,部分基底样TNBC细胞经常进入CDK2高表达的增殖状态,不需要CDK4/6绕过该限制点,分裂时间更短,因此对palbociclib治疗具有耐药性。以往研究已经证明细胞周期蛋白E在促进CDK2高表达的同时,结合并激活CDK2,形成的复合物对CDK4/6抑制剂抵抗[24],这在一定程度上解释了基底样和潜在的许多其他TNBC类型对CDK4/6抑制具有的耐药性,也表明细胞周期蛋白E在RNA或蛋白水平上的表达有可能作为乳腺癌中CDK4/6耐药的预测生物标志物。
2.2 CDK4/6抑制剂联合抗雄激素治疗TNBC
恩杂鲁胺(enzalutamide)是第二代AR拮抗剂,相较第一代,对AR亲和力更高[25],已被美国FDA批准用于治疗晚期耐去势或耐化疗前列腺癌患者[26]。除了前列腺癌,近年来的证据表明,enzalutamide对TNBC也有抗癌作用,这意味着靶向AR可能是TNBC的一种良好策略[27]。在TNBC中,palbociclib联合enzalutamide可增强AR/Rb双阳性TNBC细胞的抑制作用,诱导细胞G1期阻滞,而对其阴性的TNBC细胞抑制作用不明显[22]。
越来越多的研究发现,enzalutamide联合palbociclib可有效阻滞AR/Rb双阳性TNBC的生长,提示AR和Rb的共表达可能是palbociclib联合enzalutamide联合治疗TNBC的生物标志物,为选择CDK4/6抑制剂联合AR拮抗剂治疗提供了依据。
2.3 CDK4/6抑制剂联合PI3Ka抑制剂治疗TNBC
在LAR和间充质干细胞亚型(mesenchymal stem-like,MSL)等非基底亚型TNBC中,富含PI3K催化亚基PIK3CA基因的激活突变[28]。研究发现,PI3K抑制剂、mTOR抑制剂与palbociclib在PIK3CA突变的细胞系中都存在协同作用[23,29]。与单一治疗相比,PI3Ka和CDK4/6双重阻断对多种Rb基因野生型TNBC模型的协同效应表现在抑制TNBC细胞糖代谢[30],显著增加TNBC细胞系的凋亡、周期阻滞、肿瘤免疫原性和产生免疫原性细胞死亡。在同源TNBC小鼠模型中,PI3Ka和CDK4/6联合抑制显著增加了肿瘤浸润T淋巴细胞的活化和细胞毒性[31]。
进一步研究发现,PI3K抑制剂降低了有丝分裂后CDK2的活性,造成依赖CDK4/6活性来启动细胞周期的细胞内微环境。同时,药物抑制CDK4/6导致cyclin D1聚积并引发AKT信号上调,cyclin D1可以通过非经典途径激活CDK2[32-33]。联合抑制CDK4/6活性和PI3KAKT-mTOR轴可以防止有丝分裂上游信号上调导致的细胞反馈性增殖,为TNBC提供一种新的治疗思路,此类药物组合有可能进一步扩大对CDK4/6抑制敏感的亚型。
2.4 CDK4/6抑制剂联合免疫检查点抑制剂治疗TNBC
Goel等[34]通过乳腺癌小鼠模型研究发现,CDK4/6抑制剂在诱导肿瘤细胞周期阻滞的同时,很大程度上促进了机体抗肿瘤免疫,表现为增强肿瘤抗原的呈现、细胞毒性T细胞识别和抑制负性免疫调节的T细胞增殖。在一项最新研究中,CDK4/6抑制剂体内可通过阻止cyclin D-CDK4介导的斑点型POZ蛋白磷酸化,提高PD-L1蛋白水平,揭示细胞周期激酶调控PD-L1蛋白稳定性的新分子机制,提出CDK4/6抑制剂联合PD-1/PD-L1免疫检查点阻断在提高人类癌症疗效的潜力[35],为CDK4/6抑制剂与免疫疗法作为抗癌治疗的新组合方案提供了理论依据。进一步研究发现,联合治疗组(PI3Ka抑制剂、CDK4/6抑制剂、抗PD-1抗体、抗CTLA-4抗体)在小鼠体内诱导建立的TNBC肿瘤中,显著增加肿瘤的免疫原性和T细胞毒性,使肿瘤消退有效且持久(>1年),总生存期明显优于其他治疗组[31]。
2.5 CDK4/6抑制剂联合其他药物治疗TNBC
Foidart等[36]研究发现,在膜4型基质金属蛋白酶、表皮生长因子受体(epidermal growth factor receptor,EGFR)与Rb三者共表达的TNBC中,对CDK4/6抑制剂palbociclib与抗EGFR的erlotinib联合作用具有很强的敏感性,并提出三者生物标志物可以作为筛选CDK4/6抑制剂敏感的标志物。
现阶段,TNBC患者的主要治疗手段为DNA化疗,包含蒽环类、紫杉类和铂类药物等。Dean等[37]研究表明,在Rb高表达的TNBC中,紫杉烷类和蒽环类药物的细胞毒性作用常与CDK4/6抑制剂的细胞周期抑制作用相拮抗,阻止DNA损伤和细胞死亡诱导;在Rb突变的TNBC中,palbociclib单药无明显作用,且联合化疗药物并不改善预后[38]。CDK4/6抑制剂联合化疗在拮抗细胞毒性的同时,增加易出错的DNA修复机制,这可能有助于疾病的进展。
2.6 CDK4/6抑制剂在TNBC中的耐药机制
Cyclin D-CDK4/6-INK4-Rb-E2F信号通路功能的失调将直接影响CDK4/6抑制剂的疗效。结合CDK4/6抑制剂的作用机制和上文相关的基础实验,可以将TNBC的耐药机制归纳为:①细胞内cyclin E-CDK2的富集[23],使细胞周期绕过依赖cyclin D-CDK4/6的限制点,而出现依赖于cyclin E-CDK2的增殖分裂,TNBC富含cyclin E1,CDK4/6抑制剂单药治疗的固有耐药性已被报道[39-40],而TNBC中的LAR存在分裂后cyclin E-CDK2低浓度而对CDK4/6抑制剂敏感。②Rb基因突变,30%的TNBC表现出Rb肿瘤抑制因子的功能丧失[41],导致下游E2F转录因子释放失控而耐药,此外,Rb mRNA低转录的细胞往往对CDK4/6抑制剂较不敏感[40]。③细胞自身高表达抑制因子INK4家族,内源性抑制CDK4/6,在P16INK4a修饰后的乳腺癌模型中,palbociclib治疗对其无明显疗效[33],Rb和P16INK4a表达水平可联合预测乳腺癌患者对于CDK4/6的治疗反应。④CDK6基因的扩增及细胞内高表达CCND1,使其信号通路高度活化而难以抑制。⑤其他基因的突变,包括异常的MYC癌基因、TP53[42]、PDK1[43]、FGFR1[44]等,这些基因的变异均可导致对CDK4/6抑制剂敏感性降低。
3 CDK4/6抑制剂治疗TNBC的临床研究
CDK4/6抑制剂palbociclib(PD0332991)和ribociclib(LEE011)联合内分泌治疗在晚期ER+/HER2-乳腺癌临床试验的突出疗效,已被美国FDA批准用于治疗此类患者[10]。安全性分析结果显示[45],palbociclib试验组中性粒细胞减少、白细胞减少、贫血及乏力等不良反应发生率高。Abemaciclib常见的不良反应为消化道症状,如恶心、腹泻,另外还包括中性粒细胞减少、静脉血栓栓塞和肝损害[19]。同时,基于CDK4/6抑制剂在TNBC相关的众多基础实验中取得的重大发现,近年来CDK4/6抑制剂在TNBC的临床试验也正在进行中(表1)。
目前,CDK4/6抑制剂在TNBC的临床试验,已经完成的仅有一项(NCT01037790),共入组4例Rb阳性的TNBC患者,经palbociclib单药治疗后,其中3例疾病进展(progressive disease,PD),1例疾病稳定(stable disease,SD)[39]。在一项由Ruth O'Rega团队负责的I/Ⅱ期非随机多中心研究(NCT03090165,2017年3月2日—2019年9月)中,CDK4/6抑制剂ribociclib(LEE011)与AR抑制剂比卡鲁胺(bicalutamide)联合治疗晚期AR阳性的TNBC。邵志敏教授团队下一项Ib/Ⅱ期开放标签的综合性研究(NCT03805399,2018年7月17日—2022年6月1日),对CDK4/6抑制剂联合AR抑制剂治疗的患者,进行了更为精准的筛选,此类患者入组标准为Rb基因野生型、CCDN1扩增或CDKN2A拷贝数丢失的LAR。类似的临床试验还有,CDK4/6抑制剂trilaciclib(G1T28)治疗接受吉西他滨和卡铂化疗后转移性TNBC患者Ⅱ期研究(NCT02978716,2017年2月7日—2020年2月)以及palbociclib联合bicalutamide治疗AR阳性的转移性乳腺癌的I/Ⅱ期临床试验(NCT02605486,2015年11月11日—2020年11月)和有关TNBC的Ⅱ期临床试验(NCT03519178,2018年7月—2021年12月)。这些临床试验的药代动力学结果、PFS、ORR、OS、CBR等值得我们期待。
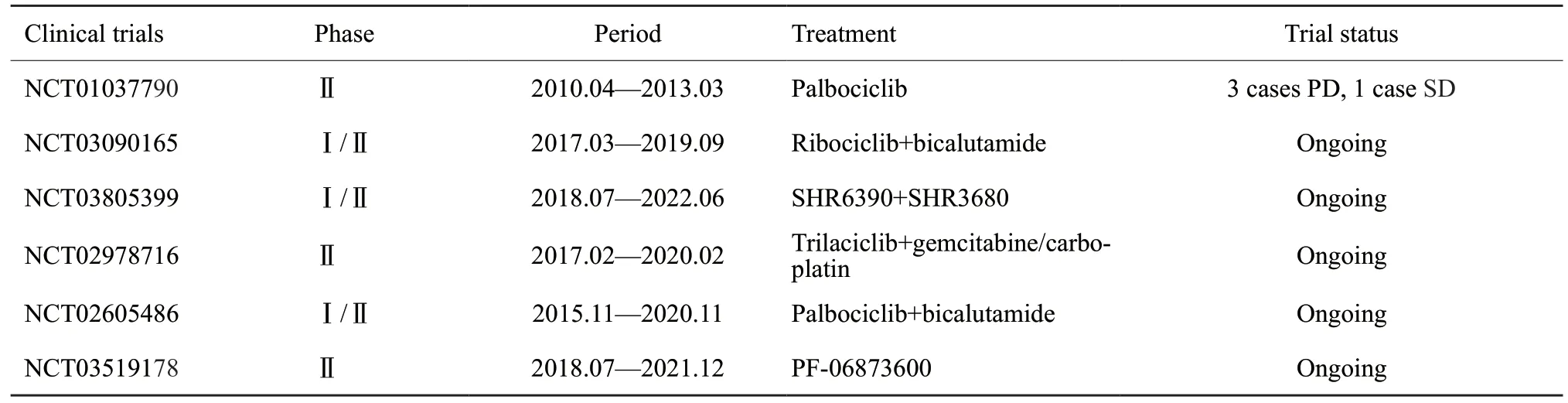
表1 CDK4/6抑制剂治疗TNBC的临床试验Tab.1 Clinical trial of CDK4/6 inhibitor in TNBC
4 总结和展望
从现有的研究来看,CDK4/6抑制剂对肿瘤细胞的抑制作用,不仅局限于细胞周期的阻滞,还包括细胞凋亡的诱导、肿瘤细胞激酶信号的改变、免疫调节的变化及众多信号转导通路的改变,这使得CDK4/6抑制剂的应用和药物配伍也不断扩大。在TNBC中,CDK4/6抑制剂单用疗效十分有限,但其联合用药在增强药物疗效的同时,也扩大了受益人群,更彰显优势[46]。在众多联合治疗方案中,CDK4/6抑制剂联合雄激素受体阻断可能成为TNBC中LAR的一种有效的选择性治疗,但仍需等待临床试验的验证。尽管目前palbociclib、ribociclib、abemaciclib这3种CDK4/6抑制剂在临床试验中疗效可观,但是现有的CDK6、CCND1、cyclin E-CDK2、INK4家族、Rb、激素受体等评估条件,除广泛认可的激素受体ER+外,与三者疗效相关的其他生物标志物尚无统一定论。因此,寻找CDK4/6抑制剂的疗效预测分子,指导合理的联合用药方案,挖掘潜在的TNBC患者,进一步实现个体精准化治疗,是未来努力的方向。
