磁共振3D-ASL技术在高级别胶质瘤靶区勾画术后残留病灶识别中的应用
2019-12-13黄立敏
黄立敏,雷 竹,张 瑜,李 勇,侯 净,许 钟,曹 辉,王 涛,杨 洁
贵州省人民医院肿瘤科,贵州 贵阳 550002
胶质瘤是一种常见的脑肿瘤之一,其中超过3/4为高级别胶质瘤(Ⅲ、Ⅳ级)(high-grade gliomas,HGG),近30年来,其发病率逐年上升[1]。HGG因其浸润性生长的特性决定了手术较难完全切除,术后需根据病理学特征及手术切除情况积极结合放疗及化疗,手术联合术后放化疗的综合治疗模式是目前HGG治疗的主流。目前国内大多数医院脑胶质瘤术后放疗使用调强放疗(intensity-modulated radiation therapy,IMRT),因其靶区适形性较好、剂量分布均匀,在治疗肿瘤的同时能更好地保护靶区周围正常组织,为提高脑胶质瘤的局部控制率做出了重要贡献。然而,准确的靶区勾画对于影像学成像技术的要求也很高,结合形态影像学及功能影像学检查准确地显示肿瘤情况,是生物靶区准确勾画必不可少的条件[2-4]。
常规MRI是颅内肿瘤的首选检查方法,其根据肿瘤的形态、信号特点及强化程度进行诊断,目前是评估脑胶质瘤患者术后残留、术后残腔、瘤床及手术通路等的主要手段。但MRI的常规检查序列及增强检查对胶质瘤术后残留及残腔的判断常常不够可靠,因肿瘤强化程度受血脑屏障破坏程度的影响,而手术均会不同程度破坏和改变血脑屏障。因此,只有灌注成像才能较真实地反映病变的微循环灌注信息、血管在肿瘤中的生长及分布情况,而常规MRI序列不能较真实地反映肿瘤组织微循环状况。动脉自旋标记成像技术(three-dimensional arterial spin labeling,3D-ASL)是一种以人体自身动脉血氢质子作为内源性示踪剂的功能磁共振检查方法,其以自体血标记为内源性对比剂,通过脉冲标记后在颅内采集衰减信息,从而清楚显示颅内灌注情况的检查技术,可通过脑血流量(cerebral blood flow,CBF)、相对脑血流量(relative cerebral blood flow,rCBF)定量地反映肿瘤内部血管血流及血管生成情况,对术后评估胶质瘤患者手术切除范围及术后残留情况具有一定价值[5-6]。本文旨在通过联合3D-ASL和常规MRI对HGG患者术后残留病灶与术后残腔进行对比研究,探讨3D-ASL在放疗靶区勾画中的精确定位价值。
1 资料和方法
1.1 临床资料
回顾性分析贵州省人民医院2015年3月—2017年5月经手术后病理学检查证实的HGG患者30例,其中Ⅲ级12例,Ⅳ级18例,男性17例,女性13例,年龄22~71岁,平均43岁。根据外科手术情况及中国中枢神经胶质瘤诊断与治疗指南(2015)[7]分为术后残留组及术后残腔组。术后残留组:①术中无法完整切除;② 术后增强范围扩大≥25%;③明显增加的T2 FLAIR非强化病灶。术后残腔组:①术中超过影像学范围的扩大切除;② 术后无明显异常强化灶或强化范围较术前缩小;③无明显增加的T2 FLAIR非强化病灶。
1.2 检查方法
采用GE Discovery MR750 3.0T扫描仪,八通道相控阵头线圈。常规行头部轴位T1WI、T2WI及矢状位T2WI序列扫描,并在增强前加扫全脑3D-ASL序列。ASL采用3D快速自旋回波连续式标记ASL,并在增强前加扫全脑3D-ASL序列。3D-ASL参数:视野(field of view,FOV)24.0 cm,层厚5 mm,重复时间(repetition time,TR)4 632.0 ms,回波时间(echo time,TE)10.5 ms,Point 512,激励次数(number of excitation,NEX)3 次,标记延迟(postlabeling delay,PLD)时间1.5 s,总扫描时间5 min。
1.3 影像后处理方法和分析
在AW4.5工作站上应用Functional软件进3D-ASL图像后处理。感兴趣区(region of interest,ROI)的放置原则:结合常规平扫和增强扫描图像,ROI放置在对应于伪彩图上实性肿瘤色彩最鲜艳的部分,软件自动得出肿瘤术后病灶内血流量(tumor blood flow,TBF)及脑血流图,至少选择3个ROI,然后取其平均值[8]。并在肿瘤镜像区域脑组织、对侧正常白质放置同样大小的ROI,得到对侧正常白质的区域血流灌注值(contralateral white matter blood flow,CBFwm),同样至少选择3个ROI,然后取其平均值。ROI的选择尽可能避开囊变、坏死、钙化、出血和大血管。为校正年龄、性别和个体所导致的平均脑血流灌注差异,计算获得标准化肿瘤血流量(normalized tumor blood flow,nTBF)=TBF/CBFwm。
1.4 治疗方案
所有病例均给予2.0 Gy/次,共30次,放疗期间替莫唑胺75 mg/m2同步放化疗加替莫唑胺150~200 mg/m2辅助化疗6个周期的标准治疗。靶区勾画采用欧洲癌症治疗研究组织(European Organisation for Research and Treatment of Cancer,EORTC)的靶区勾画原则[9]:大体肿瘤体积(gross traget volume,GTV)包括MRIT1增强区和术腔,不包括瘤周水肿区。临床靶体积(clinical target volume,CTV)为GTV外扩2 cm,对于颅骨、脑室、大脑镰、小脑幕、视器、脑干等一些天然屏障区域外扩0.5 cm。
1.5 统计学处理
2 结果
20例术后残留组胶质瘤患者(Ⅲ级4例,Ⅳ级16例),其中11例MRI平扫表现等T1、稍长T2信号,增强扫描呈环形、线样、小片状强化,强化程度为中度至明显强化;6例MRI平扫表现为稍长T1、T2信号,增强扫描呈结节样、团片状不均匀明显强化;10例胶质瘤术后残腔组患者(Ⅲ级2例,Ⅳ级8例),其中6例MRI平扫表现为等T1、稍长T2信号,其中4例增强扫描呈线样、片状强化,2例增强扫描呈明显团片状强化;4例MRI平扫表现为稍长T1、T2信号,增强扫描未见强化。
其中20例术后残留组胶质瘤患者在术后区域3D-ASL灌注图显示在低灌注的背景下部分呈高血流灌注(图1);10例胶质瘤术后残腔组患者在术后区域GE 3D-ASL灌注图显示呈低血流灌注(图2)。术后残留组TBF与nTBF均高于术后残腔组,术后残留组TBF:(85.97±17.54)mL/min,nTBF:4.19±1.58;术后残腔组TBF:(26.51±8.93)mL/min,nTBF:0.91±0.44,差异有统计学意义(P<0.01);但CBFwm差异无统计学意义(P>0.05)。
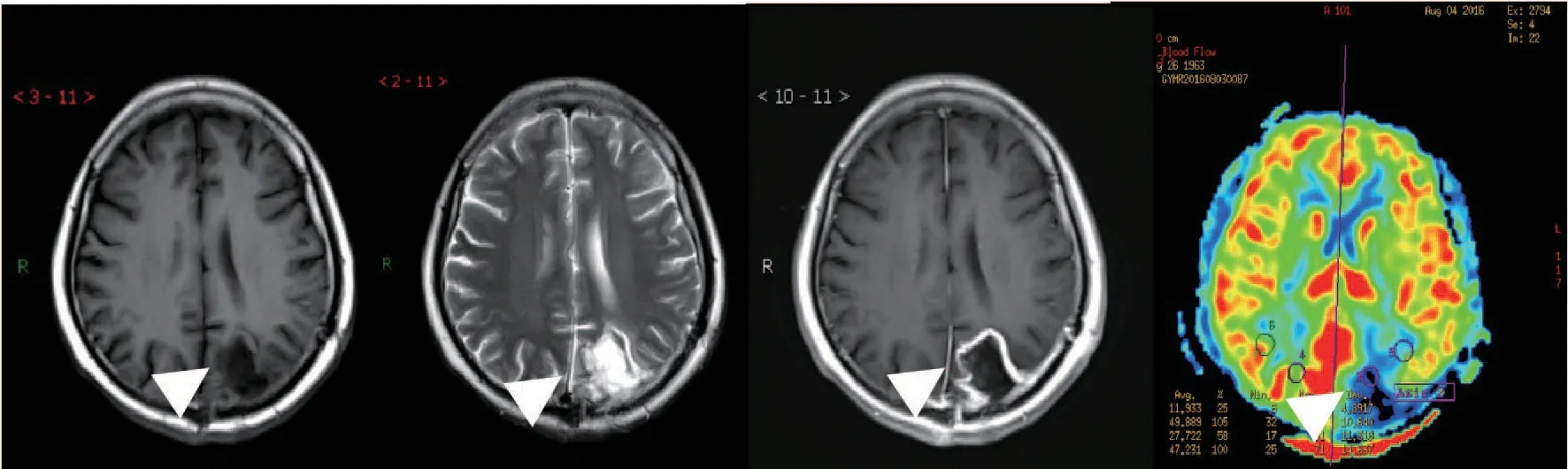
图1 女性,51岁,左侧枕顶叶(WHO Ⅳ级)术后Fig.1 Female,51 years old,left occipital lobe glioma (WHO Ⅳ) after surgical treatment
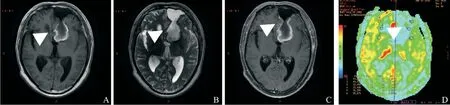
图2 男性,43岁,左侧额叶间变性星形细胞瘤(WHO Ⅲ级)Fig.2 Male,43 years old,left frontal interlobular deformed astrocytoma (WHO Ⅲ)
3 讨 论
临床工作中常把磁共振增强扫描和灌注成像混淆不清,常规增强T1WI仅反映血脑屏障有无破坏及破环后对比剂渗出至血管外间隙的程度,而只有灌注成像检查才能较真实反映病变的微循环灌注信息。肿瘤的生长依赖于新生血管的形成,临床可以通过磁共振灌注加权成像定量评估肿瘤组织的血管生成情况。获得病变组织灌注信息的影像学检查方法包括:PETCT(或MRI)、CT灌注成像、磁共振灌注成像(perfusion-weighted imaging,PWI),其中PWI成像方法包括:T1动态增强灌注成像(dynamic contrast-enhanced MRI,DCE-MRI)、动态磁敏感灌注(dynamic susceptibility contrast,DSC)成像及ASL灌注成像;DCE-MRI、DSC依赖于外源性示踪剂,需要静脉注射造影剂,存在造影剂过敏及肾毒性风险;另一种是依赖于内源性示踪剂的ASL[10]。
3D-ASL技术采用射频脉冲磁化标记循环动脉血中的氢质子,使其纵向弛豫翻转,待被标记的血液对组织灌注后,由标记像与非标记像相减得到组织的灌注信息。ASL利用内源性示踪剂,不受血脑屏障破坏的影响,可以量化地反映肿瘤内部的血流灌注情况和微血管的分布情况,从而有利于判断肿瘤的分级及手术后肿瘤切除程度等[11-12]。本研究将患者分为术中无法完整切除组及扩大切除组,根据中国中枢神经系统胶质瘤诊断与治疗指南(2015)[7]中界定的术后残留,研究显示,术后残留组TBF:(85.97±17.54)mL/min,nTBF:4.19±1.58;术后残腔组TBF:(26.51±8.93)mL/min,nTBF:0.91±0.44,差异有统计学意义(P<0.01)。从本研究ASL图可以看出胶质瘤术后残留组呈高血流灌注图,术后残腔组呈低血流灌注图表现;定量参数分析,无论是标准化前还是标准化后,术后残留组TBF与nTBF均高于术后残腔组,差异有统计学意义(P<0.01),与国内外报道一致[13]。提示3D-ASL能够根据TBF补充判断高级版胶质瘤切除程度及术后残留情况。
在CT及MRI图像上,对于HGG,部分患者术前病灶也并不都表现增强,而术后血脑屏障破坏、术后胶质增生等因素又可表现出增强,故常规T1W1增强不易区分是术后的改变还是术后的残留。基于CT及MRI勾画靶区的方法,有可能对术后残留的肿瘤组织认识不足,对靶区的设计缺乏全面的考虑,使部分肿瘤细胞处于低剂量照射范围内;根据治疗指南术后MRI复查应选择T1增强加上多种功能成像的多模态MRI检查方法,其中灌注检查是具有重要鉴别参考价值的检查方法;而3D-ASL技术对于HGG内部血流灌注的观察、术后病灶区域血流灌注差异的观察及检测评估均是可行的。目前关于是否需要对HGG术后残留的病灶组织进行局部加量等问题各肿瘤中心均有不同观点,Iuchi等[14]对25例恶性胶质瘤患者采用调强同期推量单纯放疗,单次分割剂量1.8 Gy,同时给予野中野同期推量2.5 Gy/次,总剂量最大达到了68.0 Gy,结果显示,1、2年生存率分别为71.4%、53.6%。钟良志等[15]对37例HGG行低分割同步推量至计划大体肿瘤靶体积(plan gross tumor target volume,PGTV):2.37 Gy/次,结果显示,1、2、3年生存率分别为81.1%、77.4%、62.1%。因此,能否通过适当提高放疗剂量及分割模式进一步改善HGG患者的疗效,值得进一步探索。提示3D-ASL可以为进一步探索提高术后残留放疗剂量的相关临床研究提供技术支持。
3D-ASL技术操作简单易行、安全无创、图像处理简便、无需注射外源造影剂,避免了加重诱发肾源性疾病的风险。其检查成本低,可用作胶质瘤术前术后评估的常用诊断手段。磁共振3D-ASL技术联合对比增强扫描可以半定量测定HGG灌注情况,对于HGG患者的术后残留有定位及定性诊断的价值,对于精确勾画放疗靶区具有实用价值。
