含有噻吩基团铕配合物Eu(DBM)3 (PMS)的制备及其作为汞离子传感器的性质研究
2019-12-13刘玉静张馨月赵莹莹田爱香
刘玉静,张馨月,赵莹莹,田爱香
(渤海大学 化学化工学院, 辽宁 锦州 121013)
0 引言
稀土配合物因其优良的发光特性,良好的色纯度,无论在光致发光,电致发光以及上转换发光材料等方面都具有广泛的应用价值〔1-5〕.在稀土配合物发光领域,为了获得发光性能优异的材料,设计并合成具有不同载流子基团的有机配体,使得能量在配体与稀土离子之间得到有效传递,是稀土化学研究者一直关注的热点〔6-8〕.主要集中在电子传输基团如噁二唑等的引入,另一方面是空穴传输基团的引入如三苯胺和咔唑等的引入〔9〕.基于分子设计思想,将不同的载流子引入稀土配合物发光体系,改善发光性能.稀土配合物的合成方法主要是水溶液和有机溶剂的常规合成方法等,此类方法的优点是方便、快捷、靶向合成、可控.
汞是一种剧毒性的重金属化学污染物,由于其性质稳定、生物富集性等,在全世界范围内都是重要环境污染物之一.对汞离子的检测方法主要有两种分别是冷原子吸收光谱法和二硫腙比色法.但其检测的速度、成本以及操作的专业性等问题,限制了其一般化大规模的使用.因此,急需一种快速、准确、低成本并能选择性分析检测汞离子的简易方法.而能满足这一需求的化学检测方法,只有化学传感器, 近年基于化学传感器的汞离子检测手段,能实现快速可视简便的试剂仍是少数〔10〕.
我们基于分子裁剪的思想,将空穴传输基团噻吩引入双齿有机配体中,并与稀土配位,成功制备基于噻吩基团的稀土铕配合物,将含有噻吩基团引入稀土发光体系,首先是期望改善稀土铕的发光性能,其次是通过硫原子的引入,增加铕配合物的功能性,将硫原子作为整个铕配合物发光的阀门,研究其对剧毒重金属汞离子的光化学传感性能〔11〕.
1 实验部分
1.1 试剂和仪器
实验所需化学试剂均为试剂公司购买,不需纯化.红外光谱利用Magna FT-IR 560光谱仪测试(KBr压片).Perkin-Elmer 240 C分析仪对C, H和N三种元素进行分析.
依照文献〔12〕,将2.1 g(10 mmol)1,10-邻菲罗啉-5,6-二酮、2.86 g(10.5 mmol)2-甲酰基噻吩加入到15.4 g醋酸铵和30 mL冰醋酸混合液中.在90 ℃条件下回流4 h后自然冷却,缓慢倒入冰水.用二氯甲烷萃取后, 旋蒸得到黄色固体.过硅胶柱(石油醚:乙酸乙酯=1:1),得白色固体H-PMS.产率:40%.1H NMR (CDCl3):δ10.04 (t,1H),8.44 (m,1H),8.06-7.90(d,6H),7.14(m,1H).
将4.63 g(0.01 mol) H-PMS与0.288 g NaH放入15 mL无水DMF(N,N-二甲基甲酰胺)中,及过量的正溴戊烷,在120 ℃下回流反应24 h.冷却后将反应物倒入冰水中,将得到的橙色固体用无水乙醇重结晶后得到浅黄色固体,过硅胶柱(石油醚:乙酸乙酯=1:1),得白色固体,即配体PMS.产率:65%.1H NMR (CDCl3): δ 10.04 (t, 1H), 8.44 (m, 1H), 8.06-7.90(d, 6H), 7.14 (m, 1H), 3.73 (m, 2H), 1.22-1.83 (m, 9H).
称取二苯甲酰甲烷3 mmol(0.66 g),用少量无水乙醇溶解.搅拌下加入3 mmol的NaOH,溶液变为黄色,然后滴入1.0 mmol EuCl3·6H2O,出现大量白色混浊,将0.06 g(0.3 mmol) PMS加入到装有20 mL二氯甲烷的烧瓶中,反应2 h后,向溶液中加入石油醚,得黄色固体Eu(DBM)3(PMS) 产率:40%.IR (KBr disc, 25 ℃):3059,3020,2960,2928,1557,1524,1480(C=O,chelated to Eu3+),610,512,411(O-Eu-O),1023(C-O),1601(C=N). C67H53EuN4O6S:C,67.39;H,4.47;N,4.69%.Found:C,67.21;H,4.45;N,4.66%.
2 结果与讨论
2.1 化合物Eu(DBM)3(PMS)和配体PMS的光物理性质
化合物Eu(DBM)3(PMS)和配体PMS的紫外光谱如图1(a)所示,在260-300 nm之间有一个宽的谱带,可以指认为π-π*跃迁〔13〕.且配体PMS在二氯甲烷溶液中的荧光光谱如图1(b)所示.化合物Eu(DBM)3(PMS)的紫外光谱如图2(a)所示,在260-300 nm的谱带可以归属为配体(DBM)-中心π-π*跃迁.化合物Eu(DBM)3(PMS)在二氯甲烷溶液中的荧光光谱如图2(b)所示,在580, 592, 613, 652, 703 nm具有发射峰,可以分别归属为5D0→7F0,5D0→7F1,5D0→7F2,5D0→7F3,5D0→7F4的跃迁.

图1 配体PMS(a)紫外光谱(b)发射光普

图2 配合物(a)紫外光谱(b)发射光谱
2.2 Eu(DBM)3PMS对汞离子荧光猝灭特性
Eu(DBM)3PMS的荧光强度的增强或减弱特性作为判断离子的种类以及对汞离子的检测的依据.具体实验步骤如下:
1)测试液的配制
将120 mg的化合物1配置成浓度为0.122的溶液,静置5 min后待用.溶液中如不加其他金属离子即为空白荧光.
2)荧光光谱特性测试
分别向测试液加入汞离子以及其他不同金属离子后的荧光光谱图谱.如图3(a)所示,向化合物1的水溶液加入其他不同金属离子后,只有汞离子具有使化合物荧光强度明显减弱的效果;而随着汞离子浓度的变大,化合物1的荧光强度逐渐减弱,如图3(b)所示.
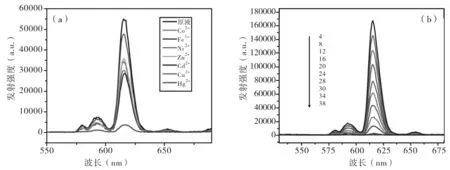
图3 (a)添加不同金属离子的测试液发射光谱(b)不同浓度Hg2+对测试液荧光猝灭的效果图
如图4所示,是测试液加入不同浓度汞离子后的紫外可见吸收光谱图,峰位在300-400 nm之间的变化,说明汞离子与S发生作用,紫外吸收减弱,对应于荧光光谱强度的减弱.测试液加入不同金属离子后在紫外灯下,发光效果会产生差异,肉眼可以直接看出只有加入汞离子的测试液发生荧光的猝灭,实现了可视化鉴别.
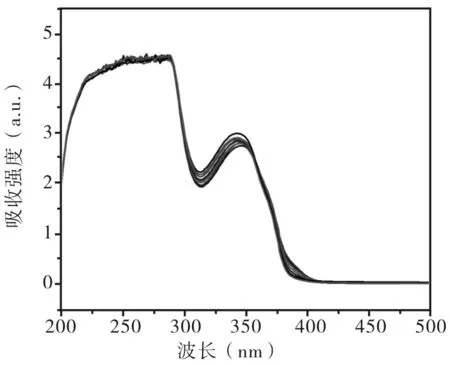
图4 不同浓度汞离子测试液的紫外可见吸收光谱
2.3 对机理的推测
根据皮尔逊软硬酸碱理论中“软亲软,硬亲硬”规律〔14〕,Hg2+为软酸,而含S有机配体为软碱,因而Hg2+和S反应快速且稳定.所以,我们利用皮尔逊软硬酸碱理论来做为含S发光化合物设计和合成的理论指导,设计配体PMS,来识别Hg2+离子.
3 结论
基于分子设计的思想,我们设计并合成了一种含有噻吩基团的稀土铕配合物Eu(DBM)3PMS作为汞离子光化学传感器,将配合物分散于水或乙醇溶液中,此发光溶液对Hg2+极为敏感,极少量的Hg2+都会导致发光溶液的荧光猝灭,适合制备Hg2+传感材料.与现有技术相比,合成方法简单,提纯方便;合成的发光材料对在水溶液中的重金属汞离子的亲和能力强;选择性区分效果明显,可作为光化学传感材料应用.对类似配合物的设计与合成在进一步的实验中,以期得到性能优异的光化学传感材料.
