3.0T高分辨率磁共振成像评估颅内动脉粥样硬化性狭窄的临床研究
2019-12-11杨丽华王艳玲马媛媛
杨丽华,刘 义,王艳玲,马媛媛
使用他汀类药物降低胆固醇已被证实对冠状动脉、颈动脉和颅内动脉粥样硬化具有保护作用[1-2]。临床研究证实服用他汀类药物具有稳定斑块,保留微血管完整性,减少斑块破裂发生率,使得动脉粥样硬化病人的血管事件显著减少[3-4]。目前已知在颈动脉粥样性狭窄的易损斑块与卒中发生的高风险密切相关,冠状动脉粥样硬化的斑块破裂后形成血栓进而引起急性心肌梗死。颅内动脉粥样硬化性狭窄引起缺血性卒中的发病机制包括血流动力学低灌注、动脉栓塞、斑块破裂导致原位血栓形成及局部分支闭塞等多种机制[5]。目前研究发现颅内动脉粥样硬化性狭窄的血管多为轻到中度狭窄,甚至有不少脑卒中/短暂性脑缺血发作病人在积极药物治疗后颅内动脉管腔仍进行性狭窄。深层次了解易损斑块、早期识别易损斑块并给予积极的干预措施对脑血管病的转归非常重要。受传统颅内动脉粥样硬化斑块成像技术的局限,目前尚缺少有关颅内动脉粥样硬化病人卒中前服用他汀类药物对易损斑块的研究。因此,本研究的目的是运用高分辨率磁共振成像(HR-MRI)评估卒中前服用他汀类药物的剂量对颅内动脉粥样硬化斑块特征(狭窄程度、血管重塑程度和斑块活化程度等)的影响。现报道如下。
1 资料与方法
1.1 临床资料 回顾性分析2015年5月—2017年5月我院收治的大脑中动脉粥样硬化性狭窄引起的急性缺血性卒中病人132例,最终符合入组标准的共53例,筛选流程见图1。
纳入标准:①磁共振血管成像(MRA)上单侧大脑中动脉M1段狭窄>30%;②无MR扫描禁忌证;③同侧颈内动脉狭窄程度<50%;④图片质量可用于诊断和分析;⑤没有非动脉粥样硬化性血管病变,如血管炎、烟雾病、脑出血、肿瘤等;⑥无潜在的心源性栓塞,如心房颤动、心脏瓣膜病、扩张型心肌病等心源性病变;⑦签署知情同意书者。
排除标准:①既往有卒中病史;②发病到入院时间超过24 h;③有严重的神经缺陷无法合作;④质量差的成像数据,如运动伪像;⑤卒中前服用他汀类药物<30 d。

图1病例筛选流程图
1.2 方法
1.2.1 一般资料收集及分组 收集病人入院时的相关临床参数包括性别、年龄、吸烟史、高血压、糖尿病、血糖、总胆固醇(TC)、磷脂酶A2(Lp-PLA2)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、三酰甘油(TG)、白细胞计数(WBC)、入院到HR-MRI检查时间以及美国国立卫生研究院卒中量表(NIHSS)评分。根据NIHSS评分将病人的卒中严重程度分为轻度(NIHSS评分≤8分)、中度(NIHSS 评分9~13分)、重度(NIHSS评分≥14分)。NIHSS评分较高表明中风更严重,预后较差。记录发病前他汀类药物的类型和剂量,并根据他汀类药物使用剂量分为对照组(未服用)、低剂量组(<40 mg)和高剂量组(≥40 mg)[6],卒中前服用他汀类药物是指发生缺血性脑卒中前30 d常规服用他汀类药物治疗。所有病人在入院后3 d内进行标准MR方案,包括轴向平扫T1加权成像(T1WI)、T2加权成像(T2WI)、T2流体衰减反转恢复(FLAIR)、扩散加权成像(DWI)、飞行时间MRA(TOF-MRA)。
1.2.2 HR-MRI检查方法 所有病人均使用具有8通道接收器阵列头部线圈的3-Tesla MR扫描仪(Ingenia,Philips Medical Systems,Netherlands)进行大脑中动脉狭窄的HR-MRI检查。运用TOF-MRA重建并确定血管结构,然后定位大脑中动脉狭窄位置。HR-MRI扫描包括垂直于大脑中动脉M1段的黑水T1WI、T2WI和质子密度加权成像(PDWI)。应用HR-MRI的成像序列参数,①TOF-MRA:重复时间(TR)22 ms,回波时间(TE)3.45 ms,激励次数(NEX)1,视场(FOV)200 mm×84 mm,矩阵大小332×227,切片间隙0.6 mm,切片数140;②T1WI:TR1 000 ms, TE9 ms,NEX 2,FOV 80 mm×80 mm,矩阵尺寸180 mm×144 mm,切片厚度2.0 mm,切片间隙0 mm,切片数6;③T2WI:TR 3 000 ms,TE80 ms,NEX 1,FOV 80 mm×80 mm,矩阵大小180 mm×144 mm,切片厚度2.0 mm,切片间隙0 mm,切片数6;④PDWI:TR 2 000 ms,TE9 ms,NEX 2,FOV80 mm×80 mm,矩阵大小180 mm×144 mm,切片厚度2.0 mm,切片间隙0 mm,切片数6。
所有参数测量均在Philips Intellispace Portal工作站上进行MR图像分析。将PDWI的短轴向图像放大到300%,并测量最狭窄部位和参照部位大脑中动脉的血管面积和管腔面积。参照部位是指最接近大脑中动脉狭窄处的无斑块或最小病变部分。如果近端参照部位不可用,则使用相邻的远端部位。当在症状性颅内动脉中检测到多个斑块时,选择狭窄程度最高的斑块用于分析。HR-MRI中大脑中动脉的狭窄程度计算公式:狭窄程度=[1-管腔面积(狭窄)/管腔面积(参照)]×100%。壁面积=血管面积-管腔面积,斑块面积=壁面积(狭窄)-壁面积(参照),重建指数=血管面积(狭窄)/血管面积(参照)。壁面积指数=壁面积(狭窄)/壁面积(参照)。扫描后由两名专业放射科医师共同测量完成,然后计算平均值。比较T1液体衰减反转恢复图像对照前后,以确定是否存在斑块增强,以及增强模式和增强体积。

2 结 果
2.1 3组一般资料比较 3.0T HR-MRI扫描后发现共有132例病人存在大脑中动脉粥样硬化性狭窄。最终符合入组标准的共53例,其中对照组25例,高剂量组12例,低剂量组16例。其中男28例,入院时有43例患有高脂血症史。尽管有高脂血症,但仍有10例病人未服用他汀类药物。3组性别、年龄、吸烟史、高血压、糖尿病、冠心病、血糖、LP-PLA2、HDL、TG、WBC比较差异无统计学意义(P>0.05),但对照组TC(P=0.025)和LDL(P=0.047)明显高于高剂量组、低剂量组,高脂血症比例低于高剂量组、低剂量组(P=0.05)。详见表1。

表1 3组一般资料比较
2.2 3组血管及斑块参数比较 形态学发现,3组颅内动脉粥样硬化斑块的NIHSS评分、狭窄程度、重塑指数、壁面积指数以及血管面积、管腔面积比较差异均无统计学意义(P>0.05)。斑块活性参数中,狭窄血管内斑块的增强比例随着他汀类药物的使用剂量增大而降低(P=0.033),3组斑块增强体积比较差异有统计学意义(P<0.001),在梗死模式方面,病人在卒中前接受他汀治疗的病人更有可能出现大脑深层皮质梗死(P=0.043)。详见表2。

表2 3组血管及斑块参数比较
2.3 颅内动脉粥样硬化性斑块增强多变量分析结果 调整可能的混杂因素后,卒中前服用他汀类药物的低剂量组[OR=2.36,95%CI(1.32,4.67),P=0.001]、高剂量组[OR=5.43,95%CI(2.54,8.62),P=0.037]、Lp-PLA2水平[OR=0.32,95%CI(0.11,0.54),P=0.024]分别与斑块增强独立相关。详见表3。
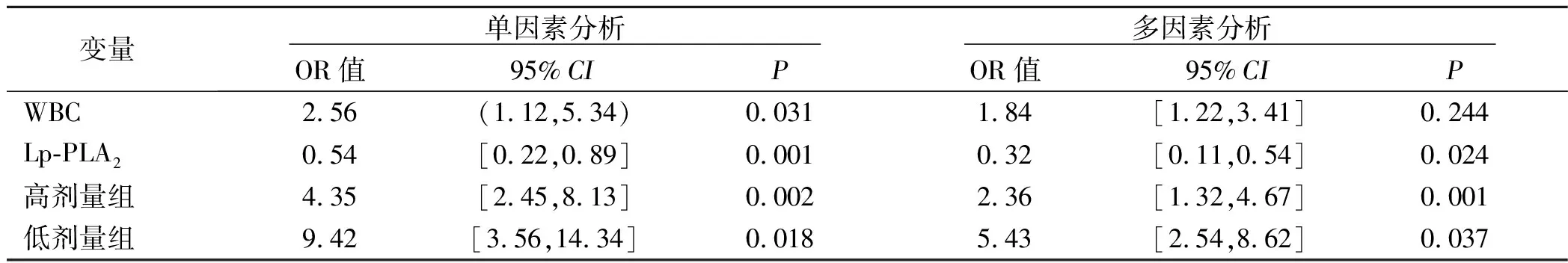
表3 颅内斑块增强的多变量回归分析
3 讨 论
他汀类药物不仅有降低胆固醇、低密度脂蛋白胆固醇(LDL-C)的作用,还具有改善神经血管内皮微环境、抗血管内皮炎症、抗氧化、间接舒张微血管、改善脑代谢等作用[7],并且能够通过多种机制稳定逆转动脉粥样硬化斑块,防止不稳定斑块破裂和血栓形成。他汀类药物已经被认为是脑卒中一级、二级预防药物[8]。动脉粥样硬化斑块突然破损、血小板激活、血栓形成是颅内动脉粥样硬化性狭窄引起缺血性卒中的重要发病机制。美国心脏协会/美国中风协会指导方针中对颅内动脉粥样硬化性卒中病人建议使用大剂量他汀类药物治疗[9]。然而,不同剂量的他汀类药物治疗颅内动脉粥样硬化性卒中的差异性仍有待研究。由于受传统颅内动脉粥样硬化斑块成像技术的局限,目前仍缺少颅内动脉粥样硬化易损斑块与卒中防治的研究。
颅内外血管狭窄的传统影像学检查均不能准确评估血管狭窄程度:如CT血管成像(CTA)的空间分辨率较低,难以识别薄纤维帽纤维斑块;且受图像噪声及对比剂干扰等因素影响,对低密度成分区分不佳,不能直接反映斑块的炎症程度。传统B超可提供颈动脉内膜中层厚度、管腔狭窄程度、斑块体积和斑块内部回声特点等信息,但局限性和主观性较大,也无法对颅内血管进行检测。数字减影血管造影(DSA)则存在有创性、昂贵、间接显示的局限。MRA检查不仅可显示血管狭窄程度,还可显示偏心型生长的斑块,可直接显示斑块大小、溃疡,同时可利用各种MR检查序列测定斑块内成分等易损性指标。可根据不同序列图像中信号强弱的不同来区分纤维帽的厚度和完整性。但图像容易受到呼吸、低分辨率和运动等相关噪音的影响[10-11]。而新近出现的HR-MRI通过强大的计算处理和高分辨率可用来定性、定量评价斑块的成分、性质(如脂质核、纤维帽、出血及钙化等)以及重塑模式[12-13],可用于颅内血管斑块易损性的判定,对进一步探讨动脉粥样硬化引发缺血性卒中的病理生理机制,指导早期卒中防治起到推进作用。
本研究发现,高、低剂量组斑块增强比例和斑块体积均较对照组降低,提示卒中前服用他汀类药物可以增强斑块的稳定性。这与既往研究结果相同,研究证实斑块增强程度与卒中程度、新生血管形成、血管内皮通透性增加具有显著相关性[14]。这表明适当的他汀类药物治疗有助于通过稳定颅内动脉粥样硬化斑块来预防大范围的皮层梗死。
既往研究表明HR-MRI检查可以发现不同临床症状与颅内动脉粥样硬化性卒中亚型之间的相关性[15]。梗死范围超过纹状体区域的病人狭窄程度均较重,并且有较高比例的斑块增强。在本研究中,3组血管狭窄程度、重塑指数和壁面积指数差异无统计学意义。这可能是由于他汀类药物主要起到稳定斑块作用,对于改变狭窄程度和重塑状态的作用较小。此外,在使用高剂量他汀类药物发生缺血性卒中的病人中,其病变仅限于深部脑组织。因此,他汀类药物使用可能对分支闭塞性疾病的保护作用有限。在本研究中,卒中前服用他汀类药物治疗的病人和对照组相比卒中严重程度差异无统计学意义。认为卒中严重程度主要与病变范围相关,既往研究强调了病变范围对卒中严重程度和长期预后的重要性,而与他汀类药物治疗无关[16]。
Lp-PLA2是由低密度脂蛋白水解氧化磷脂的炎性细胞产生的酶,与本研究中斑块增生的体积显著相关。Lp-PLA2水平升高是冠心病和脑卒中的重要危险因素[17]。既往研究表明,使用他汀类药物后Lp-PLA2水平降低对心血管事件发生率的减低具有显著预测作用[18]。最近研究表明,动脉粥样硬化斑块内缺氧和新生微血管形成是由斑块内的炎症反应引起[19]。但是,本研究中高、低剂量组炎性生物标志物Lp-PLA2较对照组均无明显降低。因此还需对颅内动脉粥样硬化性卒中病人的多种炎性生物标志物对易损斑块稳定作用的病理生理机制做进一步研究。
本研究局限在于:首先,尽管他汀类药物用于卒中的一级预防,但本研究中大部分颅内动脉粥样硬化性卒中病人未服用他汀类药物;第二,由于本研究为单中心回顾性分析,样本量较小,并且未能记录病人使用他汀类药物治疗的准确时间和剂量水平,因此研究结果的可推广性受到限制;第三,由于本研究仅包括颅内动脉粥样硬化性卒中病人,无法确定他汀类药物治疗是否减少病人心血管事件发生率。总之,本研究结果表明,卒中前服用他汀类药物可用于调节颅内动脉粥样硬化性卒中病人的斑块增生程度,并减少大皮质梗死病人的比例。进一步强调了适当的预防性使用他汀类药物治疗对于减少颅内动脉粥样硬化病人大面积皮层梗死的重要性。
