饲料不同植物提取物水平对红白锦鲤免疫力的影响
2019-12-10曲木张宝龙赵子续侯树旺翟胜利
曲木 张宝龙 赵子续 侯树旺 翟胜利


摘 要:该试验旨在探究饲料中不同绿原酸、竹青素水平对红白锦鲤免疫能力、抗氧化能力与脂质代谢的影响。以红白锦鲤为研究对象,以绿原酸、竹青素为饲料添加剂,配置9种试验饲料,选用规格一致、健康活泼的红白锦鲤600尾,随机分为10个试验组(其中9组为试验组,1组为对照组),每组3个重复,每个重复20尾鱼,于30个规格为0.85m×0.65m×0.45m的循环水养殖箱中养殖。饲喂8周后,取血液和组织等样本,通过对组织及血清中T-AOC、CAT、MDA、T-SOD、GOT、GPT指标的测定发现,Diet 2(竹青素/绿原酸水平为0.04%/0.06%)饲料组红白锦鲤免疫力有所提升。
关键词:绿原酸 竹青素 红白锦鲤 免疫力
中图分类号:S917.4 文献标识码:A 文章编号:1672-3791(2019)10(a)-0199-06
锦鲤(Cyprinus carpio L)作为一种观赏鱼以体色艳丽为美,而锦鲤一旦患病,其体色会大大降低,有时甚至可以直接影响锦鲤售卖,因此,该试验研究了绿原酸和竹青素这两种天然免疫增强剂对红白锦鲤免疫指标的影响,以期为研发锦鲤增色提供理论参考。
1 试验材料与方法
1.1 试验鱼与养殖管理
该试验以红白锦鲤为养殖对象,试验鱼购自天津市金水族水产养殖有限公司,选取规格一致、健康活泼的红白锦鲤600尾,运往天津市晨辉饲料有限公司循环水养殖实验室后消毒,暂养一周后随机分为10组(其中9组为试验组,1组为对照组),每组3个重复,每个重复20尾鱼,于30个规格为0.85m×0.65m×0.45m的循环水养殖箱中养殖。基础饲料训化2周后,开始正式试验,养殖周期为8周。养殖过程中,养殖水体氨氮含量为0.2mg/L、亚硝酸盐含量为0.1mg/L、pH值为8.4,养殖水温为25℃~29℃,每日底缸换水一次,换水量为1/3。饲料投喂时间为每日8:00与16:00,饲料投喂方法为饱食法,每日投喂后饲料称重。
1.2 试验饲料
该试验以竹青素(有效含量40%)、绿原酸(有效含量50%)为影响因素,采用双因素试验设计中的“3×3因子设计”,设计9种饲料,每个因素各设3个水平,分别为竹青素(0.04%、0.06%、0.08%)、绿原酸(0.03%、0.06%、0.09%),依次记为Diet 1、Diet 2、Diet 3、Diet 4、Diet 5、Diet 6、Diet 7、Diet 8、Diet 9,以不含竹青素和绿原酸的基础饲料做对照饲料,饲料成分见表1。
1.3 样本采集及指标测定
1.3.1 样本采集
养殖试验结束后,每个重复取9尾鱼,共27尾。血样采集方法为尾静脉采血,解剖后取肝胰脏、中肾、脾、肌肉、肠组织,血液在4℃、4000r/min条件下离心15min,取上清液,制成血清样本,存放于-20℃冰箱中冷冻保存,待测。
1.3.2 指标测定
该试验测定了红白锦鲤血清和组织中总抗氧化能力(Total antioxidant capacity,T-AOC)、过氧化氢酶(Catalase,CAT)、丙二醛(Malonaldehyde,MDA)、总超氧化物歧化酶(Total superoxide dismutase,T-SOD)、谷草轉氨酶(Glutamic-oxalacetic transaminase,GOT)、谷丙转氨酶(Glutamic-pyruvic transaminase,GPT)6个指标。血清在室温条件下融化后直接进行测定,组织指标测定按组织:0.85%生理盐水=1∶4比例配制成20%匀浆液,根据试剂盒测定需要在此基础上进行稀释,指标测定严格按照南京建成生物工程研究所所研制的试剂盒说明书进行。
2 试验结果
2.1 饲料不同竹青素、绿原酸水平对红白锦鲤T-AOC的影响
试验结果表明(见表2):红白锦鲤肝胰脏中T-AOC在Diet 2饲料组达到最高,与Diet 1和Diet 9饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05);中肾中T-AOC在Diet 2饲料组达到最高,且显著高于其他饲料组(P<0.05);脾中T-AOC在Diet 9饲料组达到最高,与Diet 2、Diet 4、Diet 5饲料组差异不明显(P>0.05);血清中T-AOC在Diet 2饲料组达到最高,与Diet 1、Diet 8、Diet 9饲料组差异不显著(P>0.05);红白锦鲤肌肉中T-AOC活性在Diet 1时达到最高,且显著高于其他饲料组(P<0.05)。
竹青素各水平对红白锦鲤组织和血清中T-AOC有显著影响(P<0.05),但对脾中T-AOC影响不显著(P>0.05),最优水平分别为0.04%、0.04%、0.06%、0.04%、0.04%;绿原酸各水平对红白锦鲤组织和血清中T-AOC有显著影响(P<0.05),但对于脾中T-AOC影响不显著(P>0.05),最优水平分别为0.03%、0.06%、0.03%、0.06%、0.03%;二者的交互作用对红白锦鲤组织和血清中T-AOC也有显著影响(P<0.05)。
2.2 饲料不同竹青素、绿原酸水平对红白锦鲤CAT活性的影响
试验结果表明(见表3):红白锦鲤肝胰脏、中肾、脾、血清中CAT活性均在Diet 2饲料组达到最高,且显著高于其他饲料组(P<0.05);肌肉中CAT活性在Diet 2饲料组达到最高,与Diet 5、Diet 8饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05)。
竹青素各水平对红白锦鲤组织和血清中CAT活性有显著影响(P<0.05),但对肌肉中CAT活性影响不显著(P>0.05),最优水平分别为0.04%、0.04%、0.04%、0.04%、0.04%;绿原酸各水平对红白锦鲤组织和血清中CAT活性均有显著影响(P<0.05),最优水平分别为0.06%、0.09%、0.06%、0.06%、0.06%;二者的交互作用对红白锦鲤组织和血清中CAT活性也有显著影响(P<0.05),但对于肌肉中CAT活性影响不显著(P>0.05)。
2.3 饲料不同竹青素、绿原酸水平对红白锦鲤MDA含量的影响
试验结果表明(见表4):红白锦鲤肝胰脏中MDA的含量在Diet 4饲料组达到最低,且与其他饲料组差异不显著(P<0.05);中肾中MDA的含量在Diet 1饲料组达到最低,与Diet 2饲料组差异不显著(P>0.05),但显著低于其他饲料组(P<0.05);脾中MDA的含量在Diet 2饲料组显著降低,与Diet 9饲料组差异不显著(P>0.05);血清中MDA的含量在Diet 2饲料组达到最低,与Diet 7和Diet 9差异不显著(P>0.05);肌肉中MDA的含量在Diet 8饲料组达到最低,与对照组、Diet 2、Diet 4、Diet 8饲料组差异不显著(P>0.05)。
竹青素各水平对红白锦鲤组织和血清中MDA的含量有显著影响(P<0.05),但对肌肉中MDA的含量影响不显著(P>0.05),最优水平分别为0.06%、0.04%、0.08%、0.08%、0.06%;绿原酸各水平对红白锦鲤组织和血清中MDA的含量有显著影响(P<0.05),但对脾中MDA的含量影响不显著(P>0.05),最优水平分别为0.06%、0.03%、0.03%、0.06%、0.06%;二者的交互作用对红白锦鲤组织和血清中MDA的含量也有显著影响(P<0.05)。
2.4 饲料不同竹青素、绿原酸水平对红白锦鲤T-SOD活性的影响
试验结果表明(见表5):红白锦鲤肝胰脏中SOD活性在Diet 9饲料组时达到最大,与Diet 2、Diet 7饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05);中肾中SOD活性在Diet 1饲料组达到最大,与Diet 2、Diet 6饲料组差异不显著(P>0.05);脾中SOD活性在Diet 2饲料组达到最大,与Diet 5饲料组差异不显著(P>0.05);血清中SOD活性在Diet 6时达到最大,且显著高于其他饲料组(P<0.05);肌肉中SOD活性在Diet 7饲料组达到最大,且显著高于其他饲料组(P<0.05)。
竹青素各水平对红白锦鲤组织和血清中SOD活性均有显著影响(P<0.05),最优水平分别为0.08%、0.04%、0.04%、0.06%、0.08%;绿原酸各水平对红白锦鲤组织和血清中SOD活性均有显著影响(P<0.05),最优水平分别为0.06%、0.09%、0.06%、0.06%、0.03%;二者的交互作用对红白锦鲤组织和血清中SOD活性也有显著影响(P<0.05)。
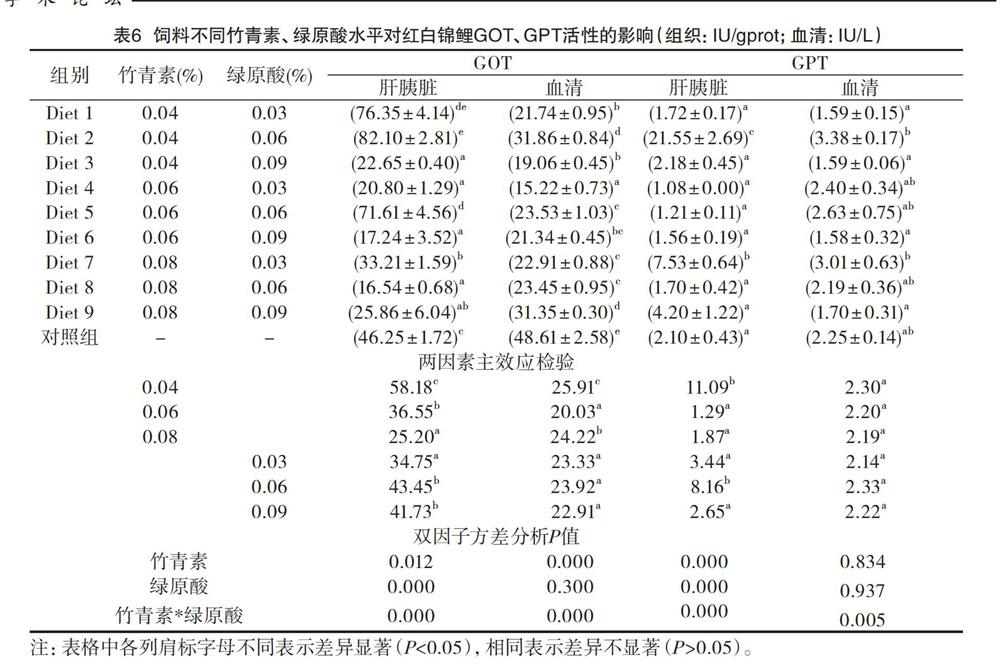
2.5 饲料不同竹青素、绿原酸水平对红白锦鲤GOT、GPT活性的影响
试验结果表明(见表6):红白锦鲤肝胰脏中GOT活性在Diet 2饲料组达到最高,与Diet 1饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05);血清中GOT活性在Diet 2饲料组达到最低,与Diet 9饲料组差异不显著(P>0.05),但显著高于其他饲料组(P<0.05)。肝胰脏中GPT活性在Diet 4饲料组达到最低,且显著低于Diet 7、Diet 8饲料组(P<0.05);血清中GPT活性在Diet 6饲料组最低,且显著低于Diet 3、Diet 7饲料组(P<0.05)。
竹青素各水平对红白锦鲤肝胰脏中GOT、GPT及血清中GOT活性均有显著影响(P<0.05),但对血清中GPT活性影响不显著(P>0.05),最优水平均为0.04%;绿原酸各水平对红白锦鲤肝胰脏中GOT、GPT活性有显著影响(P<0.05),但对血清中GOT、GPT活性影响不显著(P>0.05),最优水平均为0.06%;二者的交互作用对红白锦鲤组织和血清中GOT、GPT活性也有显著影响(P<0.05)。
3 讨论
绿原酸主要来源于植物,是一种具有抗氧化、抗菌抗病毒和免疫调节等作用的新型环保添加剂[1],竹青素是以刚竹属竹子为原料萃取而来的有效成分,是一种卓越的生物抗氧化剂、脂代谢调节剂和免疫功能增强剂[2]。
吴卫星用绿原酸、多糖、黄酮等制成复方中草药饲喂鲤鱼,测定SOD、CAT、GPT活力,发现0.2%的复方中草药添加组鲤鱼生长、免疫力得到顯著提升[3];张纯等研究发现低剂量绿原酸随着饲喂时间的延长对SOD提高作用逐渐增强,添加适量的绿原酸可显著提高建鲤血浆CAT活力,建鲤血浆中T-AOC显著升高,MDA含量显著降低,提高建鲤抗氧化能力的绿原酸最适添加量为200~400mg/kg[4];杨天俊等研究发现,当饲料中绿原酸含量为400mg/kg时可显著地提高了草鱼幼鱼血清CAT和肝胰脏中SOD活力,降低血清及肝胰脏中MDA的含量[5];李乃顺等人在对草鱼的研究中报道了0.04%绿原酸可显著提高草鱼鱼种肝胰脏SOD活性[6];韩兆红在团头鲂的饲料中添加了福乐星(主要成分绿原酸、生物碱和黄酮的),其研究成果表明中草药提取物能够显著增强团头鲂SOD活力[7]。张英等研究发现,竹提取物对SOD的活性具有显著的诱导作用[8]。黄骆镰等研究发现,饲料中添加不同水平竹青素可以降低肉鸡血清中MDA的含量,同时发现1.5g/kg和3g/kg添加量极显著地提高了肉鸡血清中SOD活性[9]。该试验结果与上述试验结果相似,由此可,见饲料中添加适量绿原酸可有效改善红白锦鲤组织抗氧化能力。Aitani等报道了口服绿原酸可减少大鼠内脏脂肪的蓄积,降低大鼠机体脂质含量[10]。杨天俊等研究发现高脂饲料中添加不同浓度绿原酸均能提高草鱼幼鱼肝胰脏中GOT、GPT活性[5],而该试验结果与以上结果相似,表明绿原酸和竹青素对红白锦鲤免疫力提升确有促进作用。
4 结语
该试验测定了能提现锦鲤体质健康程度的5个生理生化指标,通过试验结果发现,在该试验条件下,红白锦鲤饲料中最适竹青素、绿原酸添加,搭配为0.04%/0.06%。
参考文献
[1] 刘颖,郭晓华,白根本.绿原酸的研究进展[J].中药材,2012,35(3):1180-1185.
[2] 姜文进.竹取物对养殖大黄鱼食用品质和贮藏特性的影响研究[D].浙江大学,2013.
[3] 吴卫星.两种新型复方免疫增强剂对三种水产动物生长及非特异性免疫功能的影响[D].河北农业大学,2014.
[4] 张纯,温安祥.绿原酸对建鲤生长、非特异性免疫功能和抗氧化能力的影响[J].四川农业大学学报,2012,30(1):92-97.
[5] 杨天俊.高脂饲料中绿原酸对草鱼幼鱼生长性能、免疫能力、抗氧化性能及脂质代谢的影响[D].四川农业大学,2010.
[6] 李乃顺,冷向军,李小勤,等.绿原酸对草鱼鱼种生长、非特异性免疫和肉质的影响[J].水生生物学报,2014,38(4):619-626.
[7] 韩兆红.中草药提取物对团头鲂生长及免疫力的影响[D].苏州大学,2008.
[8] 张英.天然功能性添加剂——竹叶提取物[J].精细与专用化学品,2002(7):20-22.
[9] 黄骆镰,龚凌霄,刘聪,等.饲粮中添加竹青素对肉鸡脂质代谢的影响[J].动物营养学报,2013,25(1):148-155.
[10] Shimoda H, Seki E, Aitani M. Inhibitory effect of green coffee bean extract on fat accumulation and body weight gain in mice[J].BMC Complementary and Altemative Medicine,2006,6(1):9.
