花生GAIP-B基因的生物信息学分析及表达研究
2019-12-09何佳霖赵凯周定纬李培培李忠峰马兴立张幸果殷冬梅
何佳霖 赵凯 周定纬 李培培 李忠峰 马兴立 张幸果 殷冬梅


摘要:为研究DELLA蛋白在花生生长、育种过程中的功能,利用RT-PCR技术从花生栽培种品系花2014中克隆得到一个花生DELLA蛋白编码基因AhGAIP-B(GenBank登录号:XP_016191184)。序列分析结果表明,AhGAIP-B开放阅读框(ORF)全长1 812 bp,只有一个外显子,可编码603个氨基酸。生物信息学分析发现,AhGAIP-B编码的产物是一类典型DELLA蛋白,其三级结构与拟南芥GAI相似,亲缘关系与大豆GmGAI1最近。进一步qRT-PCR结果显示,AhGAIP-B基因呈组成型表达,其中在茎中表达量最高;同时,本研究还发现,外源GA3可以诱导AhGAIP-B基因上调表达,其表达量在处理后12 h最高。本结果将为进一步的花生DELLA功能研究提供理論基础。
关键词:花生;DELLA蛋白;AhGAIP-B基因;赤霉素;组织表达
中图分类号:S565.2:Q786文献标识号:A文章编号:1001-4942(2019)09-0028-07
Bioinformatics Analysis and Expression of GAIP-B in Peanut
He Jialin, Zhao Kai, Zhou Dingwei, Li Peipei, Li Zhongfeng, Ma Xingli, Zhang Xingguo, Yin Dongmei
(College of Agronomy, Henan Agricultural University, Zhengzhou 450002, China)
Abstract To study the function of DELLA protein in peanut growth and breeding, a peanut DELLA protein coding gene AhGAIP-B(GenBank accession number: XP_016191184) was cloned from peanut cultivar Hua 2014 by RT-PCR. Sequence analysis showed that the full length of AhGAIP-B open reading frame (ORF) was 1 812 bp with only one exon, and it encoded 603 amino acids. Bioinformatics analysis showed that the product encoded by AhGAIP-B was a typical DELLA protein, whose tertiary structure was similar to that of GAI in Arabidopsis thaliana, and its genetic relationship was the closest to GmGAI1 in soybean. qRT-PCR results showed that AhGAIP-B gene was expressed by the constitutive type in peanut with the highest expression level in stem. Exogenous GA3 could induce the up-regulation expression of AhGAIP-B gene, which reached the highest level at 12 hours after treatment. This results could provide a theoretical basis for further study of DELLA function in peanut.
Keywords Arachis hypogaea; DELLA protein; AhGAIP-B gene; Gibberellin; Tissue expression
赤霉素(Gibberellins,GAs)是一类由四环骨架构成的二萜类化合物,在植物生长发育中发挥着重要的调节作用[1-4]。目前,研究者们对拟南芥等模式植物中的GAs代谢途径开展了深入研究,其中对于GAs信号转导途径的关键负调控因子DELLA蛋白研究较多[5]。迄今为止,拟南芥中共鉴定出五个DELLA蛋白,分别为GAI(GA Insensitive)、RGA(Repressor of GA1-3)、RGL1(REPRESSOR OF ga7-i-LIKE protein 1)、RGL2(REPRESSOR OF ga7-i-LIKE protein 1)、RGL3(REPRESSOR OF ga7-i-LIKE protein 1)[6-8]。已有研究表明,DELLA蛋白含有多个保守功能域:位于N端特异的DELLA和TVHYNP酸性保守域与GA信号感知区;C端的VHVID、RVER、Pyre及SAW结构域具有GA信号抑制功能;另外其中心区还含有核定位区域NLS[9]。当GAs存在时,可诱导 GID1蛋白构象变化,并与DELLA蛋白结合从而形成GA-GID1-DELLA三聚体;然后在26S蛋白酶泛素化作用下DELLA蛋白发生降解,解除其对植物的生长抑制作用[10]。不同DELLA蛋白在植物发育中具有不同作用,如拟南芥GAI和RGA对植物伸长生长和开花存在抑制功能[11],而RGL1和RGL2的主要功能在于调节花瓣、雄蕊和花药的发育[12]。
在我国,花生(Arachis hypogaea)是一种重要的油料和经济作物,但每逢夏季多雨年份,花生植株长势过旺容易引起倒伏、影响机械化收获,造成大幅减产。所以花生的矮化育种具有重要的现实意义,然而传统育种方式获得矮化优良品种周期较长。近年来基因工程技术的发展为我们提供了新的思路,通过转入GAs抑制因子DELLA蛋白基因可调节植株的高度,从而获得优良矮化品种[13],但在花生中还未见相关报道。
本研究从花生中克隆到一个DELLA蛋白编码基因GAIP-B,对其进行了生物信息学分析,并进行了不同组织表达分析。研究结果可为深入研究花生DELLA蛋白的分子作用机制和分子矮化育种提供参考。
1 材料与方法
1.1 植物材料
本试验材料为花生栽培种品系花2014。
不同组织部位取材:试验于2018年5月1日至9月10日在河南农业大学毛庄科教园区进行,行距0.4 m。于2018年7—8月取花生的根、主茎、幼叶、花蕾和未成熟种子,3次重复,液氮速冻后-80℃保存。
赤霉素处理材料选取:花生种子催芽24 h后播种,在光周期为16L∶8D、温度为26℃/24℃的人工气候箱中培养,相对湿度60%,于花生三叶期(出苗后7 d)叶面喷施50 mg/L的赤霉素,在处理后0、2、4、8、12、24、48 h采集叶片样品。每个时间点选定9株长势一致的植株,每3株为1个重复,共设3次重复。取样后用液氮速冻后-80℃保存。
1.2 总RNA提取和cDNA合成
取相应组织的材料在液氮中研磨,总RNA提取采用TransZOL Plant(TRANSGEN)试剂盒,cDNA的合成采用PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa)。引物由上海尚亚生物技术有限公司合成,其编号及序列见表1。
1.3 AhGAIP-B基因的克隆
根据NCBI(https://www.ncbi.nlm.nih.gov/)数据库搜索到的AhGAIP-B基因设计特异性引物(表1),以花生栽培种花2014的cDNA为模板扩增目的片段AhGAIP-B。PCR反应体系为50 μL:cDNA模板2.5 μL,5×Q5 Reaction Buffer 10 μL,dNTPs 1 μL,F、R引物各25 μL,Q5 High-Fidely DNA Polymerase 0.5 μL,ddH2O补足50 μL。反应程序:98℃预变性30 s;98℃变性10 s,59℃退火30 s,72℃延伸2 min,33个循环;72℃延伸2 min。1%琼脂糖凝胶电泳检测PCR产物。凝胶回收试剂盒(ZOMANBIO)纯化目的条带,连接到克隆载体ZT4-Blunt上,转化后筛选阳性克隆送至上海尚亚生物技术有限公司进行测序。
1.4 AhGAIP-B基因的生物信息学分析
用在线软件GSDS 2.0(http://gsds.cbi.pku.edu.cn/index.php)绘制基因结构图;利用MapInspect软件进行染色体定位作图;用SMART(smart.embl-heidelberg.de/)工具进行结构域的预测,最终确定DELLA基因家族序列;使用expasy工具进行蛋白质理化性质分析;用TMHMM Server v. 2.0工具(http://www.cbs.dtu.dk/services/TMHMM/)预测蛋白质跨膜结构域;蛋白质亚细胞定位用在线网站(http://www.csbi- o.sjtu.edu.cn/bio inf/plant-multi/)进行预测。
蛋白质的二级结构用在线软件PRABI(http://ww-w.prabi.fr/)进行预测;根据在线软件SWISS-MODEL(https://www.swissmode- l.expasy.org/interactive)分析蛋白质三级结构。
在PeanutBase(https://www.peanutbase.org/)和NCBI(https://www.ncbi.nlm.ni-h.gov/)利用在线Blast工具搜索花生AhGAIP-B蛋白的同源序列;利用本地软件DNAMAN 6.0及在线weblogo 2.82网站(http://weblogo.berkeley.edu/)进行氨基酸多序列比对及同源性分析;使用MEGA 7.0选择邻接法(neighbor-joining,NJ)构建系统发育进化树,参数设置Bootstrap=1 000。
1.5 实时荧光定量PCR分析
分别以不同组织材料总RNA反转录的cDNA为模板,以Actin为内参基因,扩增体系及程序参照TaKaRa公司的SYBR Premix Ex TaqTM Ⅱ试剂盒说明书操作。三次生物学重复,所用引物见表1,采用2-ΔΔCt计算相对表达量。
2 结果与分析
2.1 AhGAIP-B基因的克隆
以栽培种花2014的cDNA为模板进行PCR扩增,获得AhGAIP-B基因的cDNA序列,长1 812 bp(图1A)。测序结果表明,该基因长度及核苷酸序列与参考基因组13号染色体上的基因Arahy.64CHNN预测序列完全一致,与同源染色体03号染色体上的参考基因Arahy.DN4CQF相似度为99.74%。
2.2 AhGAIP-B基因的生物信息学分析
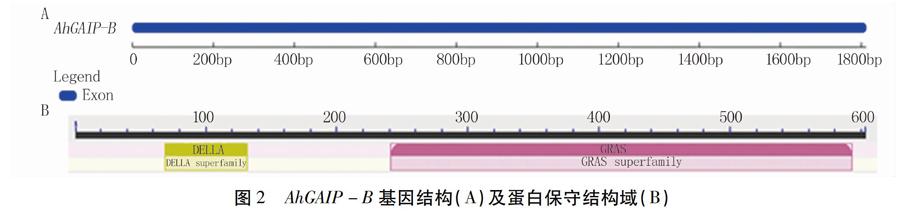
2.2.1 AhGAIP-B蛋白氨基酸序列分析 花生基因组测序结果显示,AhGAIP-B位于花生13号染色体上(图1B),包含一个外显子,无内含子(图2A),可编码603个氨基酸。氨基酸理化性质分析结果表明,AhGAIP-B蛋白的化学分子式为C2889H4495N803O893S23,相对分子质量为65.50 kD,亲水系数为-0.233,预测为亲水性蛋白。同时,该蛋白无跨膜结构域,亚细胞定位在细胞核上。进一步保守域分析显示,AhGAIP-B蛋白N端含有DELLA结构域,C端存在GRAS结构域,属于GRAS家族基因(图2B)。
2.2.2 AhGAIP-B蛋白结构分析 二级结构分析发现,AhGAIP-B由49.1%的α-螺旋、308%的無规则卷曲、11.6%的延伸链和8.5%的β-转角共同组成(图3A)。蛋白质三维结构分析发现AhGAIP-B蛋白质三级结构与AtGAI类似(图3B),推测两者可能具有相同的功能。
2.2.3 不同物种DELLA蛋白的保守结构域与系统进化分析 利用DNAMAN软件将AhGAIP-B氨基酸序列与拟南芥(At)、大豆(Gm)、棉花(Gh)、水稻(Os)、芝麻(Si)、小麦(Ta)、油菜(Bn)及玉米(Zm)等物种的DELLA蛋白进行氨基酸多重比对,发现不同物种的DELLA蛋白在C端都含有GA信号阻遏结构域VHVID、RVER和SAW,中心区存在LZ(亮氨酸七肽重复序列)及核定位区域NLS,而N端则具有GA信号感知结构域DELLA和TVHYNP(图4)。为进一步研究这些物种中DELLA蛋白的亲缘关系,基于前述氨基酸比对结果构建系统发育进化树。结果显示,
前述花生等9个物种的DELLA蛋白被明确划分为两大类,其中,同为禾本科的单子叶植物水稻、小麦和玉米DELLA蛋白为Ⅰ大类,其余双子叶植物则为Ⅱ大类(图5)。Ⅱ大类里面根据遗传距离又可细分几个小类,如同为十字花科的拟南芥和油菜的DELLA蛋白可归为一类,锦葵科的棉花和胡麻科芝麻的DELLA蛋白归为一类;而同为豆科的花生和大豆的DELLA蛋白亲缘关系则最近。
2.3 AhGAIP-B基因表达分析
荧光定量分析结果表明,AhGAIP-B基因在不同组织均有表达,其中茎中表达量最高,其次为根、种子、叶和花(图6)。为进一步了解AhGAIP-B应答GA3的表达模式,对GA3处理不同时间基因的表达水平进行了分析,结果表明,AhGAIP-B基因的表达随GA3处理时间延长先逐渐上升,在12 h时达到峰值,为处理前的26倍;此后逐渐下调,但处理48 h时仍高于处理前水平(图7)。
3 讨论与结论
本研究克隆了花生GAIP-B基因,并对其表达模式进行了分析,该基因在花生的根、茎、叶、花、种子中均有表达,与拟南芥GAI及水稻SLR[STBX]1的组织表达模式一致[14,15]。但并非所有植物的DELLA基因都是如此,擬南芥中的AtRGL1、AtRGL2和AtRGL3仅在花、萌芽的种子和角果中表达[14];苹果GAI基因仅在幼果中表达[16];大豆GAI1a仅在叶、花和胚组织中表达[17];黄瓜GAIP基因在茎和雄花芽中表达[18],这表明DELLA基因在不同植物中可能存在不同的功能。模式植物拟南芥中的RGA和GAI结构相似,但RGA比GAI更具主导作用,敲除RGA和GAI基因后使拟南芥GA1-3缺陷型恢复为野生型或过表达GA型[19];而RGL1和RGL2共同参与种子萌发、叶片衰老和控制花形态发育等途径[20-22]。Zhang等[23]利用黄瓜GAIP在拟南芥中异源表达,发现CsGAIP能够恢复拟南芥rga-24/gai-t6突变体的花形态、雌蕊发育和株高,并且导致拟南芥雄蕊数量减少;此外,将苹果RGL2a基因在拟南芥中超表达后,转基因植株表现出类似GAI突变矮化型表型[24,25]。这些结果表明DELLA蛋白可能参与植株矮化、花发育等多个生物学功能。
本研究从花生中成功分离出一个DELLA蛋白编码基因AhGAIP-B,其编码产物具有典型的DELLA蛋白保守结构域,且进化上与同为豆科的大豆DELLA蛋白亲缘关系最近。进一步研究发现,AhGAIP-B基因在花生多个组织部位均有表达,其中以茎中表达量最高;此外,外源GA3可以诱导AhGAIP-B基因上调表达。本研究结果有助于深入理解DELLA蛋白在花生生长发育中的调节机制,并为花生株型改良提供理论基础。
参 考 文 献:
[1]Itoh H,Tanaka-Ueguchi M, Kawaide H, et al. The gene encoding tobacco gibberellin 3 β-hydroxylase is expressed at the site of GA action during stem elongation and flower organ development[J].The Plant Journal, 1999, 20: 15-24.
[2]Silverstone A L, Chang C, Krol E, et al. Developmental regulation of the gibberellin biosynthetic gene GA1 in Arabidopsis thaliana[J].The Plant Journal, 1997, 12: 9-19.
[3]Rebers M, Kaneta T, Kawaide H, et al. Regulation of gibberellin biosynthesis genes during flower and early fruit development of tomato[J].The Plant Journal, 1999, 17: 245-250.
[4]Yamaguchi S, Smith M W, Brown R G, et al. Phytochrome regulation and differential expression of gibberellin 3-hydroxylase genes in germinating Arabidopsis seeds[J].Plant Cell, 1998, 10: 2115-2126.
[5]Ikeda A, Tanaka S, Yamaguchi J, et al. Characterization of gibberellin signal transduction pathway in the slender mutant with constitutive gibberellin-response in rice[J].Sci. Rep. Fac. Agric. Meijo.Univ., 1999, 35: 15-22.
[6]Dill A, Jung H S, Sun T P.The DELLA motif is essential for gibberellin-induced degradation of RGA[J].Proceedings of the National Academy of Sciences, 2001, 98 (24): 14162-14167.
[7]吴绍华, 赫泽芸, 张世鑫, 等.橡胶树HbGAIP-B基因的克隆与表达分析[J].热带作物学报, 2016, 37(5): 881-887.
[8]King K E,Moritz T,Harberd N P. Gibberellins are not required for normal stem growth in Arabidopsis thaliana in the absence of GAI and RGA[J].Genetics, 2001, 159: 767-776.
[9]Itoh H, Ueguchi-Tanaka M, Sato Y, et al.The gibberellin signaling pathway is regulated by the appearance and disappearance of SLENDER RICE1 in nuclei[J].The Plant Cell, 2002, 14 (1): 57-70.
[10] Murase K, Hirano Y, Sun T P, et al.Gibberellin-induced DELLA recognition by the gibberellin receptor GID1[J].Nature, 2008, 456: 459-463.
[11] 吴建明, 黄杏, 丘立杭, 等. DELLA蛋白在植物中的研究进展[J].农业生物技术学报, 2016, 24(8): 1207-1215.
[12] Chen W H, Lee Y I, Yang C H. Ectopic expression of two FOREVER YOUNG FLOWER orthologues from Cattleya orchid suppresses ethylene signaling and DELLA results in delayed flower senescence/abscission and reduced flower organ elongation in Arabidopsis[J].Plant Molecular Biology Reporter, 2018, 36(5/6): 710-724.
[13] Fu X, Sudhakar D, Peng J, et al.Expression of Arabidopsis GAI in transgenic rice represses multiple gibberellin responses[J].The Plant Cell, 2001, 13(8): 1791-1802.
[14] Tyler L, Thomas S G, Hu J, et al. DELLA proteins and gibberellin-regulated seed germination and floral development in Arabidopsis[J].Plant Physiology, 2004, 135(2): 1008-1019.
[15] Ikeda A, Ueguchi-Tanaka M, Sonoda Y, et al. Slender rice, a constitutive gibberellin response mutant, is caused by a null mutation of the SLR1 gene, an ortholog of the height-regulating gene GAI/RGA/RHT/D8[J].The Plant Cell, 2001, 13(5): 999-1010.
[16] 梁美霞,祝军,戴洪义. 柱型苹果MdGAI基因的克隆及表达分析[J].园艺学报, 2011, 38(10): 1969-1978.
[17] 宋仙萍. 大豆DELLA基因GmGAI1α参与赤霉素信号转导途径的功能分析[D].哈尔滨: 东北农业大学, 2013.
[18] 张颜. 黄瓜中GA信号转导因子CsGAIP和CsGAMYB1的克隆与功能分析[D].北京: 中国农业大学, 2014.
[19] Dill A, Sun T. Synergistic derepression of gibberellin signaling by removing RGA and GAI function in Arabidopsis thaliana[J].Genetics, 2001, 159: 777-785.
[20] Lee S C, Cheng H, King K E, et al. Gibberellin regulates Arabidopsis seed germination via RGL2, a GAI/RGA-like gene whose expression is up-regulated following imbibition[J].Genes and Development, 2002, 16(5): 646-658.
[21] Chen L G, Xiang S Y, Chen Y L, et al. Arabidopsis WRKY45 interacts with the DELLA protein RGL1 to positively regulate age-triggered leaf senescence[J].Mol. Plant, 2017, 10(9): 1174-1189.
[22] Cheng H, Qin L, Lee S, et al.Gibberellin regulates Arabidopsis floral development via suppression of DELLA protein function[J].Development, 2004, 131: 1055-1064.
[23] Zhang Y, Liu B, Yang S, et al. A cucumber DELLA homolog CsGAIP may inhibit staminate development through transcriptional repression of B class floral homeotic genes[J].PLoS ONE, 2014, 9(3): e91804.
[24] Peng J, Carol P, Richards D E, et al. The Arabidopsis GAI gene defines a signaling pathway that negatively regulates gibberellin responses[J].Genes and Development, 1997, 11(23): 3194-3205.
[25] Foster T, Kirk C, Jones W T, et al. Characterisation of the DELLA subfamily in apple (Malus×domestica Borkh.)[J].Tree Genetics & Genomes, 2007, 3(3): 187-197.
收稿日期:2019-07-24
基金項目:国家自然科学基金项目(U1704232);河南省产业技术体系(S2012-05-G03)
作者简介:何佳霖(1995—),男,河南信阳人,硕士研究生。
通讯作者:殷冬梅(1972—),女,河南南阳人,博士,教授,主要从事花生遗传育种工作。E-mail:yindm@126.com
