花生生长素响应因子基因AhARF3的克隆与表达分析
2019-12-09唐桂英崔维佩徐平丽李鹏祥朱洁琼单雷
唐桂英 崔维佩 徐平丽 李鹏祥 朱洁琼 单雷

摘要:生长素响应因子(auxin response factor, ARF)是调控生长素响应基因表达和信号转导的一类转录因子,在植物生长发育的各个阶段均起重要的调节作用。本研究基于花生种子萌发前后转录表达差异分析,克隆到1个生长素响应因子基因AhARF3。序列分析结果显示,该基因的ORF区为2 115 bp,编码704个氨基酸,推测相对分子量为72.92 kD,等电点6.86。不同器官表达谱分析结果显示,AhARF3为组成性表达,茎中的表达量最高,根与花中的表达量较低且近似,干种子中最低。种子萌发过程的表达分析显示,萌发10~72 h 的种子中AhARF3表达量均比干种子中极显著增加,尤其是萌发48~72 h,AhARF3的表达水平不仅比萌发前期各阶段种子中的大幅上调,与根、茎、叶、花及各发育阶段的种子相比,也具有明显的表达优势。
关键词:花生;生长素响应因子;基因表达;萌发
中图分类号:S565.2:Q785文献标识号:A文章编号:1001-4942(2019)09-0050-06
Cloning and Expression Analysis of AhARF3 Gene in Peanut
Tang GuiyingCui Weipei2, Xu PingliLi Pengxiang2, Zhu Jieqiong2, Shan Lei2
(1. Biotechnology Research Center, Shandong Academy of Agricultural Sciences/Shandong Provincial Key
Laboratory of Crop Genetic Improvement, Ecology and Physiology, Jinan 250100, China; 2. College of Life Sciences,
Shandong Normal University, Jinan 250014, China)
Abstract Auxin response factor (ARF) is a kind of important transcription factor in regulating the expression of auxin response genes and signal transduction, which is involved in various development processes in plant. In this study, the cDNA of AhARF3 gene was cloned and analyzed based on the comparative analysis of transcriptomic data between dry seeds and newly germinated seeds. Sequence analysis results showed that the ORF length of AhARF3 was 2 115 bp, which encoded 704 amino acids, and the relative molecular weight was estimated to be 72.92 kD and the isoelectric point was 6.86. The results of qRT-PCR showed that AhARF3 was expressed by the constitutive type, the expression level was the highest in stems and the lowest in dry seeds. The expression level of AhARF3 in seeds germinated for 10~72 hours was significantly higher than that in dry seeds, especially 48~72 hours after germination, and was not only significantly higher than that in pre-germination stage, but also had obvious expression advantages compared with roots, stems, leaves, flowers and seeds at the other developmental stages.
Keywords Peanut (Arachis hypogaea L.); Auxin response factor (ARF); Gene expression; Germination
生長素响应因子(auxin response factor, ARF)是一类能够调节生长素响应基因表达的转录因子,它通过特异性识别并结合生长素应答元件,激活或抑制基因的表达[1]。ARF蛋白一般包含3个结构域:N端的B3类DNA结合域(DNA binding domain, DBD)、中间的MR结构域-抑制结构域(repression domain, RD)或激活结构域(activation domain, AD)和C端的二聚化作用的结构域(carboxy-terminal dimerization domain, CTD)[2]。ARF的功能与植物细胞内生长素的浓度密切相关,当生长素浓度较低时,生长素响应基因Aux/IAA与ARF形成异源二聚体,ARFs的作用被抑制;当生长素浓度升高到一定水平,Aux/IAA经泛素化途径快速降解,ARFs被释放并与生长素响应元件TCGTCTC结合,生长素响应基因被激活或抑制,植物体随之发生一系列生长素反应[3]。
植物基因组中ARF家族成员众多,随着大量物种基因组测序的完成和基因功能分析的深入,越来越多的ARF基因家族成员被鉴定和研究,如拟南芥[4]、水稻[5]、番茄[6]、杨树[7]、葡萄[8]等。ARF参与植物生长发育的各个生物学过程。在营养生长期,它影响叶片的生长发育[9]、侧根的发生[10]、维管组织的形成[11]等;在生殖生长期,对花器官的形成、雌蕊的生长模式、胚珠的发育等方面具有重要作用[12-14]。另有研究表明,拟南芥中ARF10、ARF16和ARF17的表达水平与种子休眠性呈正相关[15]。
本研究基于丰花1号花生干种子与萌发露白期种子转录组的差异表达分析,发现AhARF3在萌发露白期种子中的表达水平显著高于干种子,推测该基因在花生种子萌发过程中起重要作用,继之对该基因进行克隆与表达谱分析,以期为AhARF3的生物学功能研究提供基础。
1 材料与方法
1.1 植物材料
花生品种:丰花1号由本实验室保存,种植于山东省农业科学院饮马泉试验田。出苗20 d左右取根、茎、葉;盛花期间取盛开花朵,并把细塑料绳绑系于即将入土的果针基部,分别于入土10、20、30、40、50、60、70 d取不同发育时期的种子;待成熟饱满种子吸涨后,置于25℃培养,取萌发4、10、16、24、32、48、72 h的种子。所取样品均经液氮速冻,-80℃保存备用。
1.2 菌株及质粒
大肠杆菌DH5α(Escherichia coli)和pEASY-T1[JP] Simple克隆载体,购自北京全式金生物技术有限公司。
1.3 主要试剂
Quick RNA isolation Kit,购自北京华越洋生物科技有限公司;PrimeScriptTM 1st Strand cDNA Synthesis Kit,购自宝生物工程(大连)有限公司;2×[JP]TransTaq High Fidelity(HiFi)PCR SuperMixⅡ(-dye)和TransStart Tip Green qPCR SuperMix,购自北京全式金生物技术有限公司;琼脂糖凝胶回收试剂盒和DNA分子量标准,购自上海捷瑞生物技术有限公司;PCR扩增引物,由生工生物工程(上海)股份有限公司合成;DNA序列测定由山东省农业科学院测序中心完成;其余生化试剂均为国产或进口分析纯。
1.4 AhARF3基因的cDNA克隆
以萌发露白的种子为材料,利用Quick RNA isolation Kit提取总RNA,参照PrimeScriptTM 1st Strand cDNA Synthesis Kit说明方法反转录合成cDNA第一条链。依据转录组数据库中ESTs参考序列设计ORF(open reading frame)区扩增引物AhARF3-F(5′-TTCTCATGGCGGGTTTGATTG-3′)、AhARF3-R:(5′-CCAGTGATCATCGCTAACATGC-3′)。参照PCR SuperMixⅡ说明书进行相关PCR反应,将产物经0.9%琼脂糖凝胶电泳分析、胶回收试剂盒回收后, 25℃条件下连接到克隆载体pEASY-T1 Simple上,转化并经菌落PCR检测,再送至本单位测序中心测序。
1.5 AhARF3基因的序列分析
利用http://web.expasy.org/protparam/ 在线分析AhARF3基因编码蛋白的氨基酸组成、理论分子量和等电点;蛋白序列的跨膜区分析和信号肽分析分别利用TMHMM 2.0软件(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP 5.0软件(http://www.cbs.dtu.dk/services/SignalP/)进行。AhARF3蛋白的亚细胞定位利用CELLO (http://cello.life.nctu.edu.tw) 进行预测。系统进化树构建利用MEGA 6.0完成,采用Neighbor-Joining法进行1 000次Boot-strap分析。
1.6 AhARF3基因的表达模式分析
以花生根、茎、叶、花、不同发育时期种子以及不同萌发时期种子为材料,提取总RNA,并反转录合成cDNA第一条链,利用实时荧光定量PCR方法,以qRT-PCR-ARF3-F(5′-GGGAAAGCTCAGGAAGGAAAA-3′)和qRT-PCR-ARF3-R(5′-CTCTCGGCTCTGATCTTGAATC-3′)为引物,[JP3]以UBI2(qRT-PCR-UBI-F:5′-AAGCCGAAGAAGATCAAGCAC-3′和qRT-PCR-UBI-R:5′-GGTTAGCCATGAAGGTTCCAG-3′)为内参基因。[JP]反应体系、PCR程序和相对表达量计算方法参照唐桂英等[16]的方法进行。
2 结果与分析
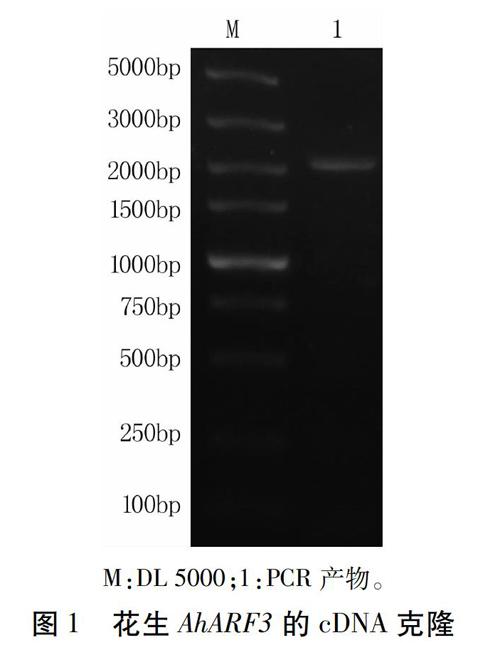
2.1 AhARF3基因cDNA克隆
以丰花1号萌发露白种子第一链cDNA为模板,利用特异引物AhARF3-F和AhARF3-R扩增到2 100 bp左右的条带(图1)。经克隆测序分析,获得一条包含ORF为2 115 bp的cDNA序列,命名为AhARF3。将该基因序列在花生基因组数据库(https://www.peanutbase.org/blast)中在线比对,发现该基因定位于栽培种花生B染色体组中。
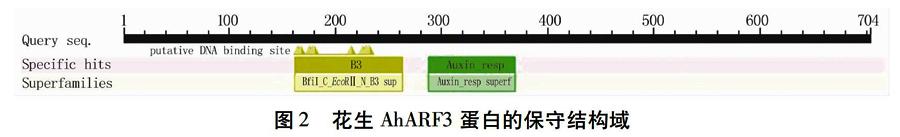
2.2 AhARF3基因及编码氨基酸序列分析
基因序列分析表明:AhARF3编码704个氨基酸,推测相对分子量为72.92 kD,等电点6.86。利用NCBI网站中CDD(Conserved Domain Database)数据库对AhARF3蛋白进行保守结构域分析,结果(图2)显示,AhARF3蛋白含有B3 DNA结合结构域(DBD)和ARF结构域Auxin_resp,符合ARF的结构特点。非保守区(MR)含量丰富的氨基酸为Ser 13.9%、Gly 9.4%、Pro 6.2%。以TMHMM 2.0、CELLO与SignalP 5.0软件分析,显示AhARF3没有跨膜区,为核内蛋白。
2.3 AhARF3氨基酸比对与系统分析
设苔藓类植物地钱(Marchantia polymorpha)為外类群,利用MEGA 6.0软件,对本研究克隆得到的AhARF3和GenBank数据库中33种高等植物(表1)ARF3的氨基酸序列构建Neighbor-Joining系统进化树(图3)。结果显示,系统树中高等植物聚成单子叶植物和双子叶植物两大分支。花生AhARF3与大豆、菜豆、蒺藜苜蓿等豆科植物聚在一个亚分支,同源性较高,其中与相思豆和大豆氨基酸序列相似率分别为75%、72%;而与苹果、拟南芥、烟草等所在分支亲缘关系较远,与拟南芥ArathARF3序列一致性为57%。该基因编码的氨基酸序列与单子叶植物水稻OrysaARF3的相似性仅为49%(图3)。
将花生AhARF3氨基酸序列与大豆、拟南芥和水稻等直系同源基因编码的GlymaARF3、ArathARF3和OrysaARF3等氨基酸序列进行比对,结果(图4)显示,B3 DNA结合结构域在不同物种间的保守性很强,一致性达96.73%;Auxin_resp结构域的保守性则较弱。
2.4 花生AhARF3基因表达分析
以UBI2为内参基因,对AhARF3基因在根、茎、叶、花、不同发育时期种子以及不同萌发时段的种子进行qRT-PCR分析。结果(图5)显示,AhARF3在花生根、茎、叶、花和干种子中均有表达,但表达水平存在差异。茎中的表达量最高,根与花中的表达量较低且近似,干种子中最低。
由图6可知,AhARF3在花生种子发育早中期表达量较高,随着种胚发育成熟度的提高,表达水平呈下降趋势;在收获晾干的种子中表达量最低。
萌发4 h的种子AhARF3基因表达水平与干种子相当,随着萌发时间的延长,其表达水平呈增长趋势,萌发10 h后即极显著高于干种子;萌发72 h时其表达量是所研究萌发过程中的最高水平,比干种子提高约100倍(图7)。另外,通过比较不同组织、不同发育时期种子与吸水萌发种子的相对表达水平,发现AhARF3基因在萌发48~72 h种子中的表达量明显高于根、茎、叶、花及不同发育时期的种子。
3 讨论与结论
ARF作为参与生长信号转导的重要转录调控因子,在调节植物生长发育过程中起重要作用。随着测序技术与分子生物学技术的快速发展,许多植物中ARF被鉴定与研究。花生作为重要的经济作物与油料作物,基因组测序开展相对较晚,关于花生ARF的研究鲜有报道。本研究从萌发露白花生种子中克隆到AhARF3基因,经生物信息学分析证明AhARF3属于ARF家族。ARF的非保守区域(MR)富含氨基酸种类的不同往往决定其转录活性,拟南芥ARF蛋白转染试验证明,AtARF1~4和AtARF9蛋白非保守中间区域富含脯氨酸,具有转录抑制活性;而AtARF5~8和AtARF19非保守区富含谷氨酰胺,具有转录激活活性[ 17]。本研究中,花生AhARF3的非保守区含量最高的氨基酸为丝氨酸、甘氨酸和脯氨酸。并且,该蛋白与拟南芥中转录抑制子AtARF3的氨基酸序列都包含B3 DNA结合结构域、Auxin_resp结构域,缺失Aux/IAA结构域,推测该转录因子可能具有转录抑制作用。
已有研究表明,ARF基因在多种植物组织、器官中表现出组成性和冗余性表达的特点[18]。以往对石榴、黄瓜ARF基因家族的组织表达分析发现,绝大多数的ARF基因在不同组织中均有表达,说明它们在植物中具有广泛的调控作用[19,20]。本研究中,AhARF3在花生根、茎、叶、花和不同发育时期种子中均有表达,暗示该基因在植物各组织器官形成与生长发育过程中起重要的调控作用。
生长素是重要植物激素之一,对向性生长、组织分化等过程的调控已有大量深入研究。另有研究证实,其对种子休眠也有重要影响。过量表达ARF10与ARF16的转基因拟南芥种子休眠性比对照显著增强[21],而通过过量表达MIR160降低靶标基因ARF10、ARF16和ARF17表达水平,转基因种子休眠程度则比野生对照显著降低[15],表明种子内生长素信号强度发生变化时,其休眠水平会受到影响。拟南芥中ARF3基因发生突变时,花器官形态畸形,表现为花被数目增多、雄蕊数目减少、雌蕊形态异常等,表明该基因在花芽分化及维持花器官形态方面起重要作用[22]。解剖学观察发现花生的花芽分化发生在种子萌发后期[23],而本研究中,种子吸水萌发48~72 h时AhARF3的表达量急剧增加,与干种子相比提高几十甚至上百倍,因此,花生AhARF3是否也参与了种子萌发后期花芽分化过程的调控,还需更加细致的表达分析与功能鉴定。
参 考 文 献:
[1]Tiwari S B, Hagen G, Guilfoyle T, et al. The roles of auxin response factor domains in auxin-responsive transcription[J].The Plant Cell, 2003, 15(2): 533-543.
[2]Guilfoyle T J, Hagen G. Auxin response factors[J].Current Opinion in Plant Biology, 2007, 10(5): 453-460.
[3]Gray W M,Kepinski S,Rouse D,et al.Auxin regulates SCFTIR1-dependent degradation of AUX/IAA proteins[J].Nature, 200414(6861): 271-276.
[4]Remington D L, Vision T J, Guilfoyle T J, et al. Contrasting modes of diversification in the Aux/IAA and ARF gene families[J].Plant Physiology, 2004, 135(3): 1738-1752.
[5]Wang D K, Pei K M, Fu Y P, et al. Genome-wide analysis of the auxin response factors(ARF) gene family in rice(Oryza sativa)[J].Gene, 2007, 394(1/2): 13-24.
[6]Wu J, Wang F Y, Cheng L, et al. Identification, isolation and expression analysis of auxin response factor(ARF) genes in Solanum lycopersicum[J].Plant Cell Reports, 20130: 2059-2073.[JP]
[7]Kalluri U C, Difazio S P, Brunner A M, et al. Genome-wide analysis of Aux/IAA and ARF gene families in Populus trichocarpa[J].BMC Plant Biology, 2007, 7: 59.
[8]Wan S B, Li W L, Zhu Y Y, et al. Genome-wide identification, characterization and expression analysis of the auxin response factor gene family in Vitis vinifera[J].Plant Cell Reports, 2014, 33(8): 1365-1375.
[9]Iwasaki M, Takahashi H, Iwakawa H, et al. Dual regulation of ETTIN(ARF[STBX]3[STBZ]) gene expression by AS1-AS2, which maintains the DNA methylation level, is involved in stabilization of leaf adaxial-abaxial partitioning in Arabidopsis[J].Development, 2013, 140(9): 1958-1969.
[10] Okushima Y, Overvoorde P J, Arima K, et al. Functional genomic analysis of the auxin response factor gene family members in Arabidopsis thaliana: unique and overlapping functions of ARF7 and ARF9[J].The Plant Cell, 2005, 17(2): 444-463.
[11] Hardtke C S, Berleth T. The Arabidopsis gene MONOPTEROS encodes a transcription factor mediating embryo axis formation and vascular development[J].The EMBO Journal, 1998, 17(5): 1405-1411.
[12] Nagpal P, Ellis C M, Weber H, et al. Auxin response factors ARF6 and ARF8 promote jasmonic acid production and flower maturation[J].Development, 2005, 135(18): 4107-4118.
[13] Ellis C M, Nagpal P, Young J C, et al. ARF1 and ARF2 regulate senescence and floral organ abscission in Arabidopsis thaliana[J].Development, 2005, 132(20): 4563-4574.
[14] Wu M F, Tian Q, Reed J W. Arabidopsis microRNA167 controls patterns of ARF6 and ARF8 expression and regulates both female and male reproduction[J].Development, 2006, 133(21): 4211-4218.
[15] Liu X D, Zhan H, Zhao Y, et al. Auxin controls seed dormancy through stimulation of abscisic acid signaling by inducing ARF-mediated ABI3 activation in Arabidopsis[J].Proc. Natl. Acad. Sci. U. S. A., 2013, 110(38): 15485-15490.
[16] 唐桂英, 王芳, 徐平麗, 等. 花生AhFAD2-2基因的克隆与表达分析[J].山东农业科学, 2018, 50(6): 27-34.
[17] Ulmasov T, Hagen G, Guilfoyle T J. Activation and repression of transcription by auxin-response factors[J].Proc. Natl. Acad. Sci. USA, 1999, 96: 5844-5849.
[18] Su Z X, Wang L L, Li W M, et al. Genome-wide identification of auxin response factor(ARF) genes family and its tissue-specific prominent expression in pineapple[JP] (Ananas comosus)[J].Tropical Plant Biology, 2017, 10(2/3): 86-96.
[19] 黄贤斌, 张太奎, 刘翠玉, 等. 石榴ARF基因家族鉴定及表达分析[J].果树学报, 2019, 36(1): 43-55.
[20] Liu S Q, Hu L F. Genome-wide analysis of the auxin response factor gene family in cucumber[J].Genetics and Molecular Research, 2013, 12(4): 4317-4331.
[21] Liu P P, Montgomery T A, Fahlgren N, et al. Repression of AUXIN RESPONSE FACTOR10 by microRNA160 is critical for seed germination and post-germination stages[J].Plant Journal, 2007, 52(1): 133-146.
[22] Sessions A, Nemhauser J L, McColl A, et al. ETTIN patterns the Arabidopsis floral meristem and reproductive organs[J].Development, 1997, 124(22): 4481-4491.
[23] 王福青, 王銘伦. 花生花芽分化的形态解剖学研究[J].中国油料作物学报, 2000, 22(2): 41-44.
收稿日期:2019-08-16
基金项目:山东省农业科学院农业科技创新工程项目(CXGC2018E13)
作者简介:唐桂英(1978—),女,硕士,副研究员,研究方向:植物分子遗传。E-mail: guiyingtang88306@163.com
通讯作者:单雷(1965—),女,博士,研究员,研究方向:植物分子遗传。E-mail: shlei1025@sina.com
