非洲猪瘟病毒结构蛋白p54的原核表达与反应原性鉴定
2019-12-06官丽娟任伟杰宫枫举韩同福邹艳丽孙学强吴晓东黄保续
官丽娟 ,邵 钰,任伟杰,宫枫举,韩同福,邹艳丽,孙学强,,吴晓东,张 志,,黄保续
(1.青岛立见诊断技术发展中心,山东青岛 266114;2.中国动物卫生与流行病学中心,山东青岛 266032)
非洲猪瘟(African swine fever,ASF)是一种由非洲猪瘟病毒(African swine fever virus,ASFV)引起的急性、热性、烈性动物传染病,病死率高达100%[1],严重危及养猪业发展。世界动物卫生组织(OIE)将其列为法定报告疫病,我国将其列为一类传染病[2]。ASFV 是一种大型的胞质内复制的病毒,由核质体、核衣壳、内层囊膜和外层囊膜构成。ASFV 基因组庞大,可达171~193 kb,有150多个主要开放阅读框,编码约200种蛋白[3],其中抗原性较强的结构性蛋白主要为p54、p220、p62、p72、p32以及CD2v 等[4]。研究发现,由基因E183L编码的p54蛋白抗原性较好,它在快速入侵、吸附易感细胞中发挥很大作用,且病毒进入机体后可产生针对于该蛋白的抗体[5-7]。因此,一些学者针对p54蛋白建立了ASFV 抗体检测方法,用于ASFV 感染动物血清的监测[8-9]。2018年8月,我国报告首例ASF 疫情,随后又陆续暴发超百起疫情,给我国养猪业带来了巨大损失[10-11]。尽管国内外已有许多研究报道了p54蛋白编码基因的表达,但其均是基于国外毒株开展的研究。本研究拟以我国暴发流行的ASFV(AnhuiXCGQ)作为研究对象,通过密码子优化后,用原核表达的方法,表达E183L基因的整个CDS 区,以期深入研究我国ASFV 流行毒株p54蛋白的抗原特性,并以此为基础建立相应的血清学诊断方法。
1 材料与方法
1.1 样品来源
ASFV 抗原、ASFV 阳性核酸和阳性血清,均由中国动物卫生与流行病学中心验证和提供。
1.2 主要试剂
Ex-Taq酶、BL21(DE3)感受态细胞、限制性内切酶NdeI 和HindⅢ,购自TaKaRa 生物技术有限公司;pET-30a(+),购自Novogen 公司;小量质粒提取试剂盒,购自天根生物有限公司。
1.3 p54基因特异性引物设计和序列扩增
根据GenBank 中ASFV 中国株(China 2018/AnhuiXCGQ)p54基因序列[12-13],设计合成1对针对整个蛋白质编码区(CDS 区)的特异性PCR扩增引物。上游引物为:5'-CATATGATGGATTCT GAATTTTTTCA-3';下游引物为:5'-AAGCTTTTA CAAGGAGTTTTCTAGGT-3'。扩增E183LCDS 区片段,使扩增目的基因长度为552 bp。扩增程序采用:94 ℃ 1 min,95 ℃ 10 s,56 ℃ 60 s,72 ℃ 60 s,35个循环;72 ℃ 10 min。在这对引物的5'端分别添加限制性内切酶NdeI 和HindⅢ 酶切位点,然后以ASFV 阳性核酸为模板进行核酸扩增;将扩增完的条带切胶后,通过DNA 纯化回收试剂盒回收,送生物公司测序,同时与E183L基因序列作比对。
1.4 pET-30a(+)-p54重组表达载体构建
上述扩增的p54 PCR 产物与pET-30a(+),同时用限制性内切酶NdeI 和HindⅢ 进行双酶切,用DNA 纯化回收试剂盒回收目的条带;通过T4 DNA 连接酶,将双酶切过的p54与pET-30a(+)表达载体连接过夜,然后转化至大肠杆菌BL21(DE3)感受态细胞,并分别用p54基因对应的上述引物进行菌液PCR 鉴定。同时,将挑选出的阳性克隆菌株,通过小量质粒提取试剂盒提取质粒后,通过限制性内切酶NdeI 和HindⅢ 进行双酶切鉴定。
1.5 p54蛋白表达
取50 μL pET-30a(+)-p54阳性菌液按1:1 000接种到5 mL 含卡那霉素的LB 培养液中,37 ℃振荡培养过夜;以1:100比例,将扩增好的菌液接种到LB 培养液中培养;当培养液中的OD 值为0.5时,加IPTG 至终浓度0.8 mmol/L,37 ℃条件下继续诱导表达5 h;将培养物离心,弃去上清,加入蛋白质裂解液进行裂解;继续离心,分别取上清液和沉淀进行SDS-PAGE 电泳分析。
1.6 p54表达蛋白纯化
根据1.5中蛋白表达的结果,取上清液进一步通过His 亲和层析柱亲和纯化重组p54蛋白。
1.7 可溶性表达蛋白鉴定
将纯化好的重组p54蛋白进行SDS-PAGE 凝胶电泳。电泳结束后进行Western Blot:将蛋白凝胶转印至PVDF 膜,以5%脱脂奶粉封闭;将ASFV 阳性血清1:800倍稀释后孵育1 h,洗涤5次;以HRP 标记的抗猪二抗1:2 000稀释后孵育1 h,洗涤5次;最后加入DAB 显色,观察重组p54蛋白的反应原性。
2 结果
2.1 p54蛋白目的基因扩增
以ASFV 核酸为模板,用本研究设计的1对引物进行PCR 扩增,可以扩增出大小为552 bp 的特异性条带(图1)。扩增结果显示,该条带序列与GenBank 中ASFV p54基因同源性为100%,表明扩增片段确为ASFV 的p54基因序列。

图1 目的基因扩增结果
2.2 重组质粒pET-30a(+)-p54构建
对扩增得到的p54特异性片段与pET-30a(+)载体进行NdeI 和HindⅢ 双酶切,经过连接、转化、蓝白斑筛选后,挑选了8个白色菌落,摇菌后进行PCR 鉴定,结果发现8个白色菌落中有6个为阳性,特异性条带大小为552 bp(图2)。选出2个阳性克隆菌进行质粒提取,通过NdeI 和HindⅢ 双酶切鉴定,结果发现有5 kb 和0.5 kb 大小左右的特异性条带(图3)。
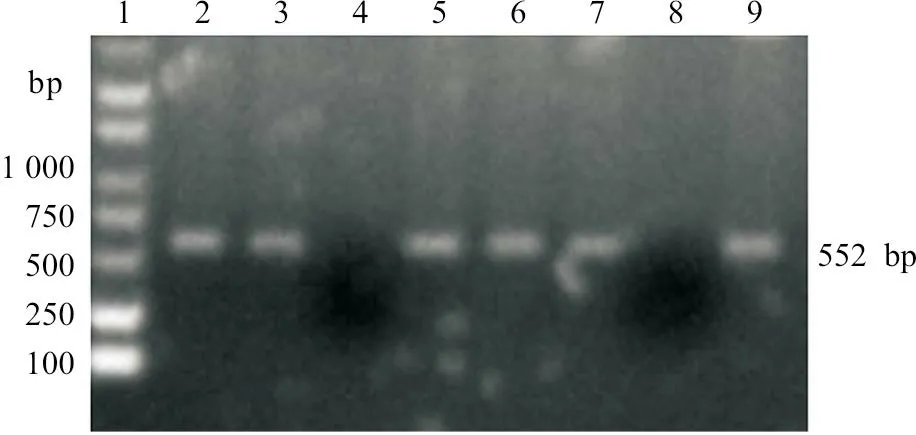
图2 重组质粒pET-30a(+)-p54琼脂糖凝胶电泳分析图
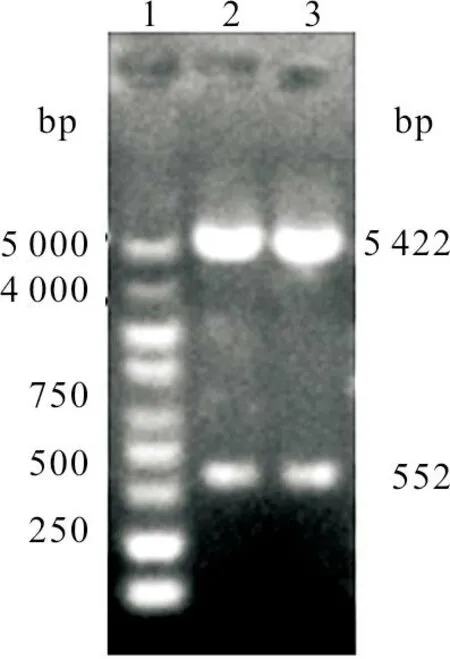
图3 重组质粒pET-30a(+)-p54双酶切鉴定结果
2.3 p54蛋白表达
重组原核表达质粒pET-30a(+)-p54转化感受态细胞BL21(DE3)后,为确定重组质粒的表达水平,采用两种不同的诱导和表达方式,即分别经过15 ℃诱导表达16 h 和37 ℃诱导表达4 h,再取上清和沉淀分别进行SDS-PAGE 凝胶电泳分析。结果可见,两种诱导表达方式的上清和全菌中均出现一条分子量约为20 kDa 的特异性条带(图4),说明两种诱导方式都可以表达p54蛋白。其中,p54在37 ℃诱导表达4 h 比15 ℃诱导表达16 h 产生的蛋白量明显增高,p54蛋白在上清中的含量比在沉淀中明显增高。
2.4 p54蛋白纯化与鉴定
用His 亲和层析柱纯化37 ℃诱导表达后的细菌上清,对纯化的蛋白进行SDS-PAGE 凝胶电泳分析,发现纯化的蛋白与预期蛋白大小一致,约为20 kDa 且纯度可达95%以上;进一步用Western Blot 进行鉴定,结果发现重组p54蛋白和阳性ASFV 抗原均与ASFV 阳性血清发生特异性反应,在20 kDa 处可以看到一条特异性棕黄色条带,且阴性样本不与ASFV 阳性血清发生反应(图5)。
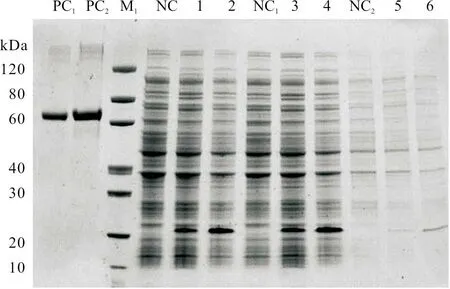
图4 p54蛋白的表达鉴定结果
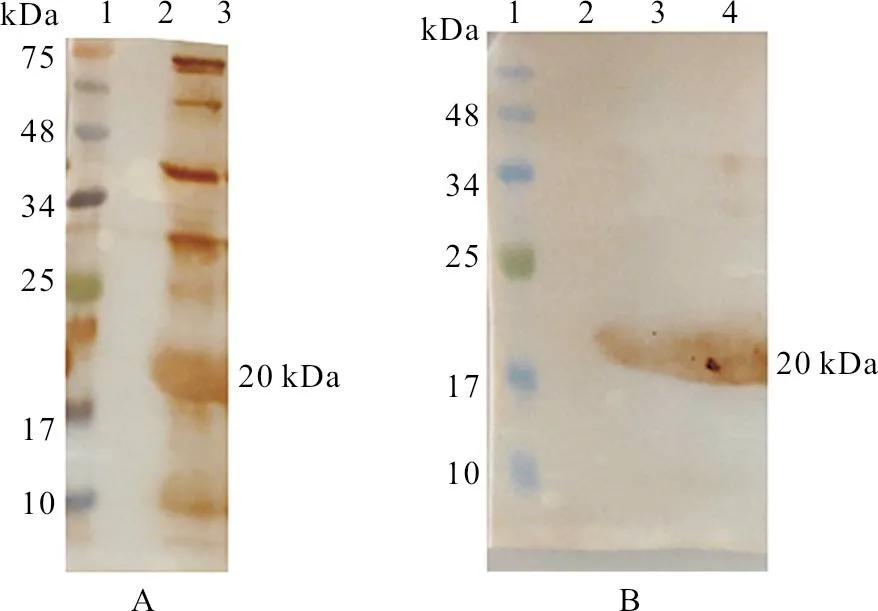
图5 p54蛋白纯化与鉴定结果
3 讨论
目前针对ASF 防控尚无有效的商品化疫苗,因此ASF 疫情的监测与诊断变得至关重要。根据OIE 和我国ASF 诊断技术国家标准,实验室检测ASFV 方法有血清学方法和病原学方法:血清学方法主要有间接酶联免疫吸附实验、阻断酶联免疫吸附试验和间接荧光抗体试验法;病原学检测方法有直接免疫荧光法、双抗体夹心ELISA 法、普通PCR 法和荧光PCR 法。我国在最新公布的《非洲猪瘟疫情应急实施方案(2019年版)》中指出,双抗体夹心酶联免疫吸附试验、聚合酶链式反应和实时荧光聚合酶链式反应等方法是检测ASFV 的病原学检测方法。
对ASFV 基因组分析表明,p54、p220、p62、p72、p32、CD2v、A104R、B602L、K205R等12种蛋白具有强抗原性,特别是p54、p72、p32、CD2v 等4种蛋白产生的抗体滴度较高,是检测ASFV 比较好的候选抗原成分[4]。Barderas 等[14]将具有强抗原表位的p54/p30嵌合在一起,结果证明其免疫原性和抗原性都很强。龚振华等[8]参考ASFV Con09/Bzz020株原核高效表达p54蛋白,并将其应用于ASF ELISA 检测中。冯春燕等[15]参考NCBI 中ASFV 的E75(GenBank:FN557520.1)毒株的p54基因序列,原核表达p54蛋白并成功制备p54单克隆抗体,进一步为ASFV ELISA 诊断技术的开发奠定了基础。梁云皓等[16]利用Bac-to-Bac 杆状病毒表达系统表达ASFV p54蛋白,并通过Western Blot 证明其具有良好的抗原性。
基于以上研究,为避免形成包涵体和p54蛋白反应原性丢失,本研究根据GenBank 序列号ASFV(MK128995)通过密码子优化后,将E183L基因的CDS 区进行克隆表达,这不仅保留了完整的E183L基因表达产物,并且通过密码子优化,选择优于大肠杆菌表达的碱基,大大提高了p54蛋白的表达量。结果表明,本研究的表达策略是成功的。利用该方法,成功用原核表达载体pET-30a(+)获得了可溶性的p54抗原;经过Western Blot 鉴定后,发现纯化的p54可以与ASFV 阳性血清发生特异性反应;用BCA 蛋白测定方法,测定其浓度高达4 mg/mL,且纯化效率高。本研究为ASF ELISA诊断试剂的开发提供了参考。
