壳聚糖-柑橘精油微胶囊制备工艺优化及其在凡纳滨对虾保鲜中的应用*
2019-12-06姚洁玉江杨阳陈士国胡亚芹
姚洁玉 李 苑 江杨阳 陈士国 胡亚芹
壳聚糖-柑橘精油微胶囊制备工艺优化及其在凡纳滨对虾保鲜中的应用*
姚洁玉 李 苑 江杨阳 陈士国 胡亚芹①
(浙江大学生物系统工程与食品科学学院 馥莉食品研究院 智能食品加工技术与装备国家(地方)联合实验室 农业农村部农产品产后处理重点实验室 农业农村部农产品营养功能评价实验室 浙江省农产品加工技术研究重点实验室 浙江大学宁波研究院 杭州 310058)
本研究分别以壳聚糖浓度、乳化剂用量和三聚磷酸钠用量为指标进行单因素试验,以粒径、PDI和Zeta电位为指标进行分析,制备壳聚糖-柑橘精油微胶囊。以挥发性盐基氮(TVB-N)值、SDS-PAGE电泳、硫代巴比妥酸值(TBA)和菌落总数(TVC)为指标分析壳聚糖-柑橘精油微胶囊在凡纳滨对虾()4℃贮藏过程中对其品质的影响。结果显示,与对照组相比,壳聚糖-柑橘精油微胶囊处理组可以明显抑制TVB-N值、TBA值和TVC值增长(<0.05);SDS-PAGE图谱也显示实验组的肌球蛋白重链分解更慢。说明在4℃冷藏条件下,壳聚糖-柑橘精油微胶囊能够有效地抑制蛋白质的变性、脂肪的酸败和微生物的增长,从而延缓凡纳滨对虾腐败变质,延长凡纳滨对虾货架期3~4 d。
凡纳滨对虾;壳聚糖-柑橘精油微胶囊;品质;保鲜
凡纳滨对虾()是世界上养殖产量最高的三大虾类品种之一(曹荣等, 2009)。 凡纳滨对虾味道鲜美,营养丰富,深受广大消费者的喜爱,现已成为中国养殖虾类的主要品种(袁丽等, 2011)。凡纳滨对虾丰富的营养物质极易被微生物利用而导致腐败,货架期短是影响凡纳滨对虾销售流通的突出问题。
随着人们对食品的口感、安全性、营养性等重视程度的提高,生物保鲜剂的应用越来越广泛,这些保鲜剂不仅可以抑制细菌生长、抗氧化而且相对安全。单一生物保鲜剂的作用相对局限,2种或2种以上协同作用可以大大降低单一保鲜剂的用量,提高保鲜效率。倪渠峰(2014)用茶多酚结合壳聚糖处理冷藏大黄鱼(),发现茶多酚和壳聚糖能延缓肌肉蛋白质中疏水基团的暴露和巯基的氧化,从而抑制大黄鱼肌原纤维蛋白的变性,控制组织微观结构的劣变。毕海丹等(2016)用茶多酚和乳清蛋白对冷藏鱼糜进行保鲜处理,结果显示,茶多酚和乳清蛋白共同作用对蛋白氧化和脂肪氧化的抑制效果都优于单独添加茶多酚或乳清蛋白。
壳聚糖(Chitosan)是甲壳素脱乙酰产物,由α-氨基-D-葡胺糖通过β-1,4-糖苷键连接而成的天然多糖。Gooday等(1986)的研究表明,壳聚糖具有广谱抑菌作用和抗氧化作用;壳聚糖对假单胞菌、肠杆菌、沙门氏菌等革兰氏阴性菌,以及金黄色葡萄球菌、乳酸菌、单核细胞增生李斯特菌等革兰氏阳性细菌和酵母菌均具有抑制作用(No, 2002; Jeon, 2001);0.5%和1%的壳聚糖投喂花鲈()可以增强花鲈的溶菌酶活性和吞噬活性(常青等, 2006)。柑橘精油是柑橘果皮中提取的一种精油,有比较强的抑菌效果和抗氧化性。柑橘油不仅对酵母、霉菌和产孢子细菌有抑菌作用,对食品产毒细菌也有抗菌效果(Palhano, 2004)。
微胶囊产品可通过预先设计的壁材溶解时间和释放曲线,在规定的时间以一定的速率释放芯材物质。在食品工业中,微胶囊化用以保持被包埋物质的生理活性,保护敏感性成分。曾治平(2010)用复凝聚法将叶黄素微胶囊化,提高了叶黄素的稳定性,能更加方便的贮藏和应用。韩宁(2006)发现,微胶囊能够大大提高β-胡萝卜素的稳定性,减缓降解速率。郭爱莲等(1994)发现,将苯甲酸钠用β-环状糊精包埋成微囊后,能显著延长产品的货架期。肉桂醛经喷雾干燥制备成微胶囊后可以延长其抗菌作用时间(武伟等, 2002)。
本研究以具有良好成膜性兼具抗菌性的壳聚糖作为壁材,以具有抗氧化性、抗菌性的柑橘精油作为芯材,制备壳聚糖-柑橘精油微胶囊,并考察了壳聚糖浓度、乳化剂用量和三聚磷酸钠用量对粒径、PDI (Polydispersity Index分散指数)及Zeta电位的影响,在此基础上得到优化的微胶囊制备条件,并研究了壳聚糖-柑橘精油微胶囊对凡纳滨对虾贮藏过程品质的影响。
1 材料与方法
1.1 材料与试剂
凡纳滨对虾购自杭州骆家庄农贸市场,选取大小(15.0±0.5) g的凡纳滨对虾置于碎冰中,于20 min内带回实验室;柑橘精油(法国Florihana公司);吐温80、Na5P3O10(TPP)、醋酸、壳聚糖(脱乙酰度80.0%~95.0%,粘度50~800 cp)、HCl、NaOH、乙醇、硫代巴比妥酸、三氯乙酸、KI、氯仿、NaH2PO4、Na2HPO4、Na2S2O3、冰乙酸等均为国产分析纯。
1.2 仪器与设备
FA2004电子天平,上海良平仪器仪表有限公司;TGL20M台式低速冷冻离心机,湖南凯达科学仪器有限公司;UV-2550紫外分光光度计,日本岛津公司;EPS300电泳仪,上海天能科技有限公司;凯氏定氮装置,郑州市中原科技坡璃仪器厂;磁力搅拌器;粒度分析仪LS-230,美国库尔特公司;Zeta电位分析仪Zetasizer Nano ZS90,英国马尔文公司。
1.3 实验方法
1.3.1 壳聚糖-柑橘精油微胶囊的制备 称取一定浓度的壳聚糖溶于1%的醋酸溶液,磁力搅拌至完全溶解,滴加一定量吐温80,磁力搅拌2 h,用蠕动泵向溶液中加入一定量柑橘精油,磁力搅拌2 h,用蠕动泵以一定速率滴加一定量的TPP溶液,边滴加边用磁力搅拌器搅拌。搅拌12 h,在4000 r/min下离心 30 min,将沉淀在-40℃下冻干备用。
1.3.2 粒径、PDI的测定 使用粒度分析仪进行测量,测量温度为25℃,每个样品取3组平行,数据以平均值±标准差(Mean±SD)表示。
1.3.3 Zeta电位的测定 使用Zeta电位分析仪进行测量,测量温度为25℃,每个样品取3组平行,数据以平均值±标准差(Mean±SD)表示。
1.3.4 样品处理 以1%的醋酸溶液为溶剂,制备1%(/)的微胶囊溶液,将凡纳滨对虾置于溶液中20 min后取出,等待其表面干燥后,置于4℃冰箱贮藏,并定期测量其指标。
1.3.5 挥发性盐基氮(TVB-N)值测定 参照Yerlikaya等(2017)的方法,蒸馏获得均质虾肉末的总挥发性碱,并将这些挥发性碱用0.1mol/L的HCl收集,在Tashiro指示剂(0.2 g甲基红和0.1 g亚甲基蓝溶解于100 ml 95%乙醇)的存在下,用0.1mol/L的NaOH滴定馏出液。计算TVB-N并表示为mg TVB-N/100g样品。
1.3.6 SDS-PAGE电泳 参照Laemmli(1970)的方法,采用SDS-PAGE分析不同处理对虾肉蛋白质的影响。采用10%的分离胶浓度,5%的浓缩胶浓度。电泳完成后,经考马斯亮蓝染色,脱色后观察蛋白质条带的变化。
1.3.7 硫代巴比妥酸值(TBA)测定 参照Vyncke(1975)的方法并有所改动,取10 g碎虾肉,加入50 ml 7.5%的三氯乙酸(含有0.1% EDTA),振摇后静置30 min,用双层滤纸过滤。取5 ml滤液,加入5 ml 0.02 mol/L的TBA溶液,在沸水浴中保存40 min,取出后冷却1 h,在1500 r/min条件下离心25 min,取上清液,加入5 ml氯仿,静置分层后取上清液分别在532 nm和600 nm波长下测定吸光度,用以下公式计算TBA值。
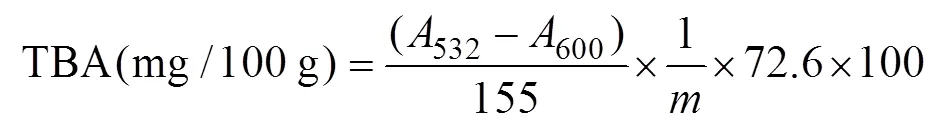
1.3.8 菌落总数(TVC)的测定 参照Saraiva等(2016)的方法,取虾肉5 g,加入45 ml灭菌生理盐水振摇并进行10倍梯度稀释,选择3个合适稀释度的样本匀液,取1 ml样品稀释液于无菌培养皿内。将约15 ml冷至45℃的平板计数琼脂培养基注入培养皿,待琼脂凝固后,翻转平板,置于(36±1)℃恒温箱内,培养72 h后计数。
2 结果与讨论
2.1 壳聚糖浓度对粒径、PDI与Zeta电位的影响
分别使用2.5、5.0、7.5、10.0、15.0和20.0 g/L浓度的壳聚糖溶液制备壳聚糖-柑橘精油微胶囊,柑橘精油添加量为6 g/L,吐温80添加量为3 ml/L,TPP添加量为2 g/L,TPP添加速度为1 mg/min。6个样品粒径、PDI与Zeta电位的测定结果见表1。由表1可以看出,随着壳聚糖浓度的增加,微胶囊的平均粒径增加,PDI增大。粒径是考察微胶囊的一个重要指标,平均粒径反映了微胶囊的大小。PDI反映了微胶囊大小的分布情况,系数越低,表明微胶囊的大小越均匀,微胶囊的粒度分布,随着壳聚糖浓度的增加越来越不均匀。在较低壳聚糖浓度下,壳聚糖和柑橘精油之间有更好的溶解性和相互作用,因此粒度较小(Fan, 2012),随着壳聚糖浓度的增加,溶液中壳聚糖分子增多,使得溶液粘度增加,从而使得微胶囊分布不均匀。Zeta电位也随着壳聚糖浓度的增加而增大,Zeta电位反映了微胶囊溶液胶体体系的稳定程度,Zeta电位数值越大表示溶液稳定性越差,这与形成的微胶囊越来越不均匀有关。随着壳聚糖浓度的增加,载有柑橘精油的微胶囊的Zeta电位增加,是因为壳聚糖带有数量过多的游离正电荷(Katas, 2006)。
表1 不同壳聚糖浓度下粒径、PDI与Zeta电位变化情况

Tab.1 Changes of particle size, PDI and Zeta potential with different chitosan concentration
2.2 乳化剂添加量对粒径、PDI与Zeta电位的影响
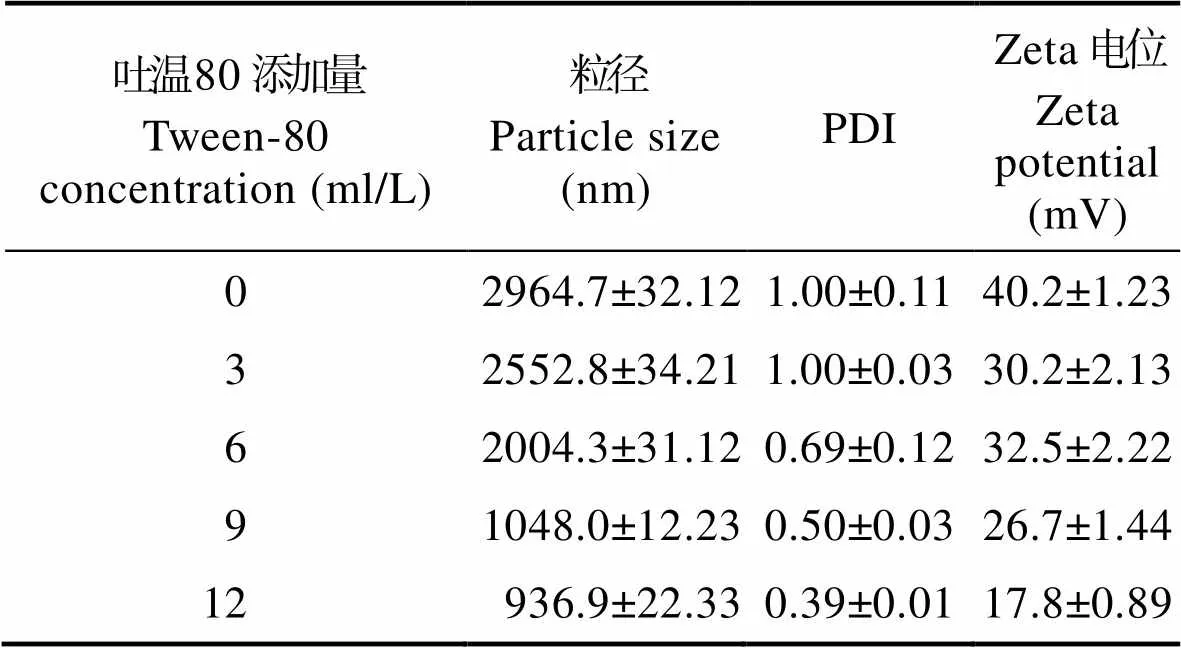
根据1.3的实验方法制备壳聚糖-柑橘精油微胶囊,壳聚糖浓度为10 g/L,TPP添加量为2 g/L,TPP添加速度为1 mg/min,柑橘精油添加量为6 g/L,吐温80添加量分别为0、3、6、9和12 ml/L。5个样品粒径、PDI与Zeta电位的测定结果如表2所示。可以看出,随着乳化剂吐温80的添加量增加,微胶囊的平均粒径减小,粒径分布系数减小,表示溶液中微胶囊粒径分布均匀,Zeta电位也逐渐减小,表明微胶囊溶液较为稳定。这是由于乳化剂使得柑橘精油在溶液体系中分布更为均匀,有利于形成更为分散和稳定的微胶囊体系。
表2 不同乳化剂添加量下粒径、PDI与Zeta电位变化情况
Tab.2 Changes of particle size, PDI and Zeta potential with different emulsifier concentration
2.3 TPP添加量对粒径、PDI与Zeta电位的影响
根据1.3的实验方法,制备壳聚糖-柑橘精油微胶囊。壳聚糖浓度为10 g/L,柑橘精油添加量为6 g/L,吐温添加量为3 ml/L,TPP添加速度为1 mg/min,TPP添加量分别为0.5、1.0、2.0、4.0和8.0 g/L。5个样品粒径、PDI与Zeta电位的测定结果见表3。由表3可以看出,随着TPP的用量增加,微胶囊的平均粒径减小,而PDI无明显变化,Zeta电位呈现出先降低、后升高的趋势。这是由于TPP可以实现壳聚糖微胶囊壁材的凝聚,TPP产生小颗粒,因为它是一个小的聚阴离子分子,与壳聚糖的-NH3+基团形成强烈的离子相互作用。因此,其用量的增加会促进微胶囊体系形成。而TPP用量继续增加,溶液体系稳定性下降,这可能是由于小颗粒聚集在一起并形成团簇所致(Rampino, 2013)。TPP制备的纳米颗粒表现出低Zeta电位,这一结果可能是由TPP与壳聚糖的-NH3+基团之间强烈的交联引起的,-NH3+基团可以中和部分游离电荷从而降低Zeta电位(Csaba, 2009)。综上所述,制备壳聚糖-柑橘精油微胶囊的较优参数是壳聚糖浓度 10 g/L,柑橘精油添加量为6 g/L,吐温添加量为 9 ml/L,TPP添加量为4 g/L,TPP添加速度为1 mg/min。
表3 不同TPP添加量下粒径、PDI与Zeta电位变化情况

Tab.3 Changes of particle size, PDI and Zeta potential with different TPP concentration
2.4 壳聚糖-柑橘精油微胶囊对冷藏凡纳滨对虾TVB-N值的影响
TVB-N是动物性食品的蛋白质在贮藏过程中由于微生物和酶的作用而分解产生的氨以及胺类物质,是反映水产品新鲜程度的主要指标(Benjakul, 2002)。GB 2733-2005规定TVB-N含量不大于30 mg/100 g为可接受范围。由图1可知,新鲜凡纳滨对虾的挥发性盐基氮含量接近7 mg/100 g,属于一级鲜度,这与 刘金昉等(2014)的研究结果一致。贮藏过程中对照组(CK, Control check, 醋酸处理)和实验组(CS-CEOs, Chitosan-citrus essential oil microcapsules, 壳聚糖-柑橘精油微胶囊处理)的TVB-N含量呈上升趋势,用壳聚糖-柑橘精油微胶囊处理的凡纳滨对虾TVB-N值与对照组相比在贮藏第19天时差异显著(<0.05),这与微胶囊抑制了微生物的生长繁殖有关。4℃贮藏17天后,对照组的TVB-N值超过30 mg/100 g。实验组在4℃贮藏22 d后,TVB-N值为27.47 mg/100 g,仍在可接受范围内。Cheng等(2016)的研究表明,茶多酚改性胶原蛋白-壳聚糖复合膜抑制了鱼肉TVB-N值的升高,这与壳聚糖抑制了微生物的生长,延缓了蛋白的变性程度有很大关系。Wu等(2014)研究显示,明胶-牛至精油薄膜可以将鲢鱼的保质期延长至12 d,并推测精油的抗菌性对延长鲢鱼的货架期做出贡献。
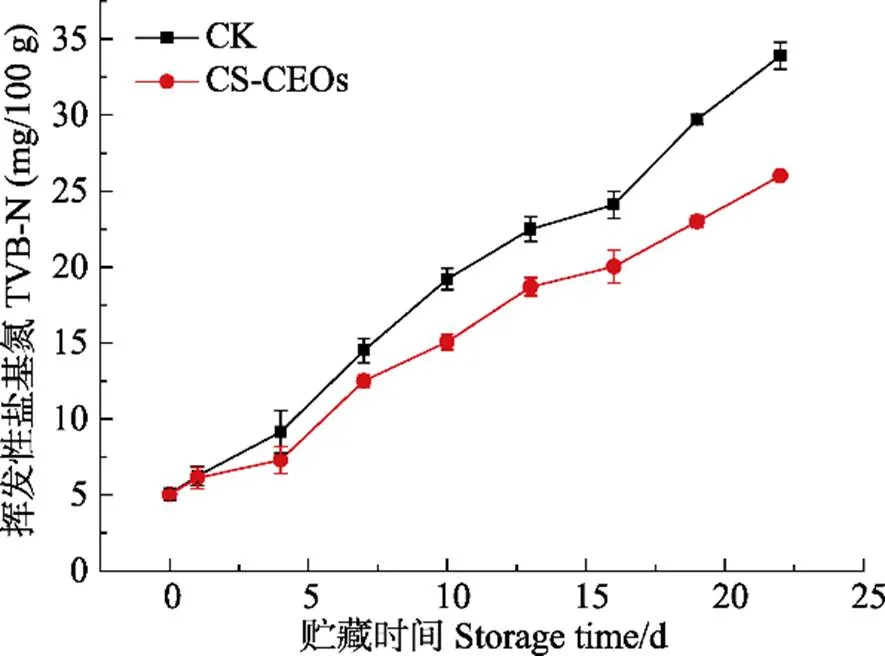
图1 凡纳滨对虾在4℃保藏过程中TVB-N值的变化
CK:醋酸处理;CS-CEOs:壳聚糖-柑橘精油微胶囊处理。下同
CK:Control check;CS-CEOs:Chitosan-citrus essential oil microcapsules. The same as below
2.5 壳聚糖-柑橘精油微胶囊对冷藏凡纳滨对虾SDS- PAGE电泳图谱的影响
如图2所示,随着贮藏时间的延长,对照组肌球蛋白重链条带明显变细,肌球蛋白重链含量明显下降,实验组肌球蛋白重链条带直到第16天都未见明显变化,在第24天出现明显变细现象,可能是因为随着贮藏时间的延长,凡纳滨对虾蛋白质自身的交联被打开,分解成分子量较低的蛋白质或者形成其他交联聚集成更高分子量的蛋白质。实验组与对照组的肌球蛋白轻链都变细且对照组表现更为明显,可能是因为肌原纤维蛋白分子间二硫键、二聚酪氨酸的形成导致蛋白的聚集,形成了分子量更大的蛋白质,而壳聚糖-柑橘精油微胶囊处理起到了抗氧化作用,减少了二硫键和二聚酪氨酸的形成。在整个处理过程中,实验组与对照组的肌动蛋白条带变化不明显。
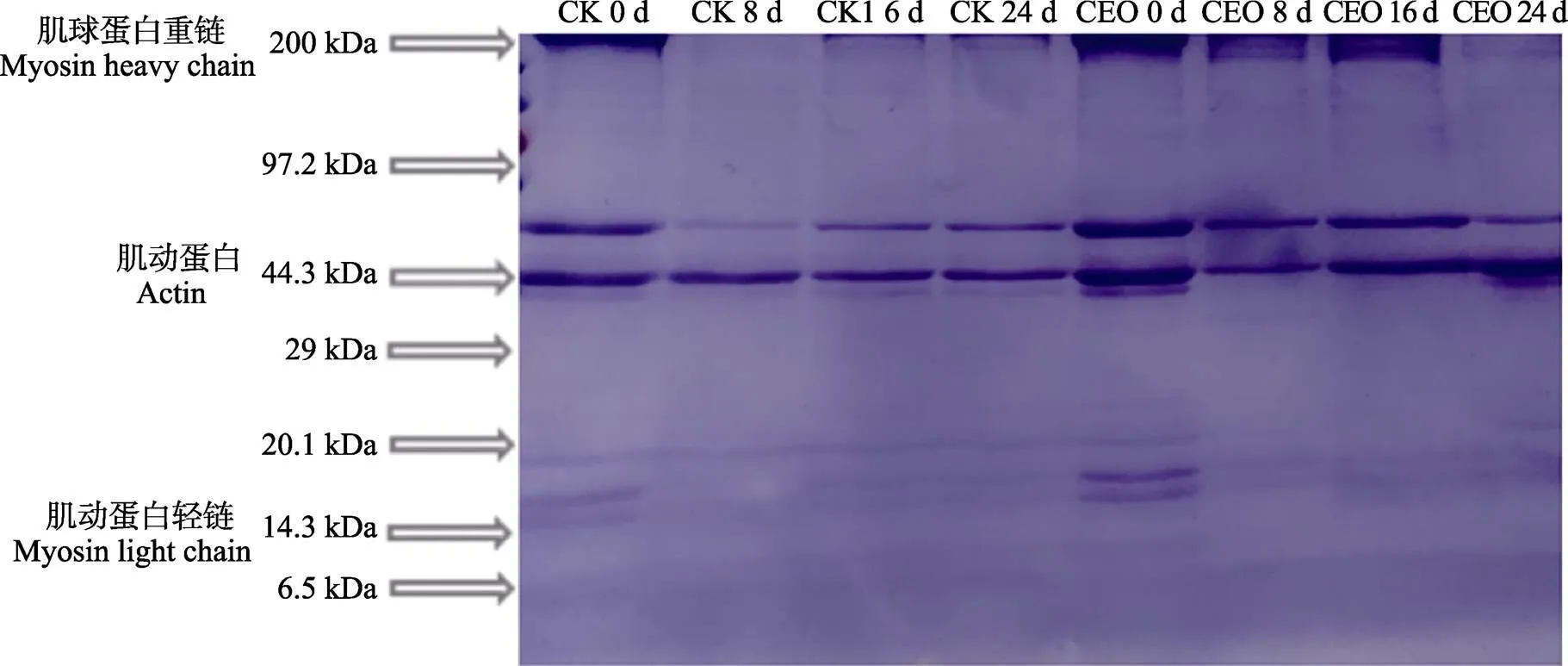
图2 凡纳滨对虾在4℃保藏过程中SDS-PAGE电泳图谱的变化
2.6 壳聚糖-柑橘精油微胶囊对冷藏凡纳滨对虾TBA值的影响
脂质氧化形成的过氧化物会分解产生丙二醛(Malondialdehyde,MDA),MDA可与TBA产生颜色反应,生成稳定的红色化合物通过测定吸光度定量(Jo, 2000)。TBA值是衡量水产品脂肪氧化酸败程度的重要指标(孙群, 2002)。在4℃条件下,凡纳滨对虾TBA值的变化趋势见图3。随着贮藏时间的延长,实验组与对照组的TBA值曲线都呈上升趋势,表明随着时间的延长,凡纳滨对虾的脂肪酸败越来越严重,实验组的TBA值与对照组相比在贮藏第19天时差异显著(<0.05),实验组的TBA值上升趋势较对照组更平缓,此外,对照组贮藏第19天的TBA值为0.958 mg/kg,而实验组贮藏第22天的TBA值为0.789 mg/kg,表明壳聚糖-柑橘精油微胶囊处理能延缓凡纳滨对虾脂肪酸败速率。刘金昉等(2014)的研究结果显示,含有壳聚糖的复合保鲜剂处理过的凡纳滨对虾的TBA上升速度更慢,在贮藏后期,当TBA值上升到一定值后趋于平衡时,含有壳聚糖的复合保鲜剂处理过的样品TBA的平衡值较未经复合保鲜剂处理的样品低。因此, 刘金昉等(2014)认为复合保鲜剂处理不仅可以延缓凡纳滨对虾脂肪氧化速率,而且还能降低凡纳滨对虾脂肪氧化程度。
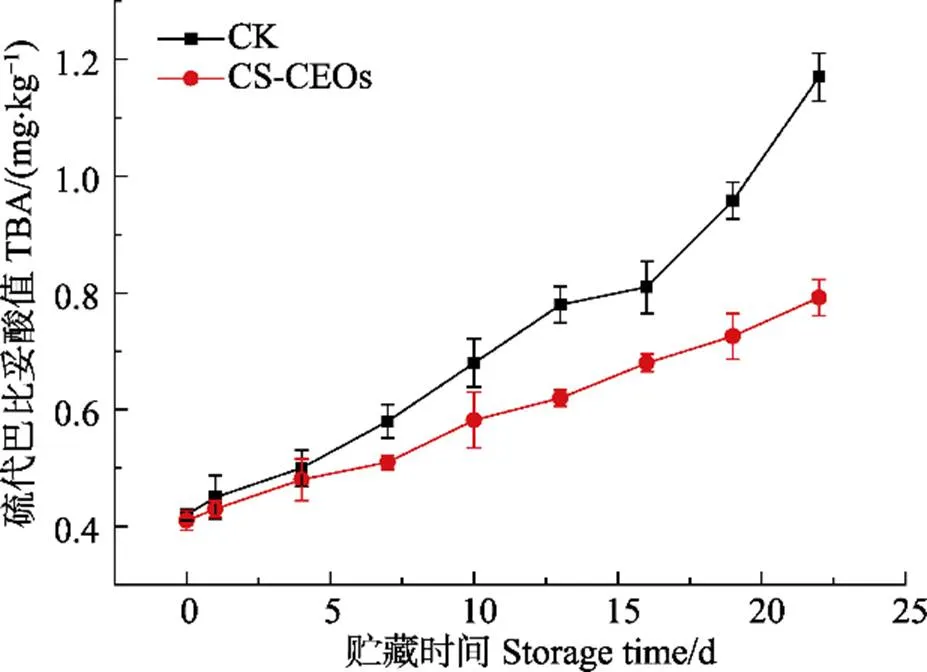
图3 凡纳滨对虾在4℃保藏过程中TBA值的变化
2.7 壳聚糖-柑橘精油微胶囊对冷藏凡纳滨对虾菌落总数(TVC)的影响
微生物生长是导致腐败的主要原因,菌落总数是衡量水产品腐败情况的重要指标。Al-Dagal等(1999)的研究表明,虾类的菌落数不大于5.0 lg(CFU/g)为一级鲜度;菌落总数在5.0~5.7lg(CFU/g)之间为二级鲜度,菌落总数大于5.7 lg(CFU/g)则判定虾类已经到达货架终点。不同处理方式的凡纳滨对虾贮藏在4℃条件下的菌落总数变化情况见图4。随着贮藏时间的延长,凡纳滨对虾的菌落总数整体呈上升趋势,新鲜样品菌落总数为4.10lg(CFU/g),为一级鲜度。不同处理方式的凡纳滨对虾的菌落总数在贮藏第19天差异显著(<0.05)。第1天对照组样品的菌落总数为4.05 lg(CFU/g),可能是因为醋酸浸泡处理起到了杀菌作用,实验组的菌落总数为3.42 lg(CFU/g),可能是因为醋酸浸泡与壳聚糖-柑橘精油微胶囊处理共同作用的结果。熊青等(2014)用茶多酚、柠檬酸和L-半胱氨酸复合保鲜剂处理凡纳滨对虾,实验组第2天的菌落总数与第0天相比也略有减少,认为这是茶多酚、柠檬酸和L-半胱氨酸复合保鲜剂导致pH值的降低,而较低的pH值抑制了微生物的增长。对照组从第1天起微生物增长迅速,第13天已超过了5.7 lg(CFU/g),实验组的菌落总数增长速率较对照组平缓,到第19天细菌总数为5.42 lg(CFU/g),到第22天细菌总数为6.07 lg(CFU/g),超出二级鲜度范围。可见壳聚糖-柑橘精油微胶囊处理对凡纳滨对虾微生物的生长繁殖起到一定抑制作用。
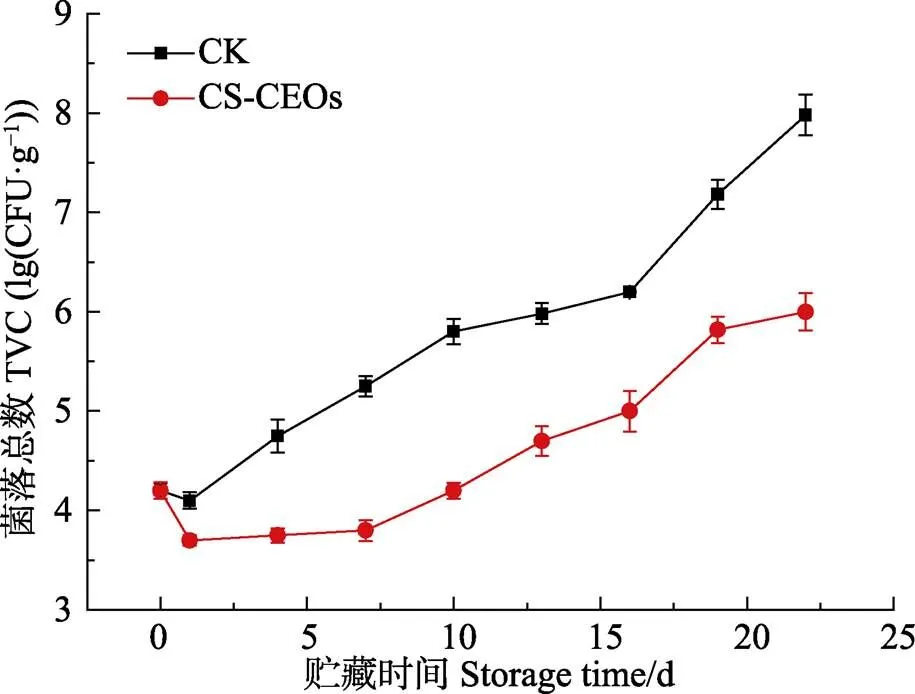
图4 凡纳滨对虾在4℃保藏过程中菌落总数的变化
3 结论
壳聚糖-柑橘精油微胶囊处理过的凡纳滨对虾在4℃冷藏过程中TVB-N值、TBA值和TVC值等指标明显低于空白对照组,说明壳聚糖-柑橘精油微胶囊能够有效地抑制蛋白质的变性、脂肪的酸败和微生物的增长,从而阻碍凡纳滨对虾腐败变质。近年来,随着人们对食品的口感、安全性和营养性等因素的重视程度的提高,人们对天然保鲜剂越来越感兴趣,天然保鲜剂不仅可以抑制细菌生长、抗氧化而且相对更安全。壳聚糖具有广谱抑菌作用和抗氧化作用,壳聚糖在中性pH下溶解度较低、表面积较小、孔隙度较低、高浓度时有涩感,单独使用时可以通过化学修饰、改变壳聚糖粒径、制备纳米壳聚糖纤维等方式来增大壳聚糖与被保鲜物质的接触面积,从而增强保鲜性能。单一生物保鲜剂的作用相对局限,2种或2种以上生物保鲜剂协同作用,可以大大降低单一保鲜剂的用量,提高保鲜效率,国内外对于壳聚糖和多酚类物质的结合使用,用于生鲜水果保鲜的研究比较多。同时,在水产保鲜贮藏技术上,单一栅栏因子的冷冻冷藏效果相对局限,利用多个栅栏因子的协同作用,例如引用生物保鲜剂等将有较好的发展前景。
Al-Dagal MM, Bazaraa WA. Extension of shelf life of whole and peeled shrimp with organic acid salts and bifidobacteria. Journal of Food Protection, 1999, 62(1): 51–56
Benjakul S, Visessanguan W, Riebroy S,. Gel-forming properties of surimi produced from bigeye snapper,and, stored in ice. Journal of the Science of Food and Agriculture, 2002, 82(13): 1442–1451
Bi HD, Cui XH, Wang ZY,. Effects of tea polyphenols and whey protein isolate on preservation of surimi quality during cold storage. Food Science, 2016, 37(10): 272–277 [毕海丹,崔旭海, 王占一, 等. 茶多酚和乳清蛋白对冷藏鱼糜保鲜效果的影响. 食品科学, 2016, 37(10): 272–277]
Cao R, Xue CH, Xu LM. Application of complex preservative on prawn anti-melanosis and preservation. Transactions of the CSAE, 2009, 25(8): 294–298 [曹荣, 薛长湖, 徐丽敏. 复合保鲜剂在对虾保鲜及防黑变中的应用. 农业工程学报, 2009, 25(8): 294–298]
Chang Q, Liang MQ, Wang JL,. Influence of chitosan on the growth and non-specific immunity of Japanese sea bass (). Marine Fisheries Research, 2006, 27(5): 17–22 [常青, 梁萌青, 王家林, 等. 壳聚糖对花鲈生长和非特异性免疫力的影响. 海洋水产研究, 2006, 27(5): 17–22]
Cheng JH, Sun DW, Qu JH,. Developing a multispectral imaging for simultaneous prediction of freshness indicators during chemical spoilage of grass carp fish fillet. Journal of Food Engineering, 2016, 182: 9–17
Csaba N, Koping-Hoggard M, Alonso MJ. Ionically crosslinked chitosan/ tripolyphosphate nanoparticles for oligonucleotide and plasmid DNA delivery. International Journal of Pharmaceutics, 2009, 382(1–2): 205–214
Fan W, Yan W, Xu ZS,. Formation mechanism of monodisperse, low molecular weight chitosan nanoparticles by ionic gelation technique. Colloids and Surfaces B: Biointerfaces, 2012, 90: 21–27
Gooday GW, Jeuniaux C, Muzzarelli R. Chitin in nature and technology//International conference on chitin and chitosan (1985: Senigallia, Italy). Plenum Press, 1986
Guo AL, Yuan J. Some preservatives and their protection. Food Science, 1994(4): 3–16 [郭爱莲, 袁静. 某些防腐剂及其保护作用. 食品科学, 1994(4): 3–16]
Han N. Preparation of β-carotene microcapsules and their stability. Master′s Thesis of Zhejiang University, 2006, 1–78 [韩宁. β-胡萝卜素微胶囊的制备和稳定性研究. 浙江大学硕士研究生学位论文, 2006, 1–78]
Jeon YJ, Park PJ, Kim SK. Antimicrobial effect of chitooligosaccharides produced by biorector. Carbohydrate Polymers, 2001, 44(1): 71–76
Jo C, Ahn DU. Volatiles and oxidatives changes in irradiated pork sausage with different fatty acid composition and tocopherol content. Journal of Food Science, 2000, 65(2): 270–275
Katas H, Alpar HO. Development and characterisation of chitosan nanoparticles for siRNA delivery. Journal of Controlled Release, 2006, 115(2): 216–225
Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970, 227(5259): 680–685
Liu JF, Liu YH, Qi FS,. Preservation effect of complex biological preservative combined with ice temperature storage on. Food Science, 2014, 35(20): 286– 290 [刘金昉, 刘红英, 齐凤生, 等. 复合生物保鲜剂结合冰温贮藏对南美白对虾的保鲜效果. 食品科学, 2014, 35(20): 286–290]
Ni QF. The effects of tea polyphenols combined with chitosan coating on muscle protein of refrigerated large yellow croaker (). Master′s Thesis of Zhejiang Gongshang University, 2014, 1–100 [倪渠峰. 茶多酚结合壳聚糖对冷藏大黄鱼肌肉蛋白质的影响. 浙江工商大学硕士研究生学位论文, 2014, 1–100]
No HK, Park NY, Lee SH,. Antibacterial activity of chitosans and chitosan oligomers with different molecular weights. International Journal of Food Microbiology, 2002, 74: 65–72
Palhano FL, Vilches TTB, Santos RB,. Inactivation ofspores by high hydrostatic pressure combined with citral or lemongrass essential oil. International Journal of Food Microbiology, 2004, 95(1): 61–66
Rampino A, Borgogna M, Blasi P,. Chitosan nanoparticles: Preparation, size evolution and stability. International Journal of Pharmaceutics, 2013, 455(1–2): 219–228
Saraiva C, Vasconcelos H, de Almeida JMMM. A chemometrics approach applied to Fourier transform infrared spectroscopy (Ftir) for monitoring the spoilage of fresh salmon () stored under modified atmospheres. International Journal of Food Microbiology, 2016, 241: 331–339
Sun Q. Lipid oxidation of meat products: Determination of aldehydes by thiobarbituric acid test. Food Science, 2002, 23(8): 331–333 [孙群. 肉制品脂类氧化: 硫代巴比妥酸试验测定醛类物质. 食品科学, 2002, 23(8): 331–333]
Vyncke W. Evaluation of the direct thiobarbituric acid extraction method for determining oxidative rancidity in mackerel (L.). Fette, Seifen, Anstrichmittel, 1975, 77(6): 239–240
Wu JL, Ge SY, Liu H,. Properties and antimicrobial activity of silver carp () skin gelatin- chitosan films incorporated with oregano essential oil for fish preservation. Food Packaging and Shelf Life, 2014, 2(1): 7–16
Wu W, Tan LF, Yang LS. Studies on microencapsulation processing of cinnaldehyde. Journal of Wuxi University of Light Industry, 2002, 21(2): 108–111 [武伟, 谭龙飞, 杨连生.肉桂醛微胶囊的制备工艺. 无锡轻工大学学报, 2002, 21(2): 108–111]
Xiong Q, Xie J, Qian YF,. Effect of tea polyphenol complex preservative on the quality ofunder cold storage. Food Science, 2014, 35(2): 287–291 [熊青, 谢晶, 钱韵芳, 等. 茶多酚复合保鲜剂对冷藏南美白对虾品质的影响. 食品科学, 2014, 35(2): 287–291]
Yerlikaya P, Yatmaz HA, Gokoglu N,. The quality alterations of rainbow trout mince treated with transglutaminase. LWT- Food Science and Technology, 2017, 84: 815–820
Yuan L, Gao RC, Xue CH,. Effect of alginate pyrolysis product on the quality of frozen white leg shrimp. Progress in Fishery Sciences, 2011, 32(6): 121–127 [袁丽, 高瑞昌, 薛长湖, 等. 褐藻酸钠裂解物对冷冻南美白对虾品质的影响. 渔业科学进展, 2011, 32(6): 121–127]
Zeng ZP. The study on microcapsule preparation of lutein and its stability. Master′s Thesis of South China University of Technology, 2010, 1–74 [曾治平. 叶黄素的微胶囊制备及其稳定性的研究. 华南理工大学硕士研究生学位论文, 2010, 1–74]
Optimization of Chitosan-Citrus Essential Oil Microcapsules for Application in the Preservation of
YAO Jieyu, LI Yuan, JIANG Yangyang, CHEN Shiguo, HU Yaqin①
(National Engineering Laboratory of Intelligent Food Technology and Equipment, Key Laboratory for Agro-Products Postharvest Handling of Ministry of Agricultureand Rural Affairs, Key Laboratory for Agro-Products Nutritional Evaluation of Ministry of Agricultureand Rural Affairs, Zhejiang Key Laboratory for Agro-Food Processing, Fuli Institute of Food Science, College of Biosystems Engineering and Food Science, Ningbo Research Institute, Zhejiang University, Hangzhou 310058)
In this study, chitosan-citrus essential oil microcapsules were prepared with the following three ingredients at varying concentrations: citrus essential oil 6 g/L, emulsifier 3 ml/L, TPP(Thiamine pyrohphosphate) 2 g/L, and chitosan at 2.5, 5.0, 7.5, 10, 15, or 20 g/L; citrus essential oil 6 g/L, TPP 2 g/L, chitosan 10 g/L, and emulsifier at 0, 3, 6, 9, or 12 ml/L; and citrus essential oil 6 g/L, emulsifier 3 ml/L, chitosan 10 g/L, and TPP at 0.5, 1, 2, 4, or 8 g/L. The particle size, PDI(Poly-dispersible), and zeta potential were used as indicators, and chitosan 10 g/L, citrus essential oil 6 g/L, emulsifier 9 ml/L, and TPP 4 g/L were eventually selected as the final ingredient concentrations for preparing the microcapsules. After soakingwith 1% (/) microcapsule solution for 20 min, the total volatile basic nitrogen (TVB-N) content, SDS-PAGE patterns, thiobarbituric acid (TBA) content, and total viable count (TVC) were analyzed to determine the effectiveness of the chitosan-citrus essential oil microcapsules in preserving the quality ofduring storage at 4℃. The results showed that the TVB-N level of the experimental group increased slowly (<0.05), reaching 27.47 mg/100 g on the 22nd day of storage, which was at the secondary freshness level, whereas that of the control group exceeded the secondary freshness level on the 19th day of storage. Likewise, the TBA level of the experimental group increased slowly (<0.05), reaching 0.789 mg/kg on the 22nd day of storage, which was the same level as that of the control group on the 15th day. The TVC of the experimental group also increased slowly (<0.05), reaching 5.42 [lg (CFU/g)] on the 19th day of storage, which was at the secondary freshness level, whereas that of the control group exceeded the secondary freshness level on the 13th day of storage. The SDS-PAGE patterns showed that the myosin heavy chain of the experimental group had decomposed more slowly. These results indicated that the chitosan-citrus essential oil microcapsules could effectively inhibit the degeneration of protein, the rancidity of fat, and the growth of microorganisms, thus, hindering the spoilage ofand extending its shelf life by 3~4 days compared with that of the control.
; Chitosan-citrus essential oil microcapsules; Quality; Preservation
TS254.7
A
2095-9869(2019)06-0203-07
10.19663/j.issn2095-9869.20180814003
http://www.yykxjz.cn/
姚洁玉, 李苑, 江杨阳, 陈士国, 胡亚芹. 壳聚糖-柑橘精油微胶囊制备工艺优化及其在凡纳滨对虾保鲜中的应用. 渔业科学进展, 2019, 40(6): 203–209
Yao JY, Li Y, Jiang YY, Chen SG, Hu YQ. Optimization of chitosan-citrus essential oil microcapsules for application in the preservation of. Progress in Fishery Sciences, 2019, 40(6): 203–209
* “十三五”国家重点研发计划(2017YFD0400403)资助 [This work was supported by the National Thirteenth Five-Year Key Research and Development Project (2017YFD0400403)]。姚洁玉,E-mail: 1326496020@qq.com
胡亚芹,教授,E-mail: yqhu@zju.edu.cn
2018-08-14,
2018-08-29
HU Yaqin, E-mail: yqhu@zju.edu.cn
(编辑 陈辉)
