复合蛋白替代鱼粉对花鲈生长、消化能力和肠道健康的影响*
2019-12-06胡鹏莉鲁康乐张春晓
胡鹏莉 吴 瑞 鲁康乐 王 玲 宋 凯 张春晓
复合蛋白替代鱼粉对花鲈生长、消化能力和肠道健康的影响*
胡鹏莉 吴 瑞 鲁康乐 王 玲 宋 凯 张春晓①
(集美大学水产学院 厦门市饲料检测与安全评价重点实验室 厦门 361021)
以初均重为(5.80±0.07) g的花鲈()幼鱼为实验对象,研究复合蛋白替代鱼粉对花鲈生长、消化和肠道健康的影响。用复合蛋白分别替代对照组饲料中0、20%、40%、60%和80%的鱼粉,配制成5种等氮等脂的实验饲料,分别用这5种饲料投喂花鲈70 d;养殖实验期间水温为(29.5±1.5)℃,盐度为29±1,溶解氧≥6.5 mg/L。养殖实验结束后采集样品进行分析,结果显示,20%替代组花鲈生长性能与对照组无显著差异(>0.05),但随鱼粉替代比例的升高,花鲈增重率(WGR)、存活率(SR)、饲料效率(FE)以及蛋白质效率(PER)显著下降(<0.05),花鲈肠道蛋白酶活性以及饲料干物质、粗蛋白与粗脂肪表观消化率皆显著降低(<0.05),且花鲈后肠黏膜组织结构出现损伤,肠道促炎因子TNF-α、IL-1β基因表达量升高,抗炎因子基因IL-4、IL-10表达量相应降低。研究表明,复合蛋白替代花鲈饲料中鱼粉比例不宜超过20%。
复合蛋白;花鲈;生长;消化;肠道组织结构;炎性因子
鱼粉是最常见的饲料蛋白源之一,因其含有的氨基酸全面、适口性好等优点,成为水产饲料中最常使用的蛋白源(吴子林, 1995)。至2018年,我国海水养殖产量已达2000万t (农业部渔业渔政管理局, 2018),水产养殖业对配合饲料的依赖使得我国对鱼粉的需求量逐年递增。然而鱼粉原料供应量却不断的降低,同时伴随着现代水产集约化养殖模式的迅猛发展,过度捕捞以及渔业资源退化等情况,寻找水产饲料中替代鱼粉的蛋白源已然迫在眉睫(van Huis, 2013; Abowei, 2011)。
近年来,昆虫蛋白已逐渐成为动物饲料中蛋白替代的研究热点(Ogunji, 2008)。目前,已有黄粉虫、黑水虻、蚕蛹粉和蝇蛆粉等应用水产饲料研究中。本研究中使用的复合蛋白是一种以豆粕等饲料原料为底物,由蝇蛆和有益微生物经过严格控制的共生环境进行繁殖、生长、发酵、转化和合成,再经浓缩和低温烘干而成的高品质动物源性蛋白,其主要成分为蝇蛆粉,蛋白含量高,氨基酸全面,在保证营养充足的同时,还有利于改善底物原料利用率和动物肠道健康。已有研究表明,在用蝇蛆粉替代鱼粉之后,尼罗罗非鱼()可以较好地摄食和消化蝇蛆粉蛋白(Wang, 2017);在用家蝇蛆粉替代尖吻鲈饲料中鱼粉的研究中发现,家蝇蛆粉可以达到75%的替代鱼粉水平而不影响其生长和饲料系数 (Lin, 2017)。而本研究就是探究复合蛋白在花鲈饲料中替代鱼粉的适宜水平。
花鲈()又称为海鲈、七星鲈、寨花等,由于其为广温、广盐性鱼类,且其具有味道鲜美、营养价值高、生长快、抗病性强等优势(Men, 2014),而被广泛养殖,2017年其年产量已达15.66万t,是我国养殖产量较高的海水鱼类(农业部渔业渔政管理局,2018)。本研究以花鲈为研究对象,通过分析复合蛋白替代鱼粉后对花鲈生长、消化及肠道健康的影响,确定其适宜的鱼粉替代水平,为复合蛋白在花鲈商业饲料中的合理使用提供理论依据。
1 材料与方法
1.1 实验饲料
根据花鲈营养需求,配制蛋白含量为43%,脂肪含量为12%的基础饲料。用复合蛋白(由江门鑫肽生物蛋白有限公司提供)分别替代基础饲料中0、20%、40%、60%和80%的鱼粉(复合蛋白与鱼粉营养组成见表1),并添加三氧化二钇为指示剂配制成5种饲料。将各种饲料原料粉碎过筛,然后制成粒径分别为1.5 mm和2.5 mm的颗粒料,饲料放置于烘箱中在55℃下5 h烘干,然后用自封袋封好,保存于-20℃冰箱中备用。饲料配方及营养组成见表2。
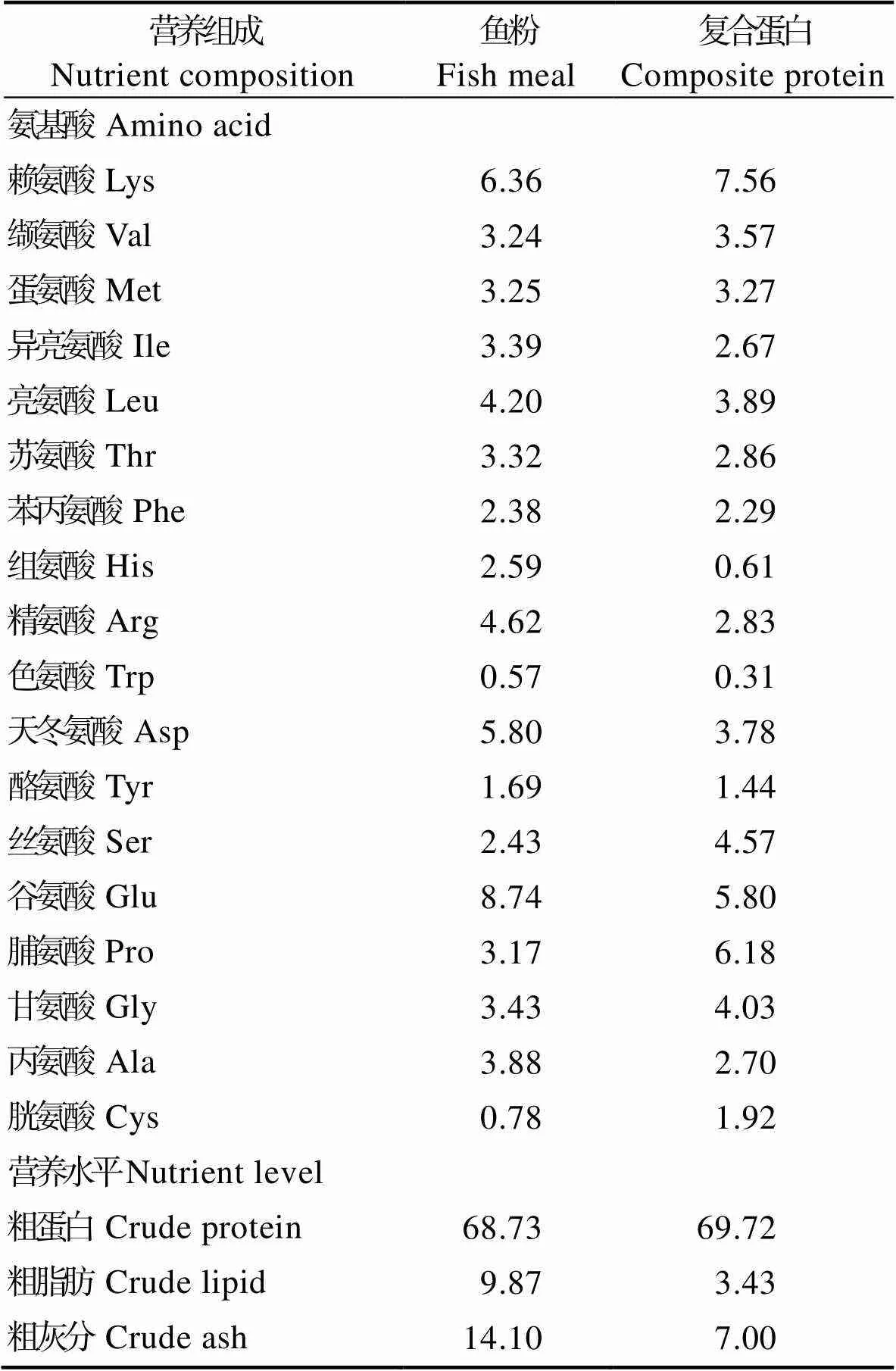
表1 鱼粉与复合蛋白营养组成(%)
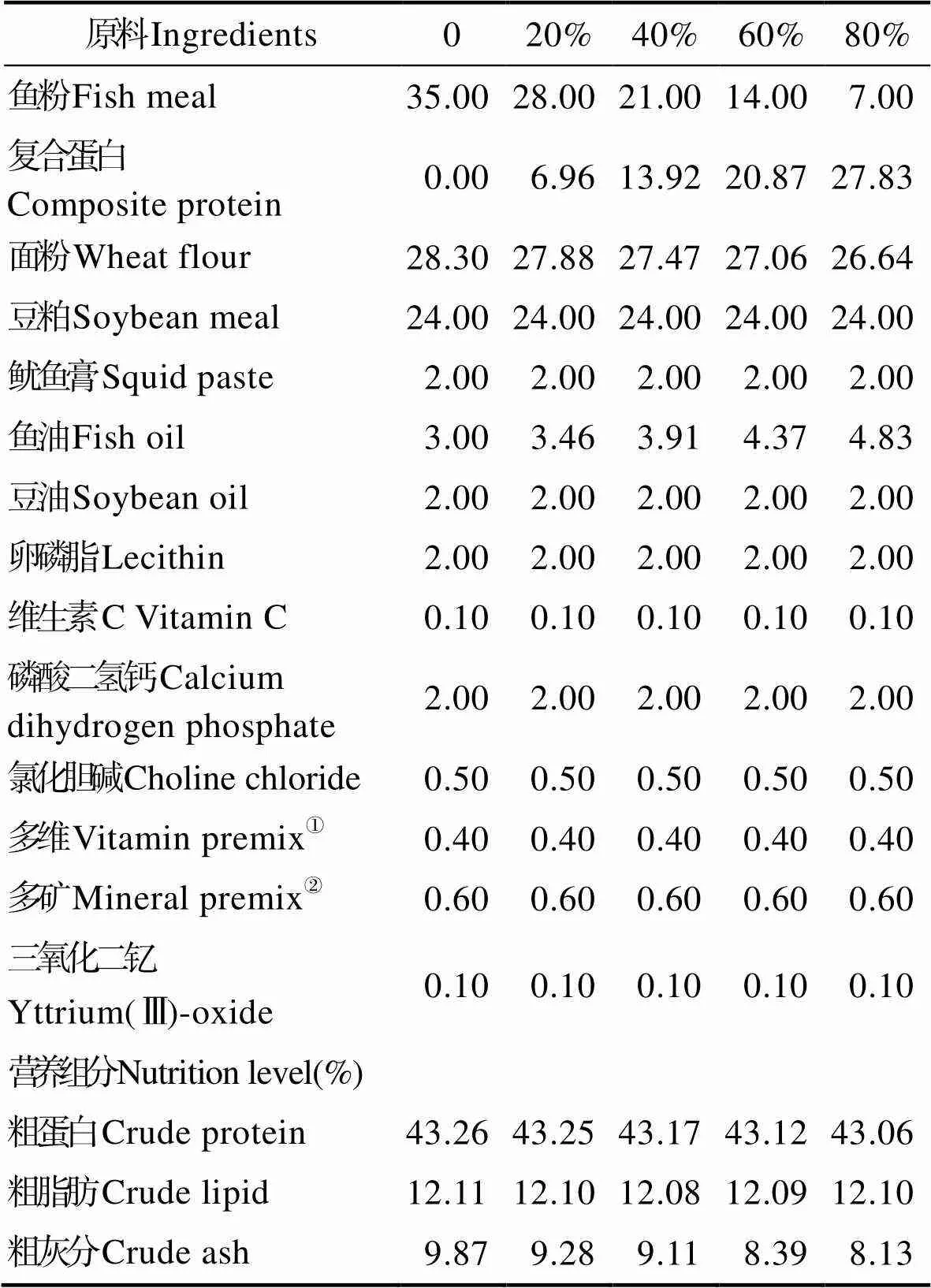
表2 实验饲料配方及主要营养成分(干物质,%)
注:①维生素混合物(mg/kg 饲料):硫胺素,25 mg;核黄素,45 mg;盐酸吡哆醇,20 mg;维生素B12,0.1 mg;维生素K3,10 mg;肌醇,800 mg;泛酸,60 mg;烟酸,200 mg;叶酸,20 mg;生物素,1.2 mg;维生素A乙酸酯,32 mg;维生素D3,5 mg;α-生育酚,120 mg;乙氧基喹啉,150 mg;微晶纤维素,1511.7 mg
②复合矿物质(mg/kg 饲料):一水硫酸镁,4000 mg;一水硫酸锰,50 mg;碘化钾(1%),100 mg;氯化钴(1%),100 mg;五水硫酸铜,20 mg;一水硫酸亚铁,260 mg;一水硫酸锌,150 mg;亚硒酸钠(1%),50 mg;微晶纤维素,5270 mg
Notes: ①Vitamin premix (mg/kg diet): thiamin, 25 mg; riboflavin, 45 mg; hydrochloric acid pyridoxine, 20 mg; vitamin B12, 0.1 mg; vitamin K3, 10 mg; inositol, 800 mg; pantothenic acid, 60 mg; nicotinic acid, 200 mg; folic acid, 20 mg; biotin, 1.2 mg; retinal acetate, 32 mg; vitamin D3, 5 mg; alpha tocopherol, 120 mg; ethoxy quinoline, 150 mg; microcrystalline cellulose, 1511.7 mg
②Mineral premix (mg/kgdiet): MgSO4·H2O, 4000 mg; MnSO4×H2O, 50 mg; KI(1%), 100 mg; CoCl2(1%), 100 mg; CuSO4×5H2O, 20 mg; FeSO4×H2O, 260 mg; ZnSO4×H2O, 150 mg; Na2SeO3(1%), 50 mg; microcrystalline cellulose, 5270 mg
1.2 实验鱼与饲养管理
花鲈鱼苗购自厦门农信渔联信息科技有限公司花鲈育苗场,在福建大北农海康养殖基地工厂化水泥池网箱中进行暂养,待实验鱼稳定后,以基础饲料驯化7 d。正式养殖实验前,鱼苗饥饿处理24 h,选取规格均一为(5.80±0.07) g、体格健康的花鲈600尾,随机分配到20个循环养殖缸内(400 L),每缸30尾鱼,每种饲料设4个重复,进行为期70 d的养殖实验。养殖期间水温为(29.5±1.5)℃,盐度为29±1,溶解氧≥6.5 mg/L。每天饱食投喂2次(08:00;16:30),认真记录每个缸中花鲈的摄食和生长情况,并用虹吸管从缸底部收取粪便到过滤袋上,保存于-20℃冰箱用于测定饲料的表观消化率。
1.3 样品采集与分析
1.3.1 样品采集 养殖实验结束后,将鱼饥饿24 h后用丁香酚(1∶10000)麻醉,进行称重和计数。每缸随机取9尾鱼,尾静脉取血后,采集前肠、中肠和后肠分别装入冻存管中,然后置于-80℃冰箱保存;每缸机取3尾鱼采集后肠放入提前装有波恩试剂的冻存管中,置于4℃冰箱保存,用于肠道组织学观察;每缸取3尾鱼用于花鲈体成分的分析。
1.3.2 饲料营养成分与全体组成的测定 原料、饲料、鱼体和粪便等常规成分测定均采用AOAC(1995)的方法进行。其中水分是在105℃烘箱中烘至恒重,粗蛋白测定采用杜马斯燃烧法定氮,测定仪器为全自动定氮仪(Elementar, rapid N Exceed)。粗脂肪测定采用索氏抽提法(溶剂为乙醚);粗灰分测定是在马弗炉中550℃灼烧12 h。饲料和粪便样品中矿物元素的测定是先用加酸微波消解(Jupiter-B,多通量微波消解仪,上海新仪微波化学科技有限公司),后用电感耦合等离子体原子发射光谱仪(ICP-OES,Prodigy 7,Leemae Labs,美国)测定。
1.3.3 肠道消化酶活的测定 肠道消化酶活性检测,首先将采集的肠道样品解冻,用生理盐水匀浆后2500 r/min 4℃离心10 min,取上清液于-80℃冰箱中备用。其中淀粉酶(AMS)和脂肪酶(LPS)活力使用试剂盒(购自南京建成生物工程研究所)测定,肠道蛋白酶活力采用福林–酚试剂法测定,肠道总蛋白采用考马斯亮蓝法测定(购自南京建成生物工程研究所)。所有样品的检测严格按照说明书的操作步骤规范完成。
1.3.4 肠道炎性因子基因表达 肠道总RNA提取用RNAiso Plus (TaKaRa, 日本)试剂,所有操作均严格按照说明书的操作步骤进行。用NanoDrop ND-2000分光光度计测定RNA浓度,琼脂糖凝胶电泳测定RNA完整性,然后用Thermo RevertAid First Strand cDNA Synthesis Kit对高质量的RNA进行cDNA合成,首先加入1mg RNA, 1ml Oligo(dT)18,并加ddH2O至12ml,进行65℃反应5 min,然后向上述体系中加入5×Reaction Buffer (4ml),Ribolock RNase Inhibitor (1ml),10 mmol/L dNTP Mix(2ml),RevertAid M-MuLV Reverse Transcriptase (1ml)混匀,按照42℃ 60 min、25℃ 5 min、70℃ 5 min进行反应。
实时荧光定量PCR用于检测炎性因子mRNA水平。使用SYBR®Green Master Mix(AceQ®qPCR, 南京诺唯赞生物科技有限公司)试剂在Thermal cycler (ABI StepOne PlusTM)仪器上进行实时荧光定量PCR。反应体系如下:SYBR®Green Master Mix (10ml),上游引物(10mmol/L,0.5ml),下游引物(10mmol/L, 0.5ml),cDNA模板(9ml)。反应条件如下:95℃ 5 min, 95℃ 10 s,60℃ 30 s,共40个循环,所有反应均进行3个重复。选择β-actin作为内参基因,数据结果采用2–DDCt法分析,引物序列见表3。
1.4 计算公式
实验结束后对每缸鱼逐一进行称重并计数,计算存活率(Survival rate, SR, %)、增重率(Weight gain rate, WGR, %)、特定生长率(Specific growth rate, SGR, %)、蛋白质效率(Protein efficiency ratio, PER)、饲料效率(Feed efficiency, FE)、摄食率(Feeding rate, FR, %/d)。公式如下:

表3 荧光定量引物序列
注: IL-1β:白细胞介素-1β;TNF-α:肿瘤坏死因子α; IL-4:白细胞介素-4;IL-10:白细胞介素-10
Notes: IL-1β: Interleukin-1β; TNF-α: Tumor necrosis factor α; IL-4: Interleukin-4; IL-10: Interleukin-10
SR=(/)×100;
WGR=100×()/0;
SGR=(n-n)×100/;
PER=(-)/;
FE=(-)/g;
FR=100×/(/2+/2)/;
式中,为实验初始花鲈尾数,N为实验结束存活的花鲈尾数,为蛋白质摄入量(g),和分别为花鲈初始总重和终末总重;和分别为花鲈初始均重和终末均重(g);为实验中花鲈摄入饲料总重(g);为饲养天数(d)。
饲料营养成分表观消化率计算公式如下:
营养成分表观消化率(%)=[1-(饲料中Y2O3%×粪便中某营养成分%)/(粪便中Y2O3%×饲料中某营养成分%)]×100
1.5 数据处理
所有实验数据均采用SPSS 22.0统计软件进行One-way ANOVA分析,用Duncan′s法多重比较,差异显著水平为<0.05。所有数据用平均值±标准误(Mean±SE)表示。
2 实验结果
2.1 复合蛋白替代鱼粉对花鲈生长性能和饲料利用率的影响
复合蛋白替代鱼粉对花鲈生长性能和饲料利用的影响见表4。研究表明,20%替代组花鲈WGR、SGR、SR和FR与0组(对照组)相比显著差异不显著(> 0.05),而FE和PER显著降低(<0.05);随复合蛋白替代鱼粉比例继续升高,花鲈WGR、SGR、FE和PER均显著降低(<0.05),至80%替代组为最低,而FR显著增加(<0.05);SR则在替代比例至60%时显著降低(<0.05)。
2.2 复合蛋白替代鱼粉对花鲈体组成的影响
复合蛋白替代鱼粉对花鲈体组成的影响见表4。研究表明,花鲈全体粗蛋白含量随复合蛋白替代水平增加而降低,至80%替代组显著降低(<0.05)。而鱼体水分、粗脂肪和粗灰分含量各组均无显著差异(>0.05)。
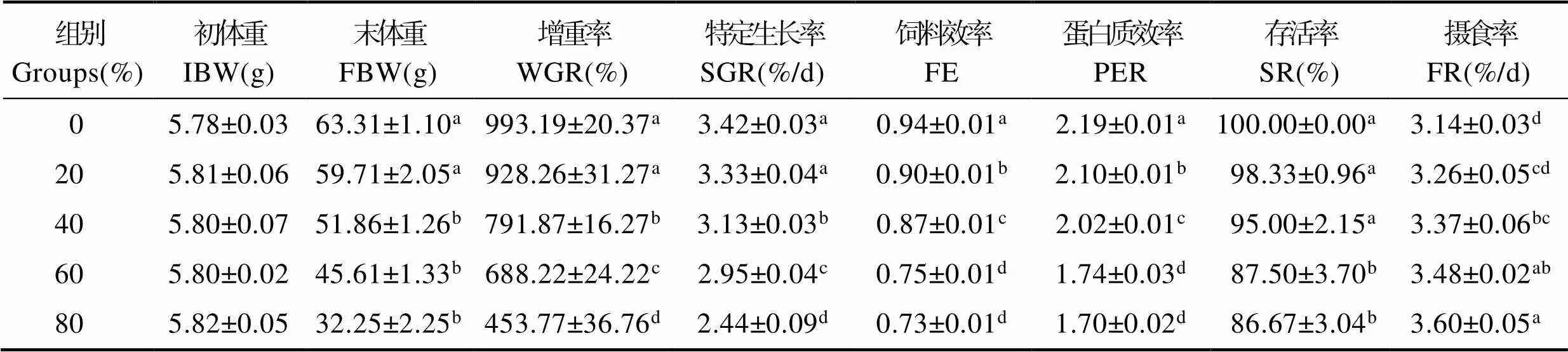
表4 复合蛋白替代鱼粉对花鲈生长性能和饲料利用率的影响
注:表中同列不同小写字母表示差异显著(<0.05),下表同
Note: The values in the same column with different upper small letter indicate significant difference (<0.05), the same as the followings
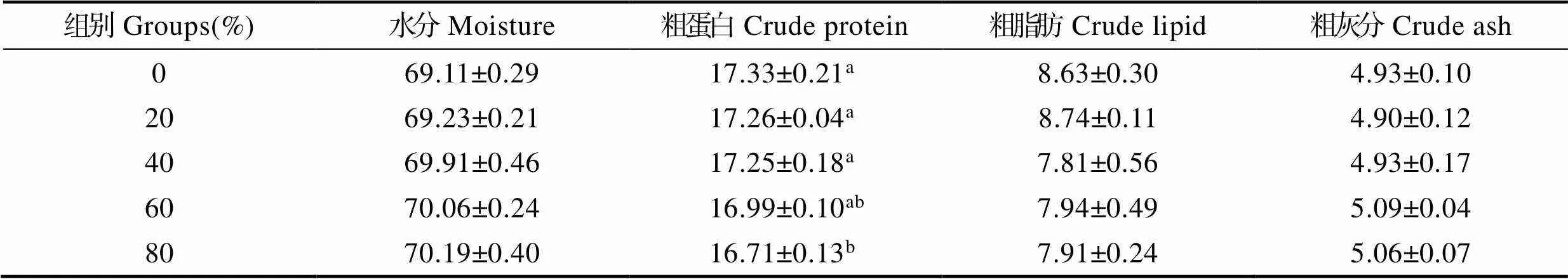
表5 复合蛋白替代鱼粉对花鲈体组成的影响(鲜重, %)
2.3 复合蛋白替代鱼粉对花鲈后肠组织结构的影响
复合蛋白替代鱼粉对花鲈后肠组织结构的影响如图1。花鲈后肠组织学观察发现,各组肠道黏膜皱襞清晰,由肠腔向肠壁方向可清晰观察到黏膜层、黏膜下层、肌层以及浆膜层。其中,对照组和20%替代组花鲈后肠绒毛形态完整,整齐伸入肠腔内,无破损、脱落现象,杯状细胞正常;但是当替代比例至40%时,观察到肠道黏膜中杯状细胞开始增多;随替代比例继续升高,肠道黏膜皱襞弯曲伸入肠腔内,固有层变宽,肠上皮细胞出现空泡。
2.4 复合蛋白替代鱼粉对花鲈肠道消化酶活性的影响
复合蛋白替代鱼粉对花鲈肠道消化酶活性的影响见表6。研究表明,花鲈肠道蛋白酶活性随复合蛋白替代鱼粉比例增加而逐渐降低,40%替代组开始显著降低(<0.05);而花鲈肠道淀粉酶和脂肪酶活性无显著差异(>0.05),但随复合蛋白替代鱼粉比例升高呈降低的趋势。

图1 复合蛋白替代鱼粉对花鲈后肠组织结构的影响(×200)
A~E分别代表对照组(0)、20%、40%、60%和80%替代组
Among A~E represents 0, 20%, 40%, 60% and 80% replacement proportion of fish meal with composite protein, respectively

表6 复合蛋白替代鱼粉对花鲈肠道消化酶活性的影响
2.5 复合蛋白替代鱼粉对花鲈营养物质表观消化率的影响
复合蛋白替代鱼粉对花鲈营养物质和能量表观消化率的影响见表7。研究表明,花鲈干物质、粗蛋白与粗脂肪表观消化率随复合蛋白替代鱼粉比例升高而降低,但20%替代组与0组相比差异不显著,其中干物质与粗蛋白表观消化率在替代水平超过40%时出现显著降低(<0.05),而粗脂肪表观消化率则是在60%替代组出现显著性降低(<0.05)。
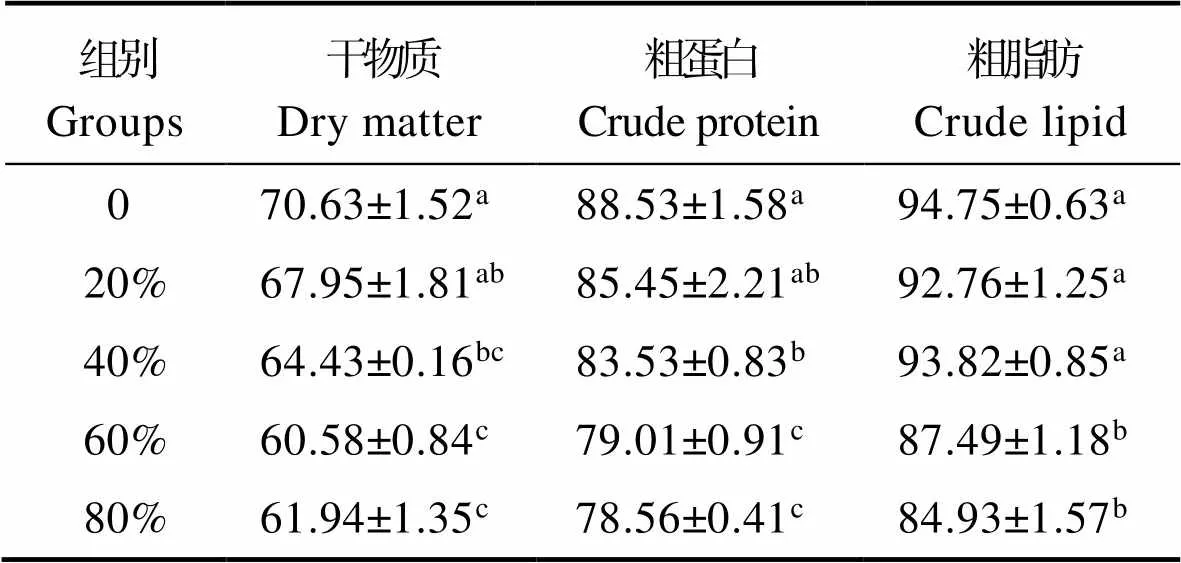
表7 复合蛋白替代鱼粉对花鲈营养物质表观消化率的影响
2.6 复合蛋白替代鱼粉对花鲈肠道促炎因子和抗炎因子基因表达量的影响
复合蛋白替代鱼粉对花鲈肠道促炎因子IL-1β,TNF-α基因表达量的影响见图2。研究表明,前肠IL-1β和TNF-α基因表达量仅在80%替代组显著升高(<0.05),其他替代组与0组差异不显著(>0.05)。中肠IL-1β基因表达量各组差异不显著,而TNF-α基因表达量随替代比例增加而升高,在60%和80%替代组显著升高(<0.05)。后肠IL-1β基因表达量在20%替代组与0组差异不显著,但当替代比例超过40%时,IL-1β基因表达量显著升高(<0.05);后肠中TNF-α基因表达量在80%替代组显著高于0组(<0.05),其他替代组与对照组相比差异不显著(>0.05)。
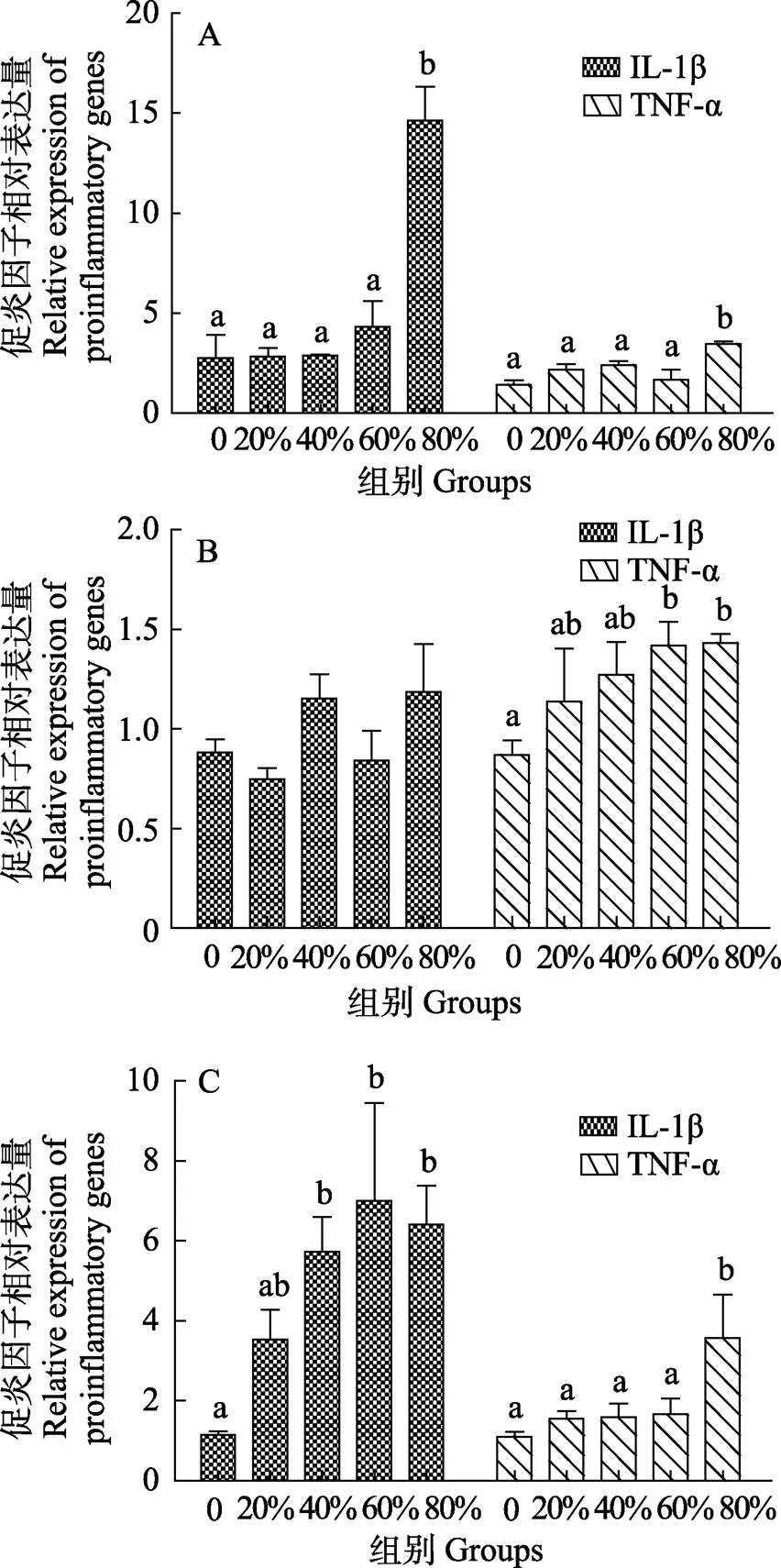
图2 复合蛋白替代鱼粉对花鲈前肠(A)、中肠(B)和后肠(C)促炎因子IL-1β, TNF-α基因表达量的影响
复合蛋白替代鱼粉对花鲈肠道抗炎因子IL-4, IL-10基因表达量的影响见图3。研究表明,前肠IL-4基因相对表达量各替代组与对照组(0组)相比差异均不显著(>0.05),但前肠中各替代组IL-10基因的表达量均显著高于对照组(<0.05),其中80%替代组最高。中肠IL-4和IL-10基因表达量随替代比例升高呈先升高后降低趋势,IL-4在20%替代组达到最高后至80%组最低,IL-10基因表达量在替代比例超过40%后显著降低(<0.05),但各替代组与对照组相比差异不显著(<0.05)。后肠各组间IL-4基因表达量不受复合蛋白替代鱼粉比例影响,各组间无显著差异(>0.05);而IL-10基因相对表达量则是40%替代组显著高于其他各组,其他各组间无显著差异(>0.05)。

图3 复合蛋白替代鱼粉对花鲈前肠(A)、中肠(B)和后肠(C)抗炎因子IL-4,IL-10基因表达量的影响
3 讨论
3.1 复合蛋白替代鱼粉对花鲈生长性能和饲料利用的影响
本研究中,复合蛋白替代20%鱼粉时,对花鲈的生长和SR无显著影响,但当替代比例至40%时,显著降低花鲈的生长性能;当替代比例达至60%时,SR也显著降低。本研究中使用的复合蛋白主要成分为蝇蛆粉,而蝇蛆粉替代饲料鱼粉已有相关研究,孟素宣等(2016)发现,在锦鲤中替代比例达60%而不影响锦鲤的生长性能;Ezewudo等(2015)发现,在吉富罗非鱼(中可替代50%鱼粉;在鱼粉供应日益紧张的形势下,蝇蛆粉替代鱼粉的研究具有较大的开发潜力。但不同养殖品种替代水平有差异,可能与不同鱼类对饲料中营养物质的消化吸收能力不同,所使用的蝇蛆粉的加工工艺以及营养水平有关。而花鲈为海水肉食性鱼类,肠道较短,对蝇蛆粉的消化可能较锦鲤、罗非鱼弱。其次,本研究使用的复合蛋白,各种必需氨基酸含量低于鱼粉,随替代比例升高导致饲料氨基酸缺乏 (窦秀丽, 2014; 李燕, 2010),不能满足花鲈的生长营养需求,从而影响其生长性能。另有研究表明,蝇蛆幼虫体内存在难以被水产动物消化利用的甲壳素(Ogunji, 2008),会对饲料利用产生一定影响,在用蝇蛆粉替代鱼粉后,会显著降低FE和PER,导致花鲈摄入的营养成分减少。文远红等(2013)发现,在黄颡鱼()中当蝇蛆粉添加比例大于8.94%时,WGR和FE显著下降;而在非洲鲶鱼() (Fasakin, 2015)、杂交鲶() (Sogbesan, 2005)和黄鳝() (杨帆, 2011)中均有类似的报道出现。因此,解决蝇蛆粉的饲料利用问题,是提高替代水平的一个重要研究方向。
本研究发现,复合蛋白替代鱼粉显著影响花鲈的体成分,当复合蛋白替代鱼粉比例为80%时,全体粗蛋白含量显著降低,表明高比例复合蛋白替代鱼粉会降低花鲈蛋白质沉积,可能是由于高比例复合蛋白替代鱼粉后,饲料中氨基酸比例不均衡,鱼类无法利用摄食到的饲料进行蛋白质的合成(梅琳等, 2015),从而影响全体蛋白的沉积。Wang等(2017)在尼罗罗非鱼中发现,用蝇蛆粉替代鱼粉后,对尼罗罗非鱼体成分无显著影响;刘黎等(2014)在青鱼中发现,随替代鱼粉比例升高,鱼体水分、粗脂肪和粗灰分含量不受影响,但粗蛋白含量逐渐升高。出现这些差异的原因可能是不同鱼类对饲料中营养成分的需求不同引起的鱼体营养物质沉积的差异。
3.2 复合蛋白替代鱼粉对花鲈消化的影响
本研究表明,复合蛋白替代20%鱼粉不影响饲料中干物质、粗蛋白和粗脂肪的表观消化率,但随复合蛋白替代鱼粉比例升高,干物质、粗蛋白和粗脂肪的表观消化率均显著降低。本实验结果与Kroeckel等(2012)在大菱鲆中用黑水虻替代鱼粉的研究结果一致,而在尼罗罗非鱼发现(Wang, 2017),蝇蛆粉替代鱼粉后,饲料干物质、粗蛋白和粗脂肪的表观消化率虽不受替代比例影响,但随替代比例升高有降低的趋势。可能是由于昆虫蛋白中含有甲壳素,而鱼类肠道中缺乏分解甲壳素的酶和微生物(Kroeckel, 2012),从而影响饲料中营养物质的消化吸收;而且甲壳素在昆虫中一般是与蛋白结合以蛋白聚糖的形式存在,这种存在形式也阻碍肠道对营养物质的消化吸收(Ogunji, 2008)。其次,肠道消化酶结果表明,肠道蛋白酶活性随复合蛋白替代鱼粉比例升高而降低,但20%替代组无显著影响,但当替代水平超过40%时,蛋白酶活性显著降低;而脂肪酶和淀粉酶活性虽不受饲料中复合蛋白替代鱼粉比例的影响,但随复合蛋白替代鱼粉比例升高呈降低的趋势。同样,在黄鳝(杨帆, 2011)、凡纳滨对虾() (曹俊明等, 2012)和彭泽鲫(var. Pengze) (郭玉阳等, 2012)的研究中发现,当饲料中添加高水平蝇蛆蛋白会显著降低肝胰脏消化酶活性。因此,蝇蛆粉对消化能力的影响可能也是限制其在水产饲料中应用的一大因素。综上,复合蛋白替代20%鱼粉不会对花鲈的消化能力产生显著影响,但高比例替代鱼粉会严重影响其消化能力,这可能也是蛋白沉积减少的一个重要原因。
3.3 复合蛋白替代鱼粉对花鲈肠道健康的影响
鱼类肠道是鱼体赖以吸收与利用营养物质的重要场所,肠道结构的健康完整与其能否正常行使生理功能密切相关,而在鱼粉替代的研究中对肠道健康的影响是评价其替代水平的一项重要指标。相关研究发现,大西洋鲑()后肠组织形态可以直观地反映出由植物蛋白引起的肠道炎性特征(Krogdahl, 2015; van den Ingh, 1991);同样,豆粕替代鱼粉后引起花鲈肠道绒毛长度与宽度、肌层厚度降低,隐窝深度增加(王亚如, 2017)。本研究肠道组织学观察发现,随复合蛋白替代鱼粉比例升高,实验组花鲈后肠黏膜杯状细胞逐渐增多。当替代比例超过60%时,黏膜皱襞固有层变宽,皱襞上皮细胞出现空泡,绒毛长度增加,杯状细胞显著增多。这些结果表明,复合蛋白高比例替代鱼粉引起花鲈肠道组织结构损伤,且随替代比例升高其受损程度加重,这可能与复合蛋白中含有一定比例的豆粕有关。而在蝇蛆粉替代鱼粉的研究中发现,在黄颡鱼中,低比例蝇蛆粉替代鱼粉对黄颡鱼肠道影响不显著,仅在100%替代组发现黄颡鱼前肠绒毛出现损伤,皱襞固有层变宽,部分微绒毛脱落(文远红等, 2015)。而肠道组织结构出现损伤的原因推测是替代鱼粉后引发了肠道炎性反应。因此,本研究对引起肠道炎性反应的分子机制进行了进一步的探讨。
肠道炎性因子是用来评价肠道炎症反应的重要指标,研究发现,促炎因子与抗炎因子的失衡是肠道黏膜损伤的重要因素之一(Pichai, 2012)。而肿瘤坏死因子α(TNF-α)和白细胞介素-1β(IL-1β)在鱼类炎症研究中受到广泛关注,常作为研究炎性反应的指标之一。本研究表明,复合蛋白替代饲料中鱼粉引起花鲈肠道炎性因子TNF-α、IL-1β基因表达上调,而TNF-α和IL-1β基因表达上调具有促炎性反应;而IL-4和IL-10作为抗炎性细胞因子通过调控白介素类因子的方式促进相关免疫反应(Rogy, 2000),本研究中复合蛋白替代鱼粉引起抗炎因子IL-4和IL-10基因表达下调。相关报道指出,在肠道发生炎性病变时,往往伴随着促炎因子如TNF-α和IL-1β等基因的表达量升高以及IL-4、IL-10表达量的降低(王少鑫等,2015; 岳文杰等, 2012; 姬培震等, 2015; Szkaradkiewicz, 2009;万国仕等,2011)。因此,本研究中复合蛋白高比例替代鱼粉引发了肠道炎症反应,可能是由于复合蛋白替代鱼粉后使肠道内促炎因子与抗炎因子失衡,肠道生态平衡被打破,从而引发肠道炎症反应。这也是高比例替代鱼粉造成肠道组织结构损伤的一大重要原因。
4 结论
复合蛋白替代20%鱼粉不会对花鲈的生长性能产生负面影响,但随着替代比例的升高,影响花鲈生长,降低花鲈肠道对营养物质的消化能力,引发肠道促炎因子与抗炎因子失衡,导致炎性反应,影响肠道健康。综合以上结论,建议复合蛋白替代花鲈饲料鱼粉比例不宜超过20%。
Abowei JFN, Ekubo AT. A review of conventional and unconventional feeds in fish nutrition. British Journal of Pharmacology and Toxicology, 2011, 2(4): 179–191
Cao JM, Yan J, Huang YH,. Effects of replacement of fish meal with housefly maggot meal on growth performance, antioxidant and non-specific immune indexes of juvenile. Journal of Fisheries of China, 2012, 36(4): 529–537 [曹俊明, 严晶, 黄燕华, 等. 家蝇蛆粉替代鱼粉对凡纳滨对虾生长、抗氧化和免疫指标的影响. 水产学报, 2012, 36(4): 529–537]
Dou XL. The study on the optimum requirement of dietary valine, histidine and threonine of Japanese seabass () in the middle and late growing stage. Master′s Thesis of Dalian Ocean University of China, 2014, 1–69 [窦秀丽. 鲈鱼()生长中后期缬氨酸、组氨酸和苏氨酸营养需求的研究. 大连海洋大学硕士研究生学位论文, 2014, 1–69]
Ezewudo BI, Monebi CO, Ugwumba AAA. Production and utilization ofmaggots in the diet of(Linnaeus, 1758) fingerlings. African Journal of Agricultural Research, 2015, 10(23): 2363–2371
Fasakin EA, Balogun AM, Ajayi OO. Evaluation of full-fat and defatted maggot meals in the feeding of clariid catfishfingerlings. Aquaculture Research, 2015, 34(9): 733–738
Guo YY, Luo L, Chen RX,. The effects of replacing fish meal with different proportions of fermented maggot protein in diet on growth performance and liver function of Pengze crucian carp. China Feed, 2012(21): 26–29 [郭玉阳, 罗莉, 陈任孝, 等. 蝇蛆复合发酵蛋白替代鱼粉对彭泽鲫的生长性能和肝脏功能的影响. 中国饲料, 2012(21): 26–29]
Ji PZ, Zhang Y, Li XP,. Effect of Fuzi Lizhong Tang on expression of NF-κB, TNF-α, IL-1β of spleen and kidney Yang deficiency type ulcerative colitis rats through enema. Chinese Journal of Experimental Traditional Medical Formulae, 2015(14): 124–128 [姬培震, 张怡, 李雪萍, 等. 附子理中汤灌肠对脾肾阳虚型溃疡性结肠炎大鼠NF-κB, TNF-α, IL-1β表达的影响. 中国实验方剂学杂志, 2015(14): 124–128]
Kroeckel S, Harjes AGE, Roth I,. When a turbot catches a fly: Evaluation of a pre-pupae meal of the black soldier fly () as fish meal substitute—Growth performance and chitin degradation in juvenile turbot (). Aquaculture, 2012, 364–365: 345–352
Krogdahl Å, Gajardo K, Kortner TM,. Soya saponins induce enteritis in Atlantic salmon (L.). Journal of Agricultural and Food Chemistry, 2015, 63(15): 3887–3902
Li Y. Optimal requirements of branch chain amino acids and histidine in diets of Japanese seabass,and large yellow croakerR. Doctoral Dissertation of Ocean University of China, 2010 [李燕. 鲈鱼和大黄鱼支链氨基酸与组氨酸营养生理的研究. 中国海洋大学博士研究生学位论文, 2010]
Lin YH, Mui JJ. Evaluation of dietary inclusion of housefly maggot () meal on growth, fillet composition and physiological responses for barramundi,. Aquaculture Research, 2017, 48(5): 2478–2485
Liu L, Ye JY, Wu CL,. Effects of maggot meal on growth performance, body composition and digestive enzymes activitivies of black carp (). Journal of Shanghai Ocean University, 2014, 23(1): 43–50 [刘黎, 叶金云, 吴成龙, 等. 饲料中蝇蛆粉用量对青鱼生长、体成分和消化酶活力的影响. 上海海洋大学学报, 2014, 23(1): 43–50]
Mei L, Zhou HH, Mai KS,. Effects of dietary substitution of fishmeal by fermented silkworm pupae on the growth, feed intake, digestion and immunity of juvenile turbot (L.). Progress in Fishery Sciences, 2015, 36(3): 85–92 [梅琳, 周慧慧, 麦康森, 等. 蛹肽蛋白替代鱼粉对大菱鲆(L.)幼鱼生长、饲料利用、消化代谢酶及免疫性能的影响. 渔业科学进展, 2015, 36(3): 85–92]
Men KK, Ai QH, Mai KS,. Effects of dietary corn gluten meal on growth, digestion and protein metabolism in relation to IGF-I gene expression of Japanese seabass,. Aquaculture, 2014, 428–429: 303–309
Meng SX, Shi DJ, Qin J,. Effects of fish meal replacement by maggot meal on growth performance,body composition,body color and non-specific immunity ofL.Hubei Agricultural Sciences, 2016, 55(8): 2066–2070 [孟素宣, 史东杰, 秦佳, 等. 蝇蛆粉替代鱼粉对锦鲤生长、体组成、体色和非特异性免疫的影响. 湖北农业科学, 2016, 55(8): 2066–2070]
Ministry of Agriculture Fisheries Bureau. China fisheries statistical yearbook 2018. Beijing: China Agriculture Press , 2018 [农业部渔业渔政管理局. 2018中国渔业统计年鉴. 北京: 中国农业出版社, 2018]
Ogunji JO, Kloas W, Wirth M,. Housefly maggot meal (magmeal) as a protein source for(Linn.). Asian Fisheries Science, 2008, 21(3–4): 319–331
Pichai MVA, Ferguson LR. Potential prospects of nanomedicine for targeted therapeutics in inflammatory bowel diseases. World Journal of Gastroenterology, 2012, 18(23): 2895–2901
Rogy MA, Beinhauer BG, Reinisch W,. Transfer of interleukin-4 and interleukin-10 in patients with severe inflammatory bowel disease of the rectum. Human Gene Therapy, 2000, 11(12): 1731–1741
Sogbesan AO, Ajuonu ND, Madu CT,. Growth response, feed conversion rate and cost benefits of hybrid catfish fed maggot meal based diets in outdoor tanks. Fison Conference Proceedings, 2005, 896: 231–237
Szkaradkiewicz A, Marciniak R, Chudzicka-Strugała I,. Proinflammatory cytokines and IL-10 in inflammatory bowel disease and colorectal cancer patients. Archivum Immunologiae et Therapiae Experimentalis, 2009, 57(4): 291–294
van den Ingh TSGAM, Krogdahl Å, Olli JJ,. Effects of soybean-containing diets on the proximal and distal intestine in Atlantic salmon (): A morphological study. Aquaculture, 1991, 94(4): 297–305
van Huis A. Potential of insects as food and feed in assuring food security. Annual Review of Entomology, 2013, 58(1): 563–583
Wan GS, Zhao ZZ, Qian YL,. Changes in serum levels of SOCS-3, IL-6 and TNF-α and their correlation in patients with ulcerative colitis. World Chinese Journal of Digestology, 2011, 19(32): 3370–3373 [万国仕, 赵振中, 钱一龙, 等. 血清SOCS-3、IL-6、TNF-α在溃疡性结肠炎患者中的变化及其相互关系. 世界华人消化杂志, 2011, 19(32): 3370–3373]
Wang L, Li J, Jin JN,. A comprehensive evaluation of replacing fishmeal with housefly () maggot meal in the diet of Nile tilapia (): Growth performance, flesh quality, innate immunity and water environment. Aquaculture Nutrition, 2017, 23(5): 983–993
Wang SX, Pu J, Liu CQ,. Expression and clinical significance of cytokine TNF-α, IL-6 and IL-4 in ulcerative colitis. Chinese Journal of Gastroenterology and Hepatology, 2015, 24(1): 104–106 [王少鑫, 浦江, 刘超群, 等. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义. 胃肠病学和肝病学杂志, 2015, 24(1): 104–106]
Wang YR. Effects of substituting fishmeal with soybean meal on growth performance and intestinal health in Japanese seabass (). Master′s Thesis of Jimei University, 2017, 1–68 [王亚如. 豆粕替代鱼粉对花鲈生长性能和肠道健康的影响. 集美大学硕士研究生学位论文, 2017, 1–68]
Wen YH, Cao JM, Huang YH,. Effects of fish meal replacement by maggot meal on growth performance,body composition and plasma biochemical indexes of juvenile yellow catfish (). Chinese Journal of Animal Nutrition, 2013, 25(1): 171–181 [文远红, 曹俊明, 黄燕华, 等. 蝇蛆粉替代鱼粉对黄颡鱼幼鱼生长性能、体组成和血浆生化指标的影响. 动物营养学报, 2013, 25(1): 171–181]
Wen YH, Huang YH, Wang HX,. Effect of replacement of fish meal with maggot meal on antioxidant indexes, digestive enzyme activities, foregut and hepatopancreas histological structure of. Feed Industry, 2015, 36(4): 29–35 [文远红, 黄燕华, 王国霞, 等. 蝇蛆粉替代鱼粉对黄颡鱼抗氧化指标、消化酶活性及前肠、肝胰脏组织结构的影响. 饲料工业, 2015, 36(4): 29–35]
Wu ZL. Application of fishmeal in feed. China Feed, 1995(1): 23–24 [吴子林. 鱼粉在饲料中的作用. 中国饲料, 1995(1): 23–24]
Yang F. Research of replacing fish meal with maggot meal in feed for. Master′s Thesis of Huazhong Agricultural University, 2011 [杨帆. 蝇蛆在黄鳝饲料中替代鱼粉的应用研究. 华中农业大学硕士研究生学位论文, 2011]
Yue WJ, Liu Y, Xu W,. The expression of IL-2, IL-4, IL-17 and IL-10 in ulcerative colitis (UC) mucosa and its relation with disease activity. Fudan University Journal of Medical Sciences, 2012, 39(5): 454–459 [岳文杰, 刘懿, 徐薇, 等. 溃疡性结肠炎(UC)肠黏膜中IL-2、IL-4、IL-17和IL-10的表达特点及其与疾病活动度的关系. 复旦学报(医学版), 2012, 39(5): 454–459]
Effects of Replacing Fish Meal with Composite Protein on Growth, Diet Digestibility, and Gut Health in Japanese Seabass ()
HU Pengli, WU Rui, LU Kangle, WANG Ling, SONG Kai, ZHANG Chunxiao①
(Xiamen Key Laboratory of Feed Testing and Safety Evaluation, Fisheries College, Jimei University, Xiamen 361021)
This study was conducted to evaluate the effects of replacing fish meal with composite protein on growth performance, diet digestibility, and gut health in Japanese seabass (). Five isonitrogenous and isolipidic diets were formulated by replacing 0, 20%, 40%, 60%, or 80% of fish meal in the basic diet with composite protein. Quadruplicate groups of 30 fish [initial body weight (5.80±0.07) g] were fed the test diets to apparent satiation twice daily (08:00 and 16:30), and the experiment continued for 70 days. During the feeding trial, water temperature, salinity, and dissolved oxygen values were maintained at (29.5±1.5)℃, 29±1, and ≥6.5 mg/L, respectively.Samples were collected for analysis after the feeding trial. The main indexes including the growth performance, diet digestibility, intestinal digestive enzymes activities, posterior intestine morphology structure, and expression of inflammation-related genes of the proximal intestine, mid-intestine, and posterior intestine were analyzed to investigate the appropriate replacement proportion of fish meal by composite protein. The results showed that substituting 20% of fish meal with composite protein did not significantly affect growth performance compared to that of the control group (>0.05), while further increment of fish meal replacement levels resulted in significant reduction of weight gain, survival rate, feed efficiency, and protein efficiency ratio<0.05). Moreover, as the replacement level of fish meal with composite protein exceeded 20%, intestinal protease activity and apparent digestibility coefficients of feed dry matter, crude protein, and crude lipid also significantly decreased with increasing level of fish meal replacement by composite protein (<0.05). Meanwhile, increasing replacement of fish meal with composite protein damaged posterior intestine morphology structure and up-regulated expression of gut inflammatory genes such as TNF-α and IL-1β, while an opposite trend was observed for the expression of anti-inflammatory genes, IL-4 and IL-10. In conclusion, it was recommended that the replacement proportion of fish meal with composite protein should not exceed 20%.
Composite protein; Japanese seabass (); Growth performance; Digestibility; Gut morphology structure; Inflammatory genes
S965.211
A
2095-9869(2019)06-0056-10
10.19663/j.issn2095-9869.20181214002
http://www.yykxjz.cn/
胡鹏莉, 吴瑞, 鲁康乐, 王玲, 宋凯, 张春晓. 复合蛋白替代鱼粉对花鲈生长、消化能力和肠道健康的影响. 渔业科学进展, 2019, 40(6): 56–65
Hu PL, Wu R, Lu KL, Wang L, Song K, Zhang CX. Effects of replacing fish meal with composite protein on growth, diet digestibility, and gut health in Japanese seabass (). Progress in Fishery Sciences, 2019, 40(6): 56–65
* 国家海水鱼产业技术体系(CARS-47)资助[This work was supported by China Agriculture Research System (CARS-47)]. 胡鹏莉,E-mail: 970260221@qq.com
张春晓,教授,E-mail: cxzhang@jmu.edu.cn
2018-12-14,
2019-01-30
ZHANG Chunxiao, E-mail: cxzhang@jmu.edu.cn
(编辑 陈辉)
