牙鲆连续四代减数分裂雌核发育家系的遗传特征分析*
2019-12-06王桂兴张晓彦孙朝徽赵雅贤侯吉伦王玉芬
王桂兴 张晓彦 孙朝徽 赵雅贤 都 威 侯吉伦 王玉芬
牙鲆连续四代减数分裂雌核发育家系的遗传特征分析*
王桂兴 张晓彦 孙朝徽 赵雅贤 都 威 侯吉伦①王玉芬①
(中国水产科学研究院北戴河中心实验站 秦皇岛 066100)
为了研究纯合度和遗传相似度在牙鲆()连续四代减数分裂雌核发育家系中的变化规律,本研究利用分布在不同连锁群上的24个高重组率微卫星标记对牙鲆连续减数分裂雌核发育二代(G2)、三代(G3)、四代(G4)家系及普通家系对照组进行了遗传分析。结果显示,24个微卫星位点在对照组、G2、G3、G4家系中,分别检测到96、42、32和32个等位基因,平均等位基因数分别为4.00、1.98、1.33和1.33;期望杂合度分别为0.6416、0.3472、0.1694和0.1492;纯合度分别为0.3503、0.6528、0.8306和0.8508;遗传相似系数分别为0.5822、0.9238、0.9890和0.9988。24个位点中已有17个纯合,但尚有7个保持杂合状态。同时,将上述结果和已发表的减数分裂雌核发育一代(G1)家系的数据进行分析,结果表明,诱导连续减数分裂雌核发育不仅能提高个体的纯合度,同时也可提高子代个体间的遗传相似度;纯合度和遗传相似度在G1、G2和G3家系中能够得到逐步提高,代际之间差异显著(<0.05);但在G4家系中趋于稳定,与G3家系差异不显著。G4家系的遗传相似性(0.9988)已高于连续20代全同胞交配所获得的理论值(0.9860),连续诱导减数分裂雌核发育是快速建立鱼类近交系的良好方法。
牙鲆;微卫星;雌核发育克隆系;遗传多样性;杂合位点
牙鲆()隶属于硬骨鱼纲(Osteichthyes)、鲽形目(Pleuronectiformes)、鲽亚目(Pleuronectoidei)、牙鲆科(Paralichthyidae)、牙鲆属(),广泛分布于中国沿海地区、俄罗斯远东海域、日本及朝鲜半岛,为冷温性大型经济鱼类,也是中国重要的海产经济鱼类。牙鲆雌性个体生长速度快于雄性,在人工养殖条件下,445日龄时,雌牙鲆的平均体重是雄牙鲆的1.8倍;773日龄时,差异达2.9倍(Yamamoto, 1999)。在生产中,养殖全雌牙鲆将获得更高的经济效益。鉴于此,中国水产科学研究院北戴河中心实验站的科研人员利用人工诱导减数分裂雌核发育技术,培育出全雌牙鲆新品种“北鲆1号”和单交种“北鲆2号”(刘海金等, 2017),并在生产上进行了推广应用,取得了良好的经济效益。
人工诱导减数分裂雌核发育具有操作简便,诱导效率高等特点,可快速提高纯合度和固定母本性状,在鱼类性别控制及遗传分析等方面都具有重要价值,已在上百种鱼类中得到应用(Komen, 2007)。牙鲆人工诱导雌核发育研究始于1986年,田畑和男等(1986)通过冷休克和静水压染色体加倍技术,建立了牙鲆减数分裂和有丝分裂雌核发育的诱导方法,并用同工酶证明了纯合子的成立。Yamamoto(1999)在诱导牙鲆有丝分裂的基础上,再次诱导减数分裂雌核发育,建立了克隆系,并用DNA指纹图谱技术进行了验证。徐成等(2002)运用同工酶、王伟等(2005)通过微卫星标记均证明减数分裂雌核发育牙鲆存在杂合基因型,不能直接用于培育克隆。但连续诱导减数分裂雌核发育能够显著提高鱼类的纯合度和相似度,在大黄鱼()连续两代雌核群体 (叶小军等, 2010)、团头鲂()连续三代减数雌核发育群体(唐首杰等, 2014)和翘嘴鲌()连续两代减数分裂雌核发育群体(李倩等, 2015)中得到验证。
本研究室开展了大量的牙鲆雌核发育诱导研究,优化了减数分裂雌核发育的诱导参数(刘海金等, 2010a),并用微卫星标记进行了遗传分析(刘海金等, 2010b; 朱晓琛等, 2006)。自2007年,开展了连续多代减数分裂雌核发育家系的制备,分别于2009和 2014年建立了连续减数分裂雌核发育二代和三代家系,并利用高重组率微卫星标记开展了遗传特征分析(王桂兴等, 2012; 侯吉伦等, 2014)。研究表明,连续减数分裂雌核发育诱导不仅提高了个体的纯合度,同时提高了子代个体间的遗传相似度。
本研究在上述基础上,利用2014年所制备的性成熟三代个体进行诱导,获得了牙鲆连续减数分裂雌核发育四代家系,并用覆盖牙鲆连锁群的24个微卫星标记进行了纯合度、遗传相似度等遗传特征的分析,进一步探讨等位基因在连续多代减数分裂雌核发育过程中的遗传变化规律,以期为牙鲆的纯系建立及品种改良提供基础数据。
1 材料与方法
1.1 连续四代减数分裂雌核发育家系的构建
本研究在中国水产科学研究院北戴河中心实验站开展。2007年,以真鲷()精子作为异源精子,经紫外线照射灭活,与1尾野生雌性牙鲆所产卵子受精,并在激活后3 min,施以0℃、45 min的冷休克处理进行减数分裂雌核发育诱导,获得第一代减数分裂雌核发育家系(G1)。2009年,利用G1内发育成熟的1尾个体再度诱导减数分裂雌核发育,获得连续第二代减数分裂雌核发育家系(G2)。2014年,以G2家系内性成熟的1尾个体进行减数分裂雌核发育诱导,获得了连续三代减数分裂雌核发育家系(G3)。2018年,对G3家系内成熟的1尾雌性个体再次诱导雌核发育,获得连续四代减数分裂雌核发育家系(G4)。
1.2 样品采集与基因组DNA提取
采集作为母本的G3家系亲鱼无眼侧的胸鳍和G4家系的15日龄仔鱼全鱼40尾,置于100%乙醇中固定,–20℃保存。以2尾野生雌雄鱼普通受精的后代作为对照组(Control,C)。基因组DNA采用海洋动物组织基因组DNA提取试剂盒(天根,DP324-02)提取。另外,本实验室尚保存着G2和G3家系的DNA样品(各 30尾),在本研究中用相同标记再次进行了检测和数据分析。
1.3 微卫星引物
微卫星引物全部选自牙鲆第二代遗传连锁图谱(Castaño-Sánchez, 2010),根据本课题组(刘永新等, 2013; Liu, 2013)的实验结果,选取24个高重组率标记,所选位点覆盖牙鲆24个连锁群。引物由生工生物工程(上海)股份有限公司合成。引物序列、退火温度和GenBank登录号见表1。
1.4 微卫星基因型检测
利用FAM和HEX分2批对24对引物的正向引物5¢端进行荧光标记,标记为FAM,被激发后呈蓝色;标记为HEX,被激发后呈绿色。PCR反应体系为15 μl,包括10×buffer 1.5 μl,Mg2+(25 mmol/μl) 1.5 μl,dNTPs (10 mmol/μl)各0.25 μl,上下游引物(10 pmol/μl)各0.15 μl,DNA聚合酶(5 U/μl) 0.2 μl,模板DNA(30~50 ng) 1 μl,ddH2O 9.5 μl。PCR反应程序:94℃预变性3 min;94℃ 25 s,50℃~54℃ 25 s,72℃ 60 s,35个循环;最后72℃延伸10 min。PCR扩增在PE9700型PCR仪上进行。取1 μl PCR产物与10 μl的Hidi Formamid和GeneScanTM-500 LIZ Size Standard混合液(Hidi Formamid∶GeneScanTM-500 LIZ Size Standard=80∶1)充分混合,95℃变性5 min,结束后迅速转移至冰上冷却。处理后的产物通过ABI 3700测序仪进行毛细管电泳,并利用GeneMarker V2.2.0软件进行基因分型。
1.5 统计指标
等位基因数(Number of alleles,a)、期望杂合度(Expected heterozygosity,e)、纯合度(Homozygosity,H)、遗传相似系数(Genetic similarity index,GSI)等遗传参数均由popgene (ver.3.2)计算获得,并利用SPSS19.0对各家系的遗传参数进行了test,检验其均值差异的显著性(<0.05)。重组率和近交系数(Nagy, 1982)由以下公式计算:
表1 24对微卫星标记位点引物序列、核心序列、退火温度和GenBank登录号

Tab.1 Primer sequences, core sequences, annealing temperatures, and accession number in GenBank of 24 microsatellite loci in the P. olivaceus
重组率=杂合子数/个体总数
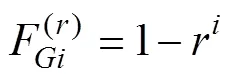
式中,为第世代的近交系数;为第代雌核发育家系;为微卫星位点的重组率。
2 结果与分析
2.1 各家系遗传信息比较
表2中统计了24个微卫星位点在G2、G3、G4以及对照组(C)中的等位基因数、期望杂合度和纯合度。结果显示,G2、G3和G4的总等位基因数分别为42、32和32;平均等位基因数分别为1.98、1.33和1.33;期望杂合度分别为0.3472、0.1694和0.1492;纯合度分别为0.6528、0.8306和0.8508。表3中整合了G1的数据,结果显示,G1、G2、G3和G4的等位基因数和期望杂合度显著低于对照组(N=4.0,e=0.6497) (<0.05),而纯合度则显著高于对照组(H=0.3503) (<0.05);前三代连续雌核发育系G1、G2和G3在遗传参数上有显著的变化,到第四代G4家系在遗传上趋于稳定。如纯合度,从G1(0.4929)到G2(0.6528),再到G3(0.8306)逐步提高,且代际间差异显著(<0.05),但G3与G4(0.8508)差异不显著。另外,杂合位点数随着雌核发育代数的增加而逐渐减少,但从G3到G4家系时趋于稳定,不再明显减少。
表2 连续雌核发育系G2、G3、G4和对照组C的遗传信息
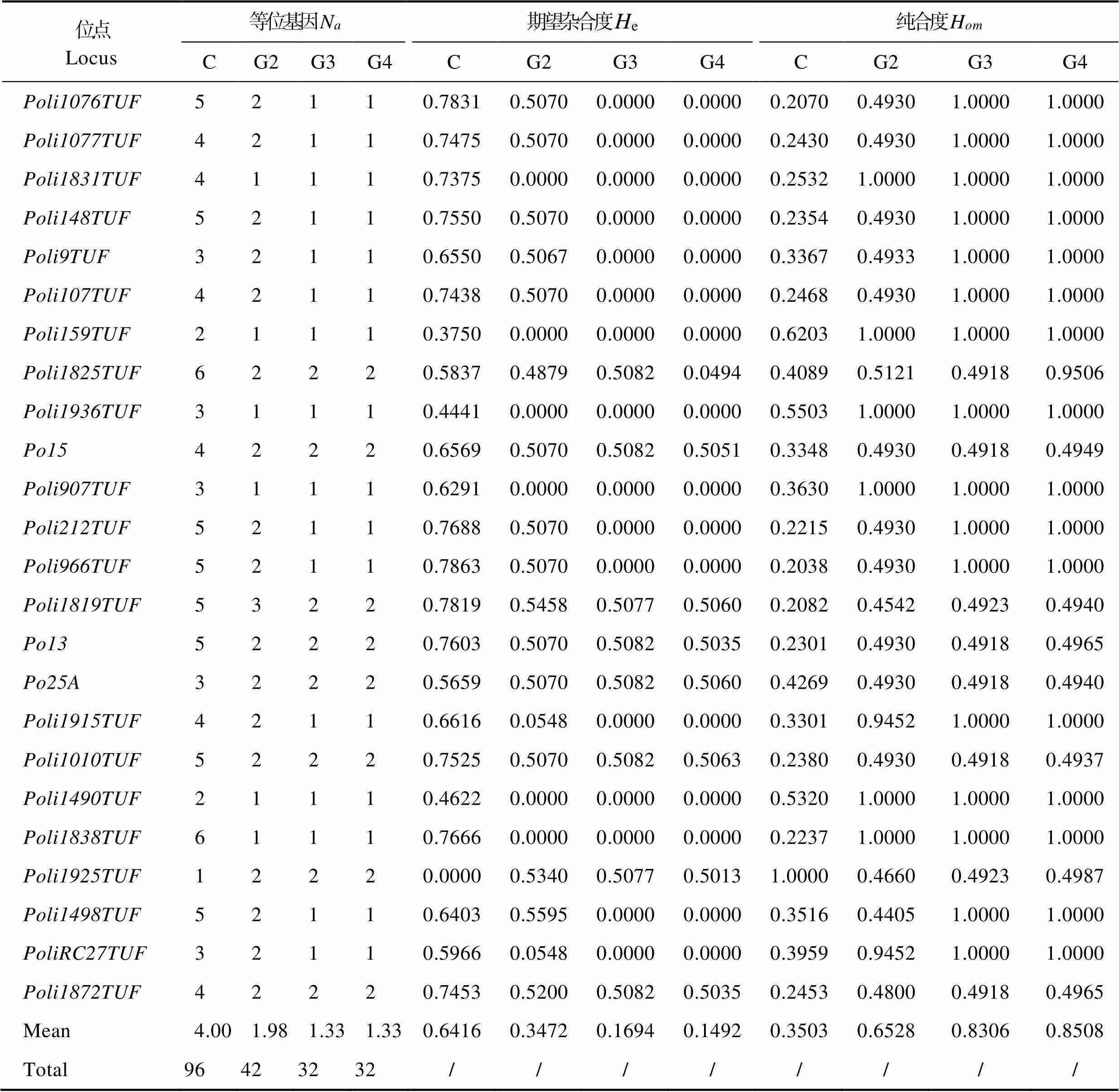
Tab.2 Number of alleles, heterozygosity and homozygosity of G2, G3, G4 and control
表3 雌核发育系G1、G2、G3、G4和对照组C的遗传参数的均值比较
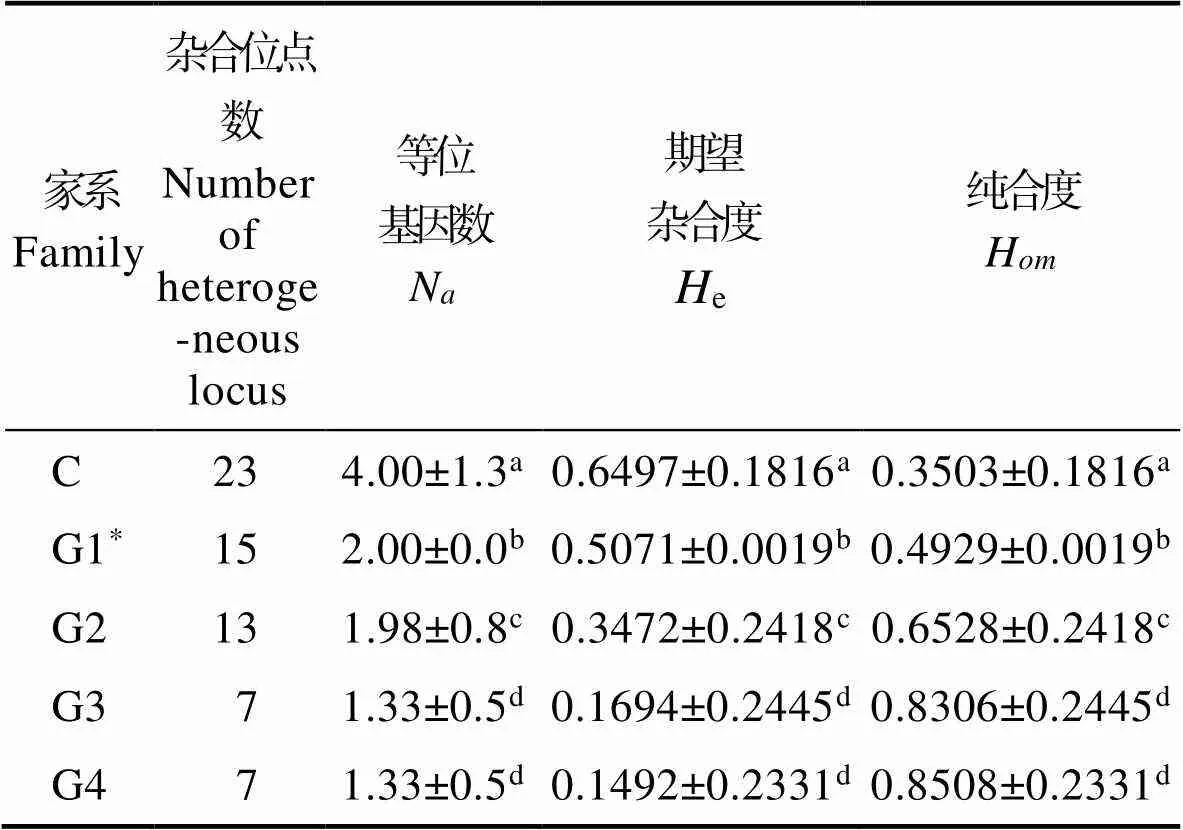
Tab.3 T-testof genetic parameters among G2, G3, G4 and control
*引用王桂兴等(2012)的数据;同列数据上标不同表示组间存在显著差异(<0.05),下同
* Data from Wang(2012); values in each column with different superscripts are significantly different (<0.05), the same as below
2.2 遗传相似度分析
结合已发表的G1数据,对连续雌核发育二倍体及对照组(C)家系内个体间的遗传相似度进行均值比较(表4)。结果表明,G1、G2、G3和G4的遗传相似度分别为0.8917、0.9238、0.9890和0.9988,均显著高于对照组(0.5822),G3和G4的遗传相似度已超过近交系的理论值(0.986)。在连续减数分裂雌核发育过程中,遗传相似度的变化规律与纯合度类似,G1到G2,再到G3均有显著提高(<0.05),G3到G4增幅不显著。
2.3 不同位点的纯合效率和近交系数
表5结果显示,G4家系中,24位点中有17个已完全纯合,近交系数达1.0000,但仍有7个位点保持杂合状态,近交系数仅为0.0963~0.3439。近交系数是衡量微卫星位点纯合速率的一个指标,并且微卫星位点的纯合速率与重组率紧密相关。在7个杂合位点中,、和3个位点仅检测到1个纯合个体,近交系数为0.0963,重组率高达0.9750。、和3个位点纯合个体数为2个,近交系数为0.1855,重组率为0.9500。检测到的纯合个体数为4,近交系数较高,为0.3439,重组率为0.9000。
表4 G1、G2、G3、G4和对照组家系内的个体间遗传相似度
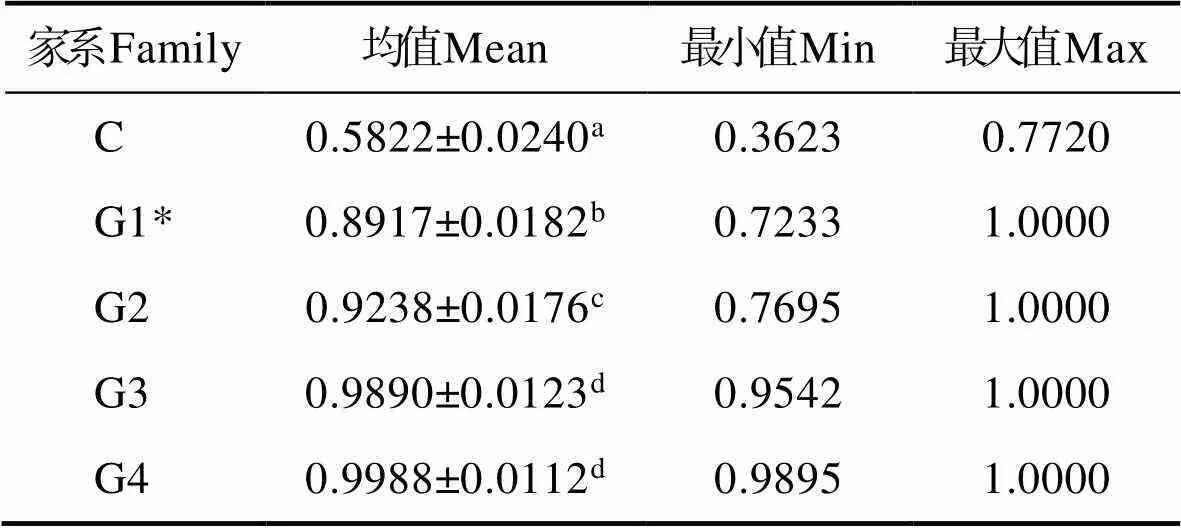
Tab.4 Genetic similarity indices among G1, G2, G3, G4 and control
3 讨论
本研究首次报道了牙鲆连续四代减数分裂雌核发育家系的建立,并通过24个高重组率微卫星标记进行了遗传特征研究。连续诱导减数分裂雌核发育能够快速提高牙鲆的纯合度和相似度,与Nagy等(1982)的研究结果相比,牙鲆减数分裂雌核发育一代相当于9~ 10个世代的全同胞交配,二代相当于11~12个世代的全同胞交配(王桂兴等, 2012)。而G4家系较前三代雌核发育家系具有更高的纯合度和相似度,其遗传相似度(0.9988)已高于连续20代全同胞交配所获得的理论值(0.9860)。另外,在大黄鱼(叶小军等,2010)连续两代减数雌核发育群体内个体间平均相似系数达0.8672,团头鲂(唐首杰等, 2014)连续三代减数分裂雌核发育群体内个体间的平均遗传相似度为0.9845,翘嘴鲌(李倩等, 2015)连续两代减数分裂雌核发育群体个体间的平均遗传相似度为1.0000。上述研究结果表明,连续诱导减数分裂雌核发育,能快速地提高遗传相似系数,是快速建立鱼类近交系的良好方法。
本研究与大黄鱼(叶小军等,2010)、团头鲂(唐首杰等, 2014)等连续雌核发育研究均显示,连续诱导减数分裂雌核发育过程中,不同位点的纯合速率不同,在脊尾白虾()近交系中也存在类似现象(王日芳等, 2017)。另外,结合已经发表的牙鲆雌核发育一代、二代及三代结果,发现标记的纯合速率与其重组率显著相关,低重组率的位点纯合较快,而部分高重组率微卫星标记的纯合度不随减数分裂雌核发育代数的增加而提高(王桂兴等, 2012; 侯吉伦等, 2014)。例如,位点在雌核发育一代的重组率为0.9333,二代为0.9667,三代为1.0000,四代为0.9750;位点在一代的重组率为0.9667,二代为0.9333,四代为0.9750。对于上述2个位点,每一代出现的纯合个体数在0~2之间,代际之间的重组率差异不明显。而微卫星位点重组率的高低取决于其在染色体上的位置。在水产动物上,根据重组率的差异,在众多物种上开展了标记‒着丝粒作图,以推定连锁群上标记和着丝粒的相对距离(Ji, 2009; Li, 2008)。在牙鲆上,韩慧宗等(2013)开展了微卫星标记‒着丝粒作图,并根据重组率的不同,将标记划分为远着丝粒区域、连锁群中部和着丝粒区域 3种类型,远着丝粒区域标记的重组率高于0.677。本研究中,7个杂合位点的重组率均高于0.9000,位于远着丝粒区域。研究结果表明,在鉴定连续雌核发育二倍体时,选择远着丝粒区域的标记(高重组率)才能够准确反映其纯合度、杂合度等遗传参数。
表5 G4家系中24个微卫星位点上纯合个体数量、比率、重组率和近交系数
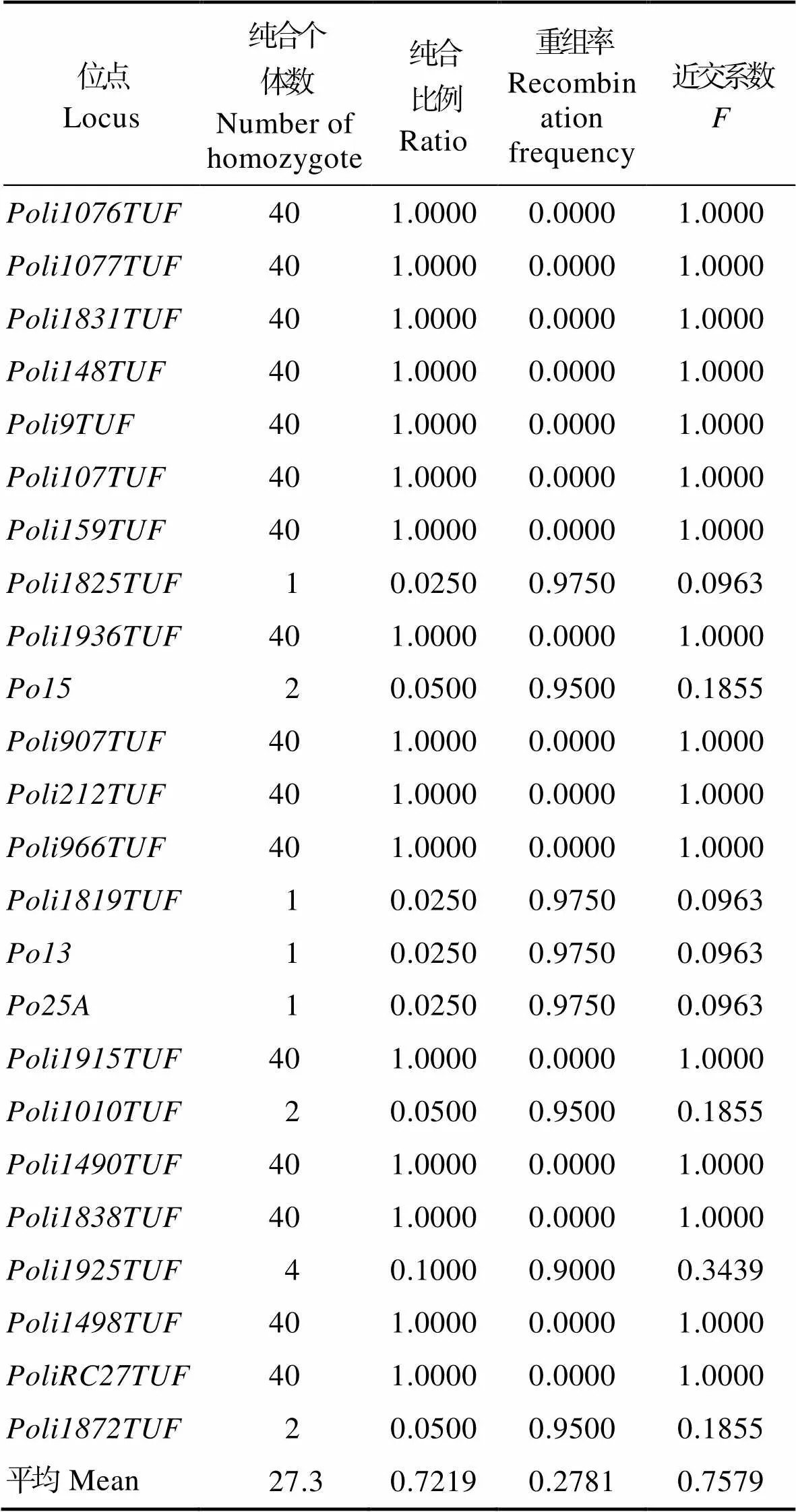
Tab.5 Number of homozygote, recombination frequency, breeding coefficients in gynogens of P. olivaceus for 24 detected microsatellite loci in G4
要使这些高重组率的位点纯合,必须在减数分裂雌核发育的基础上再次诱导有丝分裂雌核发育来实现。在牙鲆上,本团队通过筛选减数分裂雌核发育二倍体作为双单倍体诱导的亲本,提高了诱导效率,实现了双单倍体的批量制备(Zhang, 2018)。利用雌雄双单倍体或纯合克隆系之间的杂交,可制备杂合克隆(刘海金等, 2017)。杂合克隆的杂种优势明显,在育种上具有宝贵的价值。但在鱼类上,利用有丝分裂雌核发育或雄核发育诱导双单倍体效率极低,基于双单倍体的纯合克隆系制备则难度更高,目前只有少数几种鱼类成功制备了纯合克隆系(Komen, 2007)。但从双单倍体到纯合克隆,再到杂合克隆,仍有漫长的选育过程,期间充满着诸多的不确定性。与有丝分裂雌核发育相比,减数分裂雌核发育拥有较高的诱导效率和后代成活率,且连续三代和四代减数分裂雌核发育具有较高的纯合度和遗传相似度,但这些家系之间杂交的杂种优势如何,目前尚未开展研究。如果连续多代减数分裂雌核发育家系间杂交的杂种优势和杂合克隆系相近,则这些连续多代减数分裂雌核发育家系可作为纯合克隆系的有益补充,丰富克隆育种的材料,加快高产抗逆优质新品种的选育。
综上所述,通过连续四代减数分裂雌核发育所获得的牙鲆家系,具有高度的纯合度和遗传相似度,可用于基因重组热点、杂种优势以及新品种选育等研究。
Castaño-Sánchez C, Fuji K, Ozaki A,. A second generation genetic linkage map of Japanese flounder (). BMC Genomics, 2010, 11: 554
Han HZ, Jiang L, Liu Y,. Identifying genetic characteristics of different diploids in Japanese flounder based on M-C mapping. Journal of Fisheries of China, 2013, 37(3): 321– 329 [韩慧宗, 蒋丽, 刘奕, 等. 基于M-C作图鉴定牙鲆不同二倍体的遗传特征. 水产学报, 2013, 37(3): 321–329]
Hou JL, Li C, Wang GX,. Analysis of genetic structure of three third-generation of successive meiogynogenetic families in Japanese flounder,. Engineering Science, 2014, 16(9): 26–32 [侯吉伦, 李超, 王桂兴, 等. 牙鲆连续三代减数分裂雌核发育家系的遗传特征分析. 中国工程科学, 2014, 16(9): 26–32]
Ji XS, Chen SL, Liao XL,. Microsatellite-centromere mapping inusing gynogenetic diploid families produced by the use of homologous and non- homologous sperm. Journal of Fish Biology, 2009, 75(2): 422–434
Komen H, Thorgaard GH. Androgenesis, gynogenesis and the production of clones in fishes: A review. Aquaculture, 2007, 269(1): 150–173
Li Q, Gu ZM, Jia YY,. Analysis of genetic characteristics of two successive generation meiosis gynogenetic population inBleeker. Journal of Shanghai Ocean University, 2015, 24(1): 1–11 [李倩, 顾志敏, 贾永义, 等. 翘嘴鲌连续两代减数分裂雌核发育群体的遗传特征分析. 上海海洋大学学报, 2015, 24(1): 1–11]
Li YY, Cai MY, Wang ZY,. Microsatellite-centromere mapping in large yellow croaker () using gynogenetic diploid families. Marine Biotechnology, 2008, 10(1): 83–90
Liu HJ, Hou JL, Chang YM,. Induced meiogynogenesis in Japanese flounder () by sperm of red sea bream(). Journal of Fisheries of China, 2010a, 34(4): 508–514 [刘海金, 侯吉伦, 常玉梅, 等. 真鲷精子诱导牙鲆减数分裂雌核发育. 水产学报, 2010a, 34(4): 508–514]
Liu HJ, Hou JL, Liu Y. Gynogenesis in Japanese flounder: A review. Journal of Fishery Sciences of China, 2017, 24(4): 902–912 [刘海金, 侯吉伦, 刘奕. 牙鲆雌核发育研究进展. 中国水产科学, 2017, 24(4): 902–912]
Liu HJ, Liu YX, Wang YF,. Genetic difference between meiotic gynogenesis and mitotic gynogenesis in the Japanese flounder. Journal of Fisheries of China, 2010b, 34(6): 718– 724 [刘海金, 刘永新, 王玉芬, 等. 牙鲆减数分裂与有丝分裂雌核发育的遗传差异. 水产学报, 2010b, 34(6): 718– 724]
Liu YX, Han HZ, Wang QL,. Choice of microsatellite markers for identifying homozygosity of mitotic gynogeneticdiploids in Japanese flounder. Journal of Fish Biology, 2013, 82(2): 588–599
Liu YX, Zhu YM, Liu YJ,. Analysis of genetic diversity in Bohai natural population of. Journal of Fisheries of China, 2013, 37(11): 1609–1617 [刘永新, 朱以美, 刘英杰, 等. 牙鲆渤海自然群体的遗传多样性分析. 水产学报, 2013, 37(11): 1609–1617]
Nagy A, Csányi V. Changes of genetic parameters in successive gynogenetic generations and some calculations for carp gynogenesis. Theoretical and Applied Genetics, 1982, 63(2): 105–110
Tabata K, Gorie S, Nakamura K. Induction of gynogenetic diploid in hirame. Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52(11): 1901–1904 [田畑和男, 五利江重昭, 中村一彦. 紫外線によるヒラメの雌性発生2倍体の誘起条件. 日本水産学会誌, 1986, 52(11): 1901–1904]
Tang SJ, Li SF, Cai WQ. Analysis of genetic homozygosity and diversity of three successive generations of meio-gynogeneticpopulation inusing microsatellite markers. Freshwater Fisheries, 2014, 44(2): 3–8 [唐首杰, 李思发, 蔡完其. 团头鲂连续三代减数雌核发育群体遗传变异的微卫星分析. 淡水渔业, 2014, 44(2): 3–8]
Wang GX, Liu HJ, Zhang XY,. Analysis of homozygosity and genetic similarity between two successive generations in a meiogynogenetic Japanese flounder family. Journal of Fishery Sciences of China, 2012, 19(3): 381–389 [王桂兴, 刘海金, 张晓彦, 等. 牙鲆连续两代减数分裂雌核发育家系的遗传特征. 中国水产科学, 2012, 19(3): 381–389]
Wang RF, Li J, Li JT,. Genetic analysis of 33 microsatellite loci in 3 families ofinbred line. Progress in Fishery Sciences, 2017, 38(4): 78–86 [王日芳, 李健, 李吉涛, 等. 脊尾白虾()近交系3个家系33个微卫星座位的遗传分析. 渔业科学进展, 2017, 38(4): 78–86]
Wang W, You F, Gao TX,. Microsatellite markers analysis on artificial meiogynogenetic stock of. Chinese High Technology Letters, 2005, 15(7): 107–110 [王伟, 尤锋, 高天翔, 等. 人工诱导牙鲆异质雌核发育群体的微卫星标记分析. 高技术通讯, 2005, 15(7): 107–110]
Xu C, Wang KL, Xu YL,. Recombination and expression of paternal gene of isozymes in gynogenetic olive flounder. Oceanologia et Limnologia Sinica, 2002, 33(1): 62–67 [徐成, 王可玲, 徐永立, 等. 雌核发育牙鲆同工酶基因的重组及父方基因的表达. 海洋与湖沼, 2002, 33(1): 62–67]
Yamamoto E. Studies on sex-manipulation and production of cloned populations in hirame,(Temminck etSchlegel). Aquaculture, 1999, 173(1–4): 235– 246
Ye XJ, Wang ZY, Liu XD,. Analysis of genetic homozygosity and diversity of two successive generation meio-gynogenetic population inusing microsatellite markers. Acta Hydrobiologica Sinica, 2010, 34(1): 144–151 [叶小军, 王志勇, 刘贤德, 等. 大黄鱼连续两代雌核发育群体的微卫星标记分析. 水生生物学报, 2010, 34(1): 144–151]
Zhang XY, Wang GX, Sun ZH,. Mass production of doubled haploids in Japanese flounder,. Journal of the World Aquaculture Society, 2018, 49(2): 420–428
Zhu XC, Liu HJ, Sun XW,. Assessment of homozygosity in gynogenetic diploid using microsatellite markers in Japanese flounder (). Zoological Research, 2006, 27(1): 63–67 [朱晓琛, 刘海金, 孙效文, 等. 微卫星评价牙鲆雌核发育二倍体纯合性. 动物学研究, 2006, 27(1): 63–67]
Genetic Analysis of Four Generations of a Successive Meiogynogenetic Population in the Japanese Flounder,
WANG Guixing, ZHANG Xiaoyan, SUN Zhaohui, ZHAO Yaxian, DU Wei, HOU Jilun①, WANG Yufen①
(Beidaihe Central Experiment Station, Chinese Academy of Fishery Sciences, Qinhuangdao 066100)
Artificially induced gynogenesis is a form of chromosome manipulation for sex control, accelerating both the elimination of recessive deleterious genes and the rapid establishment of inbred lines that could benefit the breeding progress in fish species. Artificially induced gynogenesis can be divided by mechanism into meiogynogenesis and mitogynogenesis. In this study, the fourth generation of a successive meiogynogenetic population (G4) in Japanese flounder () was established by induction of meiogynogenesis, in which the eggs of third-generation females (G3) were activated by ultraviolet-irradiated red sea bream () sperm, followed by a cold-shock treatment at 0℃, starting 3 min after activation and lasting 45 min. We evaluated the genetic structure of the control, G2, G3, and G4 populations with 24 microsatellite markers and a high recombination rate that covered all linkage groups of the flounder. The efficiency of successive meiogynogenesis in terms of producing a highly inbred line was quantified by calculating the homozygosity and genetic similarity. The results showed that 96, 42, 32, and 32 alleles were detected in the control, G2, G3, and G4 populations, respectively; the average numbers of alleles were 4.00, 1.98, 1.33, and 1.33, respectively; and the average expected heterozygosities were 0.6416, 0.3472, 0.1694, and 0.1492, respectively. The average homozygosities among the 24 analyzed loci were 0.3503, 0.6528, 0.8306, and 0.8508, respectively. In the G4 population, 17 loci were homozygous, while 7 remained heterozygous. With respect to genetic similarity, the average similarity indexes between offsprings within populations were 0.5822, 0.9238, 0.9890, and 0.9988, respectively. Among G1, G2, and G3 populations, the homozygosity and genetic similarity index increased significantly (0.05) with generations. However, the differences in homozygosity and genetic similarity index between G3 and G4 were not significant. Our results indicate that artificially induced successive meiogynogenesis can effectively increase the homozygosity of individuals, as well as the genetic similarity of offspring within a population. Successive meiogynogenesis has a higher induction rate than mitogynogenesis, and therefore is a useful alternative method for establishing clonal lines in fish.
; SSR; Gynogenesis clonal line; Genetic diversity; Heterozygous locus
S917
A
2095-9869(2019)06-0048-08
10.19663/j.issn2095-9869.20180907001
http://www.yykxjz.cn/
王桂兴, 张晓彦, 孙朝徽, 赵雅贤, 都威, 侯吉伦, 王玉芬. 牙鲆连续四代减数分裂雌核发育家系的遗传特征分析. 渔业科学进展, 2019, 40(6): 48–55
Wang GX, Zhang XY, Sun ZH, Zhao YX, Du W, Hou JL, Wang YF. Genetic analysis of four generations of a successive meiogynogenetic population in the Japanese flounder,. Progress in Fishery Sciences, 2019, 40(6): 48–55
* 河北省自然科学基金优秀青年科学基金(C2018107006)和现代农业产业技术体系(CARS-47)共同资助[This work was supported by Natural Science Foundation of Hebei Province(C2018107006), and China Agriculture Research System (CARS-47)]. 王桂兴,E-mail: 13903343053@163.com
侯吉伦,副研究员,E-mail: jilunhou@126.com;王玉芬,副研究员,E-mail: wangyf-8000@163.com
2018-09-07,
2018-10-13
HOU Jilun, E-mail: jilunhou@126.com; WANG Yufen, E-mail: wangyf-8000@163.com
(编辑 马璀艳)
