饲用溶菌酶对吉富罗非鱼消化道组织结构和营养物质消化吸收的影响*
2019-12-06赵金鑫刘东来华雪铭杨景丰
王 坛 赵金鑫 刘东来 孔 纯 华雪铭,2,3 吴 钊 王 刚 冯 悦,2,3 杨景丰,2,3 刘 韬,2,3
饲用溶菌酶对吉富罗非鱼消化道组织结构和营养物质消化吸收的影响*
王 坛1,4赵金鑫4刘东来5孔 纯1华雪铭1,2,3①吴 钊1王 刚1冯 悦1,2,3杨景丰1,2,3刘 韬1,2,3
(1. 上海海洋大学农业农村部鱼类营养与环境生态研究中心 上海 201306;2. 上海海洋大学农业农村部淡水水产种质资源重点实验室 上海 201306;3. 上海海洋大学水产科学国家级实验教学示范中心 上海 201306;4. 广东海大集团股份有限公司 广州 511400;5. 安徽省巢湖市中旱镇农业综合服务中心水产站 巢湖 238054)
为了解饲用溶菌酶对吉富罗非鱼()消化道组织结构发育和营养物质利用的影响,本研究设计5种饲料溶菌酶添加水平:18 mg/kg (L18)、36 mg/kg (L36)、54 mg/kg (L54)、72 mg/kg (L72)和90 mg/kg (L90),以不添加溶菌酶的饲料(L0)为对照,进行为期60 d的饲养。结果显示,饲料中添加溶菌酶对吉富罗非鱼肝脏和胃肠道消化酶活性产生了不同程度的影响。L36、L54和L72组的胃、前肠和中肠蛋白酶活性显著高于对照组(<0.05),肝脏、前肠脂肪酶活性在L54和L72组均显著高于对照组(<0.05),淀粉酶活性在除前肠、中肠外的L72和L90组显著高于对照组(<0.05)。L36、L54和L72组鱼的肠道不同部位肠绒毛密度、高度和宽度较对照组显著提高,在肌层厚度上,溶菌酶添加组在前肠和后肠部位有下降趋势,L18、L36和L90组显著低于对照组(<0.05),而在中肠部位,肌层厚度随添加水平升高而呈先升后降的变化趋势,L36、L54和L72组在数值上高于对照组,但无显著性差异(>0.05);杯状细胞数量在L54和L72组均显著高于对照组(<0.05)。肝脏切片图显示,L36和L54组肝细胞排列整齐、形状饱满,相较于对照组更致密,但高剂量添加组的肝脏健康程度有下降趋势。消化吸收率方面,在饲养Ⅰ期和Ⅱ期,L36和L54组对粗蛋白的表观消化率显著高于对照组,到饲养Ⅲ期和Ⅳ期,L36~L90组对干物质、粗蛋白和粗脂肪的消化吸收率均有显著提高(<0.05)。研究表明,在本实验条件下,36、54 mg/kg溶菌酶添加水平具有最稳定的作用效果,吉富罗非鱼通过肝肠发育和消化酶活性的提高来促进对饲料干物质、粗蛋白和粗脂肪的消化吸收。
吉富罗非鱼;溶菌酶;消化吸收率;消化酶;肝肠组织形态
近年来,随着水产养殖业的迅速发展,由细菌、病毒引起的水产动物病害也日益凸显,持续制约着养殖动物的生产和产业效益的提高。抗生素虽是解决这一问题的有效方法,但药物残留、机体耐药性、环境污染等弊端以及对人类健康构成的潜在威胁,显然已不能在养殖生产实际中首选使用。溶菌酶是一类具有天然抗菌活性的蛋白多肽类物质,对包括细菌、真菌等在内的病原微生物具有广谱抑菌作用,已作为一种新型绿色的饲用酶制剂而应用于动物生产中。在畜禽动物上的研究发现(王军等, 2013; 张世卿等, 2008; 顾维智等, 2008; 王晓可等, 2008),日粮中添加溶菌酶对家畜家禽有不同程度的促生长以及提高饲料利用率和自身抗病力的作用,可以完全或部分替代抗生素,但由于水产动物特殊的生活环境和生理生化特点,加之溶菌酶活性易受水产饲料加工等因素的影响,饲用溶菌酶在水产动物中的应用研究还较少,且作用效果仍存在一定程度的差异(邢思华等, 2013; Chen, 2014)。研究表明,溶菌酶不仅是一种有活性的免疫调节因子,同时又是一种主要的消化酶,与动物的消化系统密切相关(Nilsen, 1999)。此外,饲料中外源性酶制剂的添加能改变鱼类内源消化酶的活性,进而对其消化能力产生影响(张璐等, 2007; 黎军胜等, 2006; 叶元土等, 1993)。虽然鱼的不同种类、不同食性和消化道结构及不同生长期和养殖环境均与机体的消化功能存在一定关系,但对于溶菌酶是否与其他酶制剂一样影响养殖鱼类营养物质消化利用和消化机能,尚未见报道。
吉富罗非鱼()是经遗传性状改良后的尼罗罗非鱼。该品系罗非鱼因其生长速度快、出肉率高、肌肉必需氨基酸种类齐全且含量丰富,是一种经济价值和营养价值均较高的鱼类,在我国南方有广泛的养殖。然而,在实际生产过程中发现,该鱼摄食量大而杂,尤其在集约化养殖模式中,更易聚积过多残饵和粪便,对鱼的消化机能和组织健康造成威胁。为此,本研究在吉富罗非鱼基础饲料中添加不同水平的溶菌酶制品,通过比较各组鱼对营养物质的消化能力、消化酶活性及消化道器官发育和健康程度三方面来综合评估饲用溶菌酶对吉富罗非鱼营养物质消化和消化道组织健康的影响,以期为溶菌酶在以罗非鱼为代表的杂食性有胃鱼类健康养殖中的合理应用提供理论依据。
1 材料与方法
1.1 实验设计与饲料
根据吉富罗非鱼的营养需求(NRC, 2011),以鱼粉、豆粕、花生粕和菜籽粕为主要蛋白源,以鱼油和豆油为主要脂肪源,配制成粗蛋白、粗脂肪和总能水平分别为35.41%、5.77%和22.87 kJ/g的基础饲料,在此基础上,分别添加18、36、54、72和90 mg/kg,即9×104、1.8×105、2.7×105、3.6×105和4.5×105U/kg的溶菌酶制品(上海沈李科工贸公司;初始酶活性5×103U/mg),分别记为L0(对照组)、L18、L36、L54、L72和L90。饲料原料粉碎过40目筛,微量成分采用逐级扩大的方法添加,与大宗原料混合均匀后用制粒机(SLP-45, 中国水产科学研究院渔业机械仪器研究所)制成粒径为2.0 mm的硬颗粒饲料,制粒温度控制在(75±5)℃。自然风干后于-20℃冰箱冷藏备用。实验饲料组成及营养水平见表1。
表1 吉富罗非鱼基础饲料组成及营养水平(%, 风干基础)
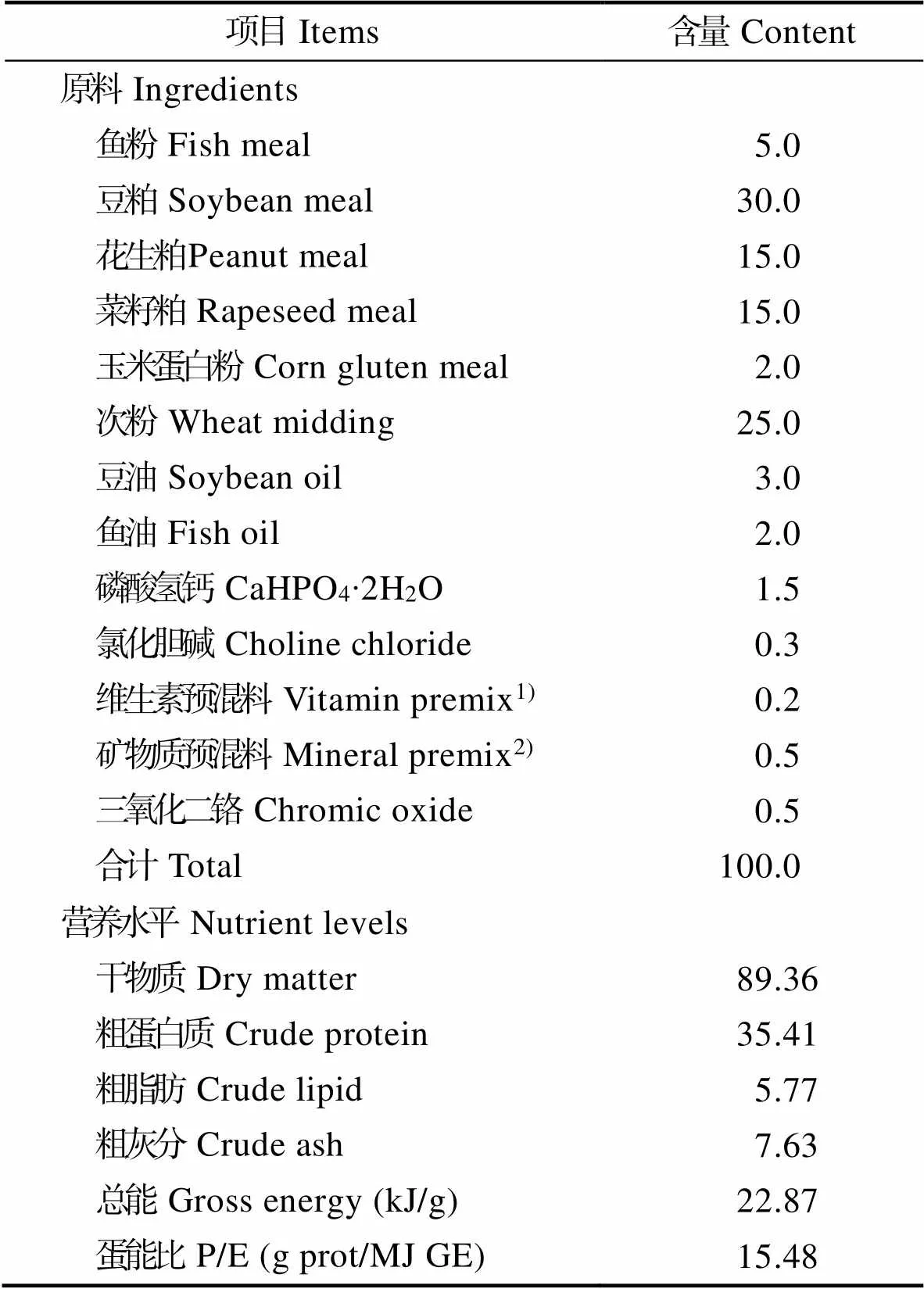
Tab.1 Composition and nutrient levels of the basal diet for GIFT tilapia (%, air-dry basis)
注: 1) 维生素预混料为每千克饲料提供 Vitamin premix provided the following per kg of the diet: 硫胺素thiamine 20.00 mg, 核黄素 riboflavin 20.00 mg, 吡哆醛 pyridoxine 10.00 mg, 尼克酸 nicotinic acid 10.00 mg, 泛酸钙 calcium pantothenate 50.00 mg, 生物素 biotin 1.0 mg, 叶酸 folic acid 5.0 mg, 肌醇 inositol 500 mg, VC100 mg, VE50 mg, VA2 mg, VB120.02 mg, VK310 mg, VD30.05 mg
2)矿物质预混料为每千克饲料提供Mineral premix provided the following per kg of the diet: ZnSO4·7H2O 525.5 mg, MnSO4·H2O 49.2 mg, KI 5.23 mg, FeSO4·7H2O 238.8 mg, MgSO4·7H2O 4.62 g, CuSO4·5H2O 11.8 mg, CoCl2·6H2O 0.2 mg, Na2SeO40.66 mg, KCl 600 mg, NaCl 107.1 mg
1.2 实验用鱼与饲养管理
饲养实验在上海海洋大学滨海养殖基地进行。选用规格一致、平均体重为(11.35±0.08)g的吉富罗非鱼960尾,随机分配于24个等大尼龙网箱中(分为6组, 每组4个重复),每网箱40尾。对照组饲喂基础饲料,5个实验组分别对应饲喂L18~L90组的实验饲料。实验用鱼饲养于室外水泥池中的24口等大尼龙网箱(1.2 m×1.8 m×1.2 m)中,水源为天然河水。用基础饲料驯化7 d,待其摄食正常后开始正式实验。日投喂采取定量投喂方式,每天定点投喂3次(08:00、12:00和17:00),日投饵率为鱼体重的3%~8%,根据生长阶段、天气、摄食状况调整投喂量。实验期间24 h充气,定期换水,水温为26~34℃,溶氧>5 mg/L,氨氮含量<0.3 mg/L,养殖周期为60 d。
1.3 消化实验
实验期间,按照基础饲料配方以0.5%的Cr2O3作为指示剂进行不同时期的消化率实验,实验前预饲7 d。每天08:00投料30 min后收集粪便,取具包膜、结构完整者风干后65℃恒温烘干,保存于干燥器中,连续收集4次(1~15 d/Ⅰ期; 16~30 d/Ⅱ期; 31~45 d/Ⅲ期; 46~60 d/Ⅳ期)。每网箱每一阶段的鱼粪混合均匀后称重,作为分析样品。测定实验饲料和粪便样品中的干物质、粗蛋白、粗脂肪和Cr2O3含量,以计算饲料常规营养成分的表观消化率(Apparent digestibility coefficients,ADCs)。其中,水分含量采用105℃烘箱干燥恒重法测定;粗蛋白含量采用凯氏定氮法(总氮×6.25)测定;粗脂肪含量采用氯仿–甲醇提取法测定;Cr2O3用高氯酸–硝酸湿式灰化后进行定量测定。
饲料营养物质(干物质、粗蛋白和粗脂肪)ADCs的计算方法如下所述:
ADC(%)=100×[1–(×cr)/(×cr)];
式中,为粪便中的营养物质含量;为饲料中营养物质含量;cr为饲料中Cr2O3的含量;cr为粪便中Cr2O3的含量。
1.4 肝脏和胃肠道消化酶测定
饲养实验结束后,禁食24 h,用丁香酚溶液麻醉,解剖取样。每网箱取6尾鱼的肝脏和胃肠道组织,并根据Cataldi等(1987)和Garcia等(2001)的方法分离出前、中、后肠,各部分组织用0.86%的预冷鱼用生理盐水洗去内容物,装袋保存于–20℃冰箱。检测前,将肝脏或胃肠道组织在4℃冰箱解冻,按照质量∶体积=1 : 9的比例用上述生理盐水匀浆,然后4℃、4000 r/min离心10 min,取上清液并稀释不同倍数后进行消化酶比活力的测定,并于24 h内测完。其中,蛋白酶和淀粉酶比活力测定部位是肝脏、胃和前、中、后肠,脂肪酶仅测定其生理性发生和存量最多的肝脏和前肠部位。蛋白酶活力采用福林酚法测定,酶活力定义:每毫克蛋白40℃下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位(U/mg prot) (施兆鸿等, 2016)。其中,胃蛋白酶在pH=2.4的酸性介质条件下测定,肠道和肝脏蛋白酶在pH=7.5中性介质条件下测定(刘爱君等, 2009)。淀粉酶(AMS)活力采用碘-淀粉比色法测定,酶活力定义(施兆鸿等, 2016):每毫克蛋白在37℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位(U/mg prot)。
脂肪酶(LPS)活力使用南京建成生物工程研究所试剂盒测定,酶活力定义:37℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol的底物为1个酶活力单位(U/g prot) (施兆鸿等, 2016),以下检测结果中统一转化为(U/mg prot)。
组织样本中总蛋白含量的测定采用考马斯亮蓝法。
上述组织淀粉酶、脂肪酶和总蛋白含量均使用南京建成生物工程研究所提供的专业试剂盒进行测定,检测方法和酶活力定义均按照说明书进行。
1.5 肝脏和肠道组织切片观察
饲养实验结束时,每网箱随机取2尾鱼,取约1 cm3肝脏和2~3 cm的前、中、后肠组织块(根据1.4方法划分肠道,并在各肠段和肝脏的中间处取材),用0.86%鱼用生理盐水轻轻冲洗,滤干水分后,用Bouin氏液固定,24 h后,转移至70%酒精中用于石蜡切片的制作。切片制作过程中,组织样本经过常规系列梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(5 μm)和H&E染色后,在普通光学显微镜下观察、拍摄并测量肠绒毛高度(HF)、宽度(HW)、密度(HD)和肌层厚度(tML),统计杯状细胞数量(dGC),每个样本取5张染色结果较好的切片进行拍照。其中,HF和HW均选取一个肠道横截面中的5根最高绒毛为测量对象;HD是以一个肠道横截面的全部绒毛数量为测量值;dGC为横切面上5根最高肠绒毛上皮层中的杯状细胞数目;tML为横切面上表征整个肠壁肌肉层的最大厚度(李志刚等, 2007; 黄玉章等, 2010; 于朝磊等, 2014)。
1.6 数据分析
实验数据均以平均值±标准差(Mean±SD)表示,采用SPSS 17.0分析软件进行单因素方差分析(One-way ANOVA),若影响显著,则采用Duncan氏法进行多重比较,<0.05为差异显著。
2 结果
2.1 饲用溶菌酶对不同饲养时期吉富罗非鱼饲料营养成分表观消化率的影响
经过60 d的饲养,各添加组鱼在不同生长期对饲料营养成分的表观消化率见表2。在饲养Ⅰ期,各组鱼对干物质、粗蛋白和粗脂肪的表现消化率分别为60.48%~69.03%、82.38%~87.62%和70.71%~76.20%,其中,L36和L54组鱼对干物质和粗蛋白的表观消化率显著高于对照组(<0.05),在L54组达到最大值。各溶菌酶添加组鱼对粗脂肪的表观消化率均显著低于对照组(<0.05),L72组最低;在饲养Ⅱ期,各组鱼对干物质、粗蛋白和粗脂肪的表观消化率分别为69.24%~74.30%、88.04%~92.00%和80.82%~88.24%,随溶菌酶添加量的增加,实验鱼对粗蛋白的表观消化率整体呈现先升后降的变化趋势,L54~L90组显著高于对照组,此时3组鱼对干物质、粗脂肪的表观消化率存在显著下降(<0.05);在饲养Ⅲ期,各组鱼对干物质、粗蛋白和粗脂肪的表观消化率为63.32%~ 71.67%、84.32%~88.79%和81.44%~88.58%,L36~L90组的干物质、粗蛋白表观消化率均显著高于对照组,且L90组显著高于其他各组(<0.05),同时,粗脂肪表观消化率在组间也整体呈现上升趋势,显著高于对照组(<0.05);在饲养Ⅳ期,各组鱼对饲料干物质、粗蛋白和粗脂肪的表观消化率分别为59.25%~66.06%、79.63%~87.46%和64.78%~75.09%,除L54组外,其他各溶菌酶添加组鱼对饲料干物质、粗蛋白和粗脂肪的表观消化率均显著高于对照组(<0.05),在L90组呈现最大值。
2.2 饲用溶菌酶对消化酶活力的影响
由表3可见,饲用溶菌酶对吉富罗非鱼肝脏和胃肠道消化酶活力产生了不同程度的影响。与对照组相比,溶菌酶的添加对罗非鱼胃、前肠和中肠蛋白酶活力具有显著促进作用,在L36、L54和L72组呈现最大值(<0.05),后肠蛋白酶活力在组间无显著性差异(>0.05);淀粉酶方面,在高剂量添加剂组(L72和L90)的肝脏、胃和后肠部位显著高于对照组(<0.05),前肠中L54组显著高于对照组,但在L72和L90组显著低于对照组(<0.05),中肠部位在除L72组外的其余添加组均显著高于对照组(<0.05);脂肪酶方面,L54和L72组在肝脏和前肠部位的酶活力显著高于对照组和其他各添加组(<0.05)。
2.3 肝脏组织结构变化
经过60 d养殖实验后,各组鱼肝脏组织切片结果见图1A~F。对照组和L18组鱼出现较多的肝细胞核偏移和个别细胞核消失现象(图1箭头所示);L36和L54组鱼肝细胞排列整齐,形状饱满,相较于L0和L18组更致密,大小均一;高剂量添加组(L72和L90)鱼肝细胞排列相对稀疏,出现较多的核消失、移和浓缩现象,L90组伴有纤维化趋势(图1箭头所示)。
表2 饲用溶菌酶对吉富罗非鱼不同饲养时期营养物质表观消化率的影响(%)
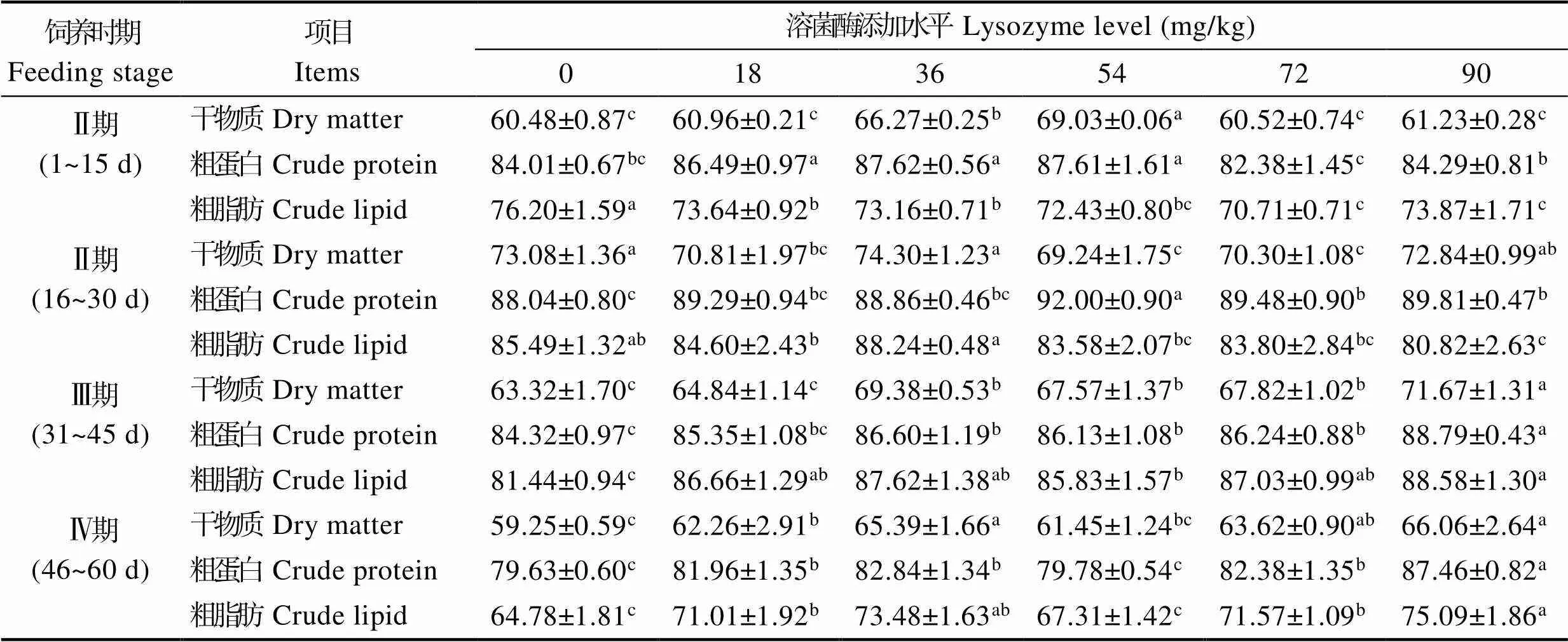
Tab.2 Effects of dietary lysozyme supplementation on apparent digestibility coefficients (ADCs) of GIFT tilapia at different feeding stages (%)
注: 不同上标字母表示显著性差异。下同
Note: Different superscript letters represent significant difference. The same as below
表3 饲用溶菌酶对吉富罗非鱼肝脏和胃肠道消化酶活力的影响(U/mg prot)

Tab.3 Effects of dietary lysozyme supplementation on digestive enzyme activities of GIFT tilapia in the liver and gastrointestine (U/mg prot)
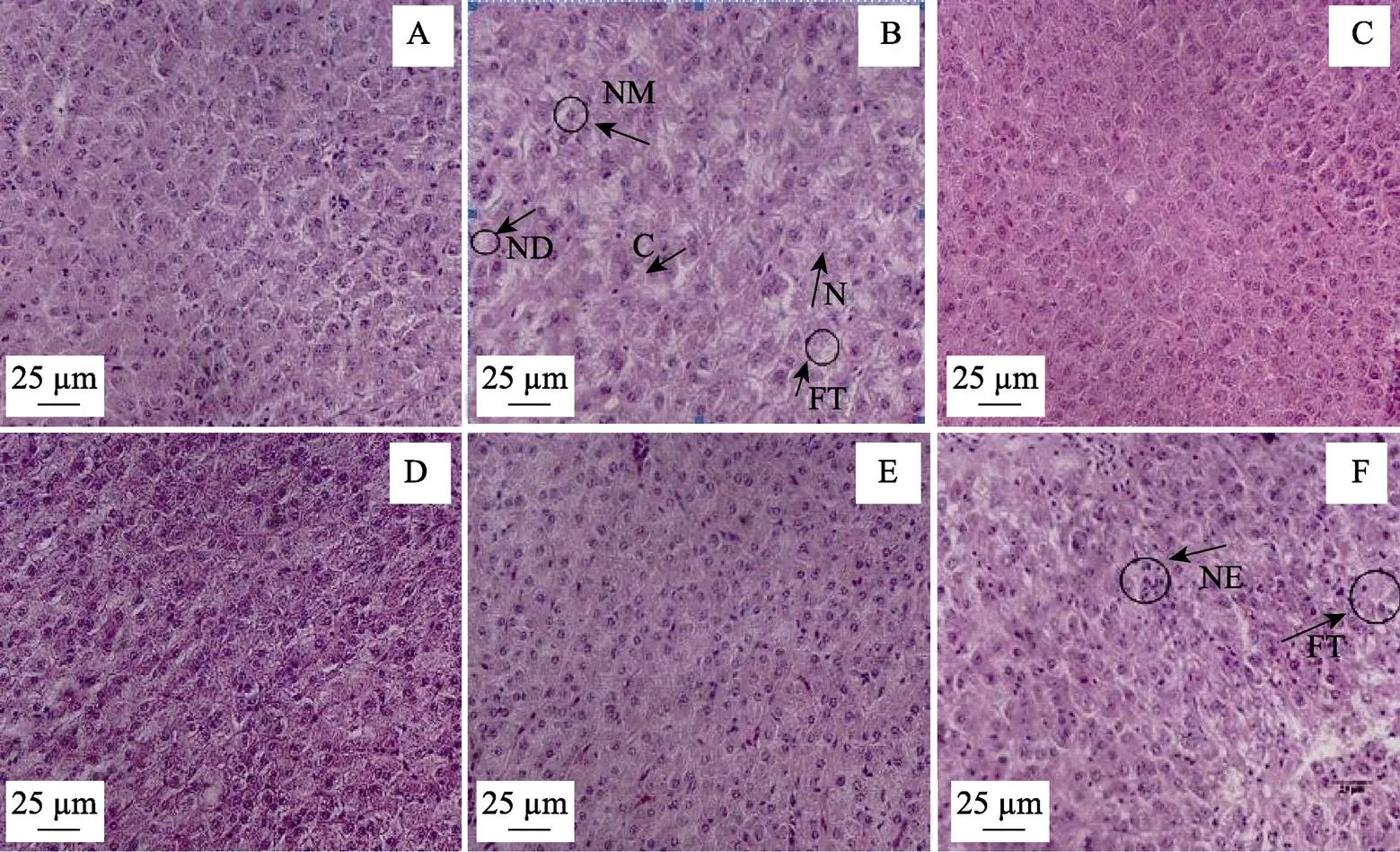
图1 饲用溶菌酶对吉富罗非鱼肝脏形态、结构的影响(×400)
A: L0组; B: L18组; C: L36组; D: L54组; E: L72组; F: L90组 C: 细胞质; N: 细胞核; NM: 核偏移; ND: 核消失; NE: 核浓缩; FT: 纤维化
A: L0 group; B: L18 group; C: L36 group; D: L54 group; E: L72 group; F: L90 group C: Cytoplasm, N: Cell nucleus, NM: Nuclear migration, ND: Nuclear disappear, NE: Nuclear enrichment; FT: Fibrillation
2.4 肠道组织形态结构
2.4.1 形态学指标 由表4可见,经过60 d的饲养,不同溶菌酶添加水平对吉富罗非鱼的肠道各部位形态学指标也产生了不同程度的影响。绒毛密度上,溶菌酶添加组较对照组要明显增多(L18组除外,< 0.05),但高剂量添加下(L90)存在显著或数值上的下降趋势。绒毛高度和宽度方面,L54和L72组在前肠和中肠部位均显著高于对照组,后肠绒毛高度在L54和L90组较高,且各溶菌酶添加组的后肠绒毛宽度较对照组均显著增加(<0.05);在肌层厚度上,溶菌酶添加组在前肠和后肠部位有下降趋势,L18、L36和L90显著低于对照组(<0.05),而在中肠部位,肌层厚度随添加水平升高而呈现先升后降的变化趋势,L36~L72组在数值上高于对照组,但无显著性差异(>0.05)。
表4 饲用溶菌酶对吉富罗非鱼肠道形态学指标的影响(μm)
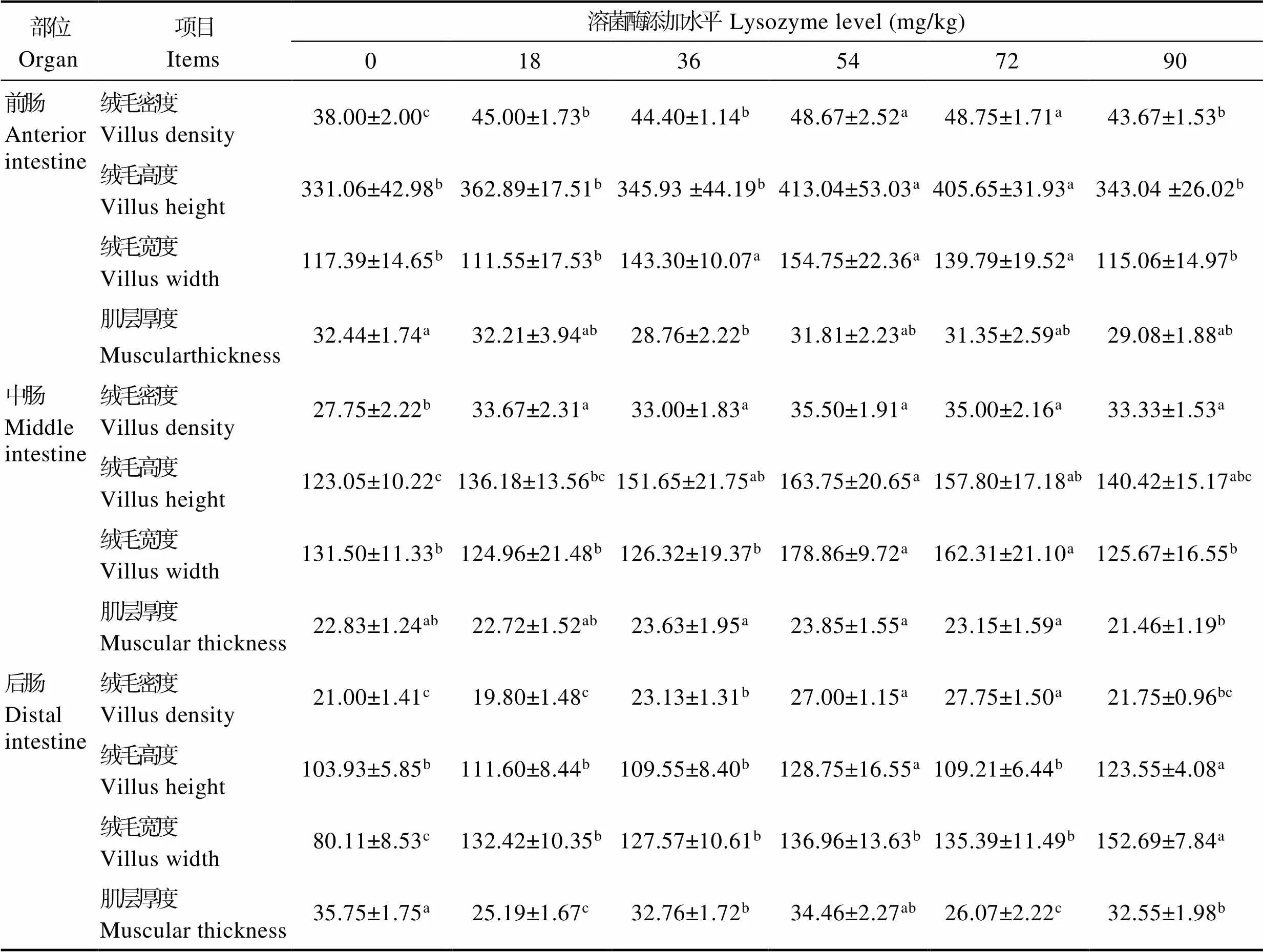
Tab.4 Effects of dietary lysozyme supplementation on intestinal morphology of GIFT tilapia (μm)
2.4.2 肠道不同部位形态结构的显微观察 图2~图4显示了养殖60 d各组吉富罗非鱼肠道不同部位的石蜡切片结构。在显微镜下观察,各组罗非鱼肠黏膜形态结构都较为完整、层次分明,肠黏膜上皮细胞密集且排列规则,高倍镜下轮廓清晰,染色鲜明。但从发育程度上看,溶菌酶添加组鱼的肠道各段较对照组有明显优势。如图2所示,对照组的前肠绒毛相对稀疏,质地松软,且绒毛高度较短,而L54~L90组鱼的前肠绒毛明显变得紧实高壮,与表4的测量结果相吻合。如图3所示,与对照组相比,L36~L72组鱼的中肠绒毛密度、高度和宽度有所增加,且绒毛排列整齐,但高剂量添加水平下(L90)的中肠绒毛发育出现下降趋势,表现为绒毛变短、稀疏松弛,且肌层厚度变薄。如图4所示,对照组的后肠绒毛有脱落现象,但肌层厚度仍较大,L36~L72组鱼后肠绒毛密度有所增加,L54和L90组后肠绒毛高度也有增加趋势。此外,添加溶菌酶也明显提高了后肠绒毛宽度,这些均与表4的测量结果基本吻合。
2.5 肠粘膜杯状细胞的变化情况
从表5可以看出,L54和L72组鱼前肠肠黏膜上皮杯状细胞数量显著高于其他各组(<0.05);且与对照组相比,L36~L72组鱼的中肠和后肠肠黏膜上皮杯状细胞数量也有显著增加(<0.05)。
3 讨论
3.1 饲用溶菌酶对吉富罗非鱼肝肠组织结构发育的影响
早在Marshall(1998)提出的“肠-肝轴”理论中就已认为,肠道和肝脏并不是2个完全独立的器官,它们在功能上存在着广泛的联系。鱼体生理性的“肠–肝轴”中,胆汁酸的“肠-肝循环”是其重要物质基础之一,构造了二者之间天然的功能联系(Cortes, 2013)。在水生动物上常用肠道绒毛高度、绒毛密度以及杯状细胞的数量等组织形态学指标来反映鱼类肠道的发育和健康程度,并以此评估鱼类肠道的消化吸收能力(聂国兴等, 2007; Farhangi, 2001)。同时,肝脏的结构形态和健康程度对于其本身消化功能和整个“肠–肝轴”系的正常运转也起到不可忽视的作用。本研究结果显示,L36、L54和L72组鱼在摄食含有溶菌酶饲料60 d后的肠道不同部位肠绒毛密度、高度和宽度长势较对照组显著提高,说明适量溶菌酶的添加可以促进吉富罗非鱼肠道的生长发育,这可能与溶菌酶进入鱼体后发挥的调控肠道菌群结构平衡有关。对异育银鲫()的研究表明,适量添加溶菌酶能够促进有益菌的增殖,同时,对诸如葡萄球菌科等有害菌群有抑制作用,这种对微生物结构的正面调节作用能够降低肠道维持,从而促进肠绒毛发育(Chen, 2014)。然而,本研究结果发现,添加溶菌酶并没有提高吉富罗非鱼前肠、后肠的肌层厚度,甚至有下降趋势,这可能与机体在确保肠道健康的前提下,减少肠道维持需求、促进动物生长有关。此外,溶菌酶的过量添加则可能破坏肠道微生物菌落结构,使得机体肠绒毛发育减弱,此结论也在本研究有所体现。

图2 饲用溶菌酶对吉富罗非鱼前肠形态、结构的影响(×100)
A: L0组; B: L18组; C: L36组; D: L54组; E: L72组; F: L90组
HF: 绒毛高度; HW: 绒毛宽度; tML: 肌层厚度; GC: 杯状细胞
A: L0 group; B: L18 group; C: L36 group; D: L54 group; E: L72 group; F: L90 group
HF: Height of fold; HW: Width of fold; tML: Thickness of muscular layer; GC: Goblet cells
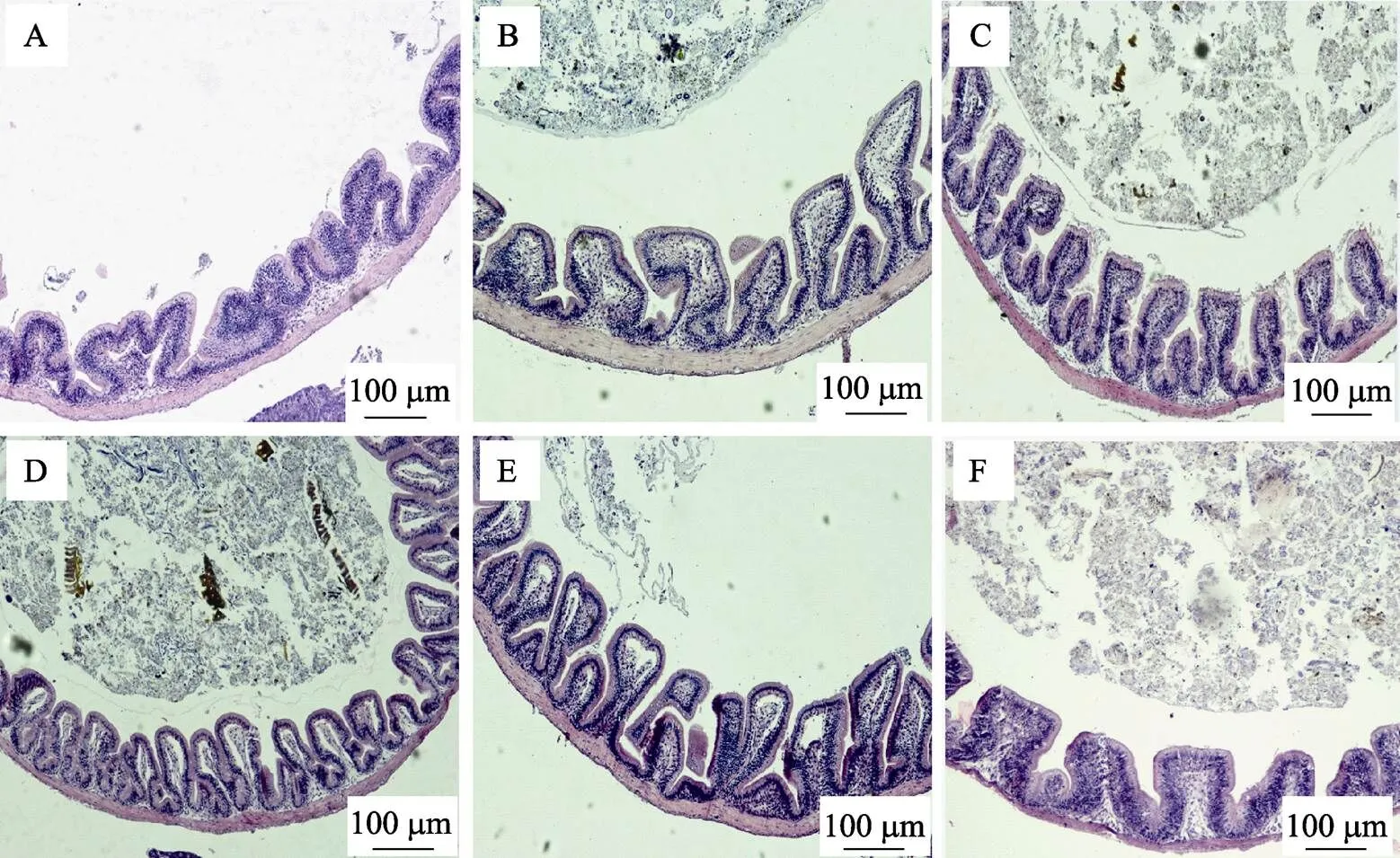
图3 饲用溶菌酶对吉富罗非鱼中肠形态、结构的影响(×100)
A: L0组; B: L18组; C: L36组; D: L54组; E: L72组; F: L90组
A: L0 group; B: L18 group; C: L36 group; D: L54 group; E: L72 group; F: L90 group

图4 饲用溶菌酶对吉富罗非鱼后肠形态、结构的影响(×100)
A: L0组; B: L18组; C: L36组; D: L54组; E: L72组; F: L90组
A: L0 group; B: L18 group; C: L36 group; D: L54 group; E: L72 group; F: L90 group
表5 各组鱼肠粘膜杯状细胞的数量变化(个)

Tab.5 Quantity changes of intestine goblet cells of GIFT tilapia in different groups (ind.)
本研究结果还显示,L36、L54和L72组鱼肠黏膜上皮层中的杯状细胞数量也有显著提高,这进一步促进了吉富罗非鱼肠道健康水平,相似结论在异育银鲫(Chen,2014)、断奶仔猪(Cooper, 2011)中已有报道,同时与溶菌酶具有类似功能的抗菌肽在无菌鸡(Wang, 2009)日粮中作用效果一致。其内在机制可能在于溶菌酶的添加有利于鱼肠上皮杯状细胞发生,从而更多产生黏蛋白,于肠上皮形成致密粘液层,更好地保护肠上皮组织抵御外来有害微生物的侵犯,降低肠道疾病发生。关于溶菌酶能够促进肠上皮细胞增殖分化和加快组织修复的功能已在小鼠(林成招等, 2005; 刘晋峰, 2007)和兔(梁彦, 2012)等畜禽动物上有过报道,而和溶菌酶具有类似功能的抗菌肽也在断奶仔猪肠道损伤修复方面起到了相似的作用(Tang, 2013)。
结合肝脏组织形态学观察,本研究发现,L36和L54组鱼的肝脏组织细胞更加饱满,较对照组和L18组,细胞核偏移和浓缩的现象减少,从而能在总体水平上提高肝脏的健康程度;然而,高剂量添加水平组并没有显示出这种优势,这种和肠道相似的变化结果很可能与“肠–肝轴”系的连带运转机制有关,关于溶菌酶在此方面的研究机制需要进一步论证。
3.2 饲用溶菌酶对吉富罗非鱼消化酶活力的影响
一般来说,进入肠道的食物会受到肠道运动带来的机械性消化作用,同时,也会接触消化酶而进行化学性消化。消化酶活性的高低是评价养殖鱼类对营养物质消化能力的重要指标(刘襄河等, 2013)。邢思华等(2013)研究表明,在一定范围内添加溶菌酶能够显著提高草鱼()肝胰脏的蛋白酶活性,但对肠道蛋白酶和淀粉酶活性没有影响。本研究发现,随饲料溶菌酶添加水平的提高,吉富罗非鱼胃、前肠和中肠蛋白酶活性呈现先升高后降低的变化趋势,在L36、L54和L72组呈现最大值,对后肠蛋白酶活性无显著影响,同时,L54和L72组的肝脏和前肠的脂肪酶活性也有显著提高,而对于淀粉酶,则在高剂量添加组(L72和L90组)表现出较高的酶活性(前肠和中肠不明显),这说明饲用溶菌酶能够在一定程度上刺激吉富罗非鱼肝脏和胃肠道消化酶的分泌,但存在添加剂量与所激发的消化酶种类不同的差异性变化。推测原因可能与溶菌酶作为蛋白酶类物质进入鱼体后的排异反应、鱼体不同部位的适应机制、消化酶自身特性等均有关系(Yokooji, 2013),其内在机制有待进一步研究。另一方面,溶菌酶对鱼体消化道微生态的积极调控,使得机体内环境处于一个最佳生理状态,更有利于消化酶活性的发挥。
涂永锋等(2004)研究表明,鱼类肠黏膜柱状上皮层中散落的杯状细胞不仅是一类黏液细胞,又是一种典型的分泌型细胞,是储存和分泌消化酶的重要场所,因而,杯状细胞数目的提高会增加鱼体消化酶的分泌量。本研究发现,L36、L54和L72组鱼肠黏膜上皮层中的杯状细胞数量明显高于其他组,这可能是这几组鱼消化酶分泌量提高的又一重要原因。
3.3 饲用溶菌酶对吉富罗非鱼营养物质消化吸收的影响
目前,关于溶菌酶对营养物质消化吸收率的研究多见于畜禽动物(张世卿等, 2008; 程时军等, 2009; 丁亦男, 2012),而在鱼类上仅见于异育银鲫(Chen, 2014)。这些研究表明,在饲粮中添加适量的溶菌酶能在一定程度上提高养殖动物对营养物质的消化吸收率,但作用不显著。本研究通过跟踪不同养殖周期内吉富罗非鱼对饲料干物质、粗蛋白和粗脂肪的表观消化率,发现在饲养Ⅰ期和Ⅱ期,L36和L54组鱼对粗蛋白的表观消化率显著高于对照组,而高剂量添加水平下会存在显著降低趋势。随着饲养时间的增长,到达饲养Ⅲ期和Ⅳ期,高剂量添加组鱼对干物质、粗蛋白和粗脂肪的表观消化率也呈现明显上升趋势,甚至在L90组出现最大值,推测原因可能在饲养前期阶段,鱼体对中剂量添加水平下的溶菌酶饲料具有更快的适应反应,高剂量水平下反而存在较大排异行为,因此,在饲养前期,这2组鱼先满足生长发育所需的蛋白质营养,而到养殖中后期,鱼体对高剂量添加水平的溶菌酶饲料逐渐适应,且随水温降低,对饲料干物质、粗蛋白和粗脂肪的表观消化率均有显著提升,这与鱼体的自我适应机制、摄食水平、生长发育和环境变化均有很大关系。
Nilsen等(1999)研究表明,溶菌酶作为一种蛋白多肽类物质,其在机体内也可以一种潜在“蛋白酶”的形式存在,从而发挥类似消化酶的作用。在养殖Ⅰ期和Ⅱ期,L36和L54组鱼的生理机能最优,一方面通过刺激机体内源性蛋白酶的分泌,另一方面在保证健康前提下,促使溶菌酶发挥抗菌、消化的双重功能,使鱼体消化机能进一步提升(张娟娟等,2012)。关于消化酶活力的增强和分泌量的增加对鱼类消化吸收过程的促进作用已有大量报道(Das, 2014; Ray, 2012),并在尼罗罗非鱼() (Lara-Flores, 2003)、金头鲷() (Suzer, 2008)、大西洋鲑()(Sørensen, 2011)等鱼类上得到证实。另一方面,在该溶菌酶添加水平下,吉富罗非鱼肝肠结构的健康发育也促进了鱼体对营养物质的消化吸收率,相似结论已在肉鸡、仔鸡、断奶仔猪等畜禽动物有过报道(程时军等, 2009; Humphrey, 2002; Nyachoti, 2012)。
4 小结
本实验条件下,添加36、54 mg/kg的饲用溶菌酶可以促进吉富罗非鱼肝脏和肠道健康发育;添加水平在36~72 mg/kg范围能够激发吉富罗非鱼胃、前肠、中肠蛋白酶及肝脏、前肠脂肪酶的分泌和活性提高;对于营养物质消化吸收方面,在饲养前期(Ⅰ期和Ⅱ期),36、54 mg/kg添加水平主要促进了鱼体对粗蛋白的消化吸收率;中后期(Ⅲ期和Ⅳ期),36~90 mg/kg添加水平下,干物质、粗蛋白和粗脂肪的消化吸收率均有显著提高。总体而言,36、54 mg/kg添加水平具有最稳定的作用效果,其内在机制与调节内环境微生态平衡、促进鱼体肝肠结构发育和消化酶的分泌以及内、外源性酶之间的互作机制均有关系。
Cataldi E, Cataudella S, Monaco G,. A study of the histology and morphology of the digestive tract of the sea-bream,. Fish Biology, 1987, 30: 135–145
Chen Y, Zhu X, Yang Y,. Effect of dietary lysozyme on growth, immune response, intestine microbiota, intestine morphology and resistance toin gibel carp (). Aquaculture Nutrition, 2014, 20(3): 229–241
Cheng SJ, Ma LB, Zhang W. Effect of dietary lysozyme on growth performance, nutrient apparent digestibility in broilers. Feed China, 2009(19): 32–34 [程时军, 马立保, 张伟. 溶菌酶对肉鸡生长性能与营养物质表观消化率的影响. 饲料广角, 2009(19): 32–34]
Cooper CA, Brundige DR, Reh WA,. Lysozyme transgenic goats’ milk positively impacts intestinal cytokine expression and morphology. Transgenic Research, 2011, 20: 1235–1243
Cortes VA, Busso D, Mardones P,. Advances in the physiological and pathological implications of cholesterol. Biological Reviews, 2013, 88(4): 825–843
Das P, Mandal S, Khan A,. Distribution of extracellular enzyme-producing bacteria in the digestive tracts of 4 brackish water fish species. Turkish Journal of Zoology, 2014, 38: 79–88
Ding YN. Effects of recombinant lysozyme on growth performance and carcass traits in broilers. Journal of Anhui Agricultural Sciences, 2012, 40(34): 16623–16626 [丁亦男. 人重组溶菌酶对肉鸡营养消化及肠道组织结构的影响. 安徽农业科学, 2012, 40(34): 16623–16626]
Farhangi M, Carter CG, Hardy RW,. Growth, physiological and immunological responses of rainbow trout () to different dietary inclusion levels of dehulled lupin (). Aquaculture Research, 2001, 32(1): 329–340
Garcia HMP, Lozano MT, Elbano MT,. Development of the digestive tract of sea bass. Light and electron microscopic studies. Anatomy and Embryology, 2001, 204(1): 39–57
Gu WZ, Zhang GJ. Effects of lysozyme on growth performance and immune organ index of meat duck. Feed Industry Magazine, 2008, 29(24): 46–48 [顾维智, 张国基. 溶菌酶对肉鸭生长性能和免疫器官指数的影响. 饲料工业, 2008, 29(24): 46–48]
Huang YZ, Lin X, Wang QX,. Effects of astragalus polysaccharide on structure of intestinal villus and intestinal immunocyte of tilapia. Chinese Journal of Animal Nutrition, 2010, 22(1): 108–116 [黄玉章, 林旋, 王全溪, 等. 黄芪多糖对罗非鱼肠绒毛形态结构及肠道免疫细胞的影响. 动物营养学报, 2010, 22(1): 108–116]
Humphrey BD, Huang N, Klasing KC. Rice expressing lactoferrin and lysozyme has antibiotic-like properties when fed to chicks. Nutrition, 2002, 132: 1214–1218
Lara-Flores M, Olvera-Novoa MA, Guzman-Mendez BE,. Use of the bacteria,and, and the yeast,as growth promoters in Nile tilapia (). Aquaculture, 2003, 216: 193–201
Li JS, Li JL, Wu TT. Effect of exogenous enzyme and citric acid on activities of endogenous digestive enzyme of tilapia (). Journal of Nanjing Agricultural University, 2006, 28(3): 97–101 [黎军胜, 李建林, 吴婷婷. 外源酶和柠檬酸对奥尼罗非鱼内源消化酶活性的影响. 南京农业大学学报, 2006, 28(3): 97–101]
Li ZG, Qi BM, Wang QX,. Effect of cysteamine hydrochloride on intestinal histological structure of tilapia. Feed Research, 2007(9): 25–28 [李志刚, 祁保民, 王全溪, 等. 半胱胺对尼罗罗非鱼肠道黏膜结构的影响. 饲料研究, 2007(9): 25–28]
Liang Y. The experimental study of repairing rabbit radial bone defects with hydroxypatite/chitosan-lysostaphin biological materials. Master´s Thesis of Tianjin Medical University, 2012 [梁彦. 羟基磷灰石壳聚糖载溶菌酶生物材料修复兔桡骨缺损的实验研究. 天津医科大学硕士研究生学位论文, 2012]
Lin CZ, Ma HT, Zou SX,. Effects of soybean isoflavone on the growth of the ratepithelial cell and absorption of glucose and amino acids of small intestine. Journal of Nanjing Agricultural University, 2005, 28(1): 71–75 [林成招, 马海田, 邹思湘, 等. 大豆异黄酮对大鼠小肠上皮细胞生长及葡萄糖和氨基酸吸收的影响. 南京农业大学学报, 2005, 28(1): 71–75]
Liu AJ, Leng XJ, Li XQ,.Effects of azomite on growth,intestinal structure and non-specific immunity of tilapia (). Chinese Journal of AnimalNutrition, 2009, 21(6): 1006–1011 [刘爱君, 冷向军, 李小勤, 等. 艾佐迈对奥尼罗非鱼生长、肠道结构和非特异性免疫的影响. 动物营养学报, 2009, 21(6): 1006–1011]
Liu JF. Experimental research on between the expression of β-catenin, Tcf-4, LZM and proliferation and differentiation of intestinal stem cell in intestinal mucosa during severe abdominal infection. Master´s Thesis of First Military Medical University, 2007 [刘晋峰. 严重腹腔感染时肠黏膜β连环蛋白、T细胞因子4、溶菌酶与肠上皮干细胞增殖分化机制关系的实验研究. 第一军医大学硕士研究生学位论文, 2007]
Liu XH, Ye CX, Zheng LM,. Effect of dietary dextrin levels on growth, activities of digestive enzyme and blood biochemical indices of juvenile obscure puffer. Journal of Fisheries of China, 2013, 37(9): 1359– 1368 [刘襄河, 叶超霞, 郑丽勉, 等. 饲料糊精水平对暗纹东方鲀幼鱼生长、消化酶活性和血液生化指标的影响. 水产学报, 2013, 37(9): 1359–1368]
Marshall JC. The gut as a potential trigger of exercise-induced inflammatory responses. Canadian Journal of Physiology and Pharmacology, 1998, 76(5): 479–484
Nie GX, Wang JL, Zhu MW,. The influences of xylanase added in wheat basal diet on intestine chyme viscosity and the development of villi and microvilli of. Journal of Fisheries of China, 2007, 31(1): 54–61 [聂国兴, 王俊丽, 朱命炜, 等. 小麦基础饲料添加木聚糖酶对尼罗罗非鱼肠道食糜粘度和绒毛、微绒毛发育的影响. 水产学报, 2007, 31(1): 54–61]
Nilsen IW, Overbo K, Sandsdalen E,. Protein purification and gene isolation of chlamysin, a cold-active lysozyme-like enzyme with antibacterial activity. FEBS Letters, 1999, 464(3): 153–158
Nyachoti C, Kiarie E, Bhandari S,. Weaned pig responses toK88 oral challenge when receiving a lysozyme supplement. Animal Science, 2012, 90: 252–260
Ray AK, Ghosh K, Ringø E. Enzyme-producing bacteria isolated from fish gut: A review. Aquaculture Nutrition, 2012, 18: 465–492
Shi ZH, Xie MM, Peng SM,. Effects of temperature stress on activities of digestive enzymes and serum biochemical indices ofjuveniles. Progress in Fishery Sciences, 2016, 37(5): 30–37 [施兆鸿, 谢明媚, 彭士明, 等. 温度胁迫对银鲳()幼鱼消化酶活性及血清生化指标的影响. 渔业科学进展, 2016, 37(5): 30–37]
Sørensen M, Penn M, El-Mowafi A,. Effect of stachyose, raffinose and soya-saponins supplementation on nutrient digestibility, digestive enzymes, gut morphology and growth performance in Atlantic salmon (L.). Aquaculture, 2011, 314(1–4): 145–152
Suzer C, Coban D, Kamaci HO,.spp. bacteria as probiotics in gilthead sea bream (L.) larvae: Effects on growth performance and digestive enzyme activities. Aquaculture, 2008, 280(1–4): 140–145
Tang ZR, Deng H, Zhang XL,.Effects of orally administering the antimicrobial peptide buforin Ⅱon small intestinal mucosal membrane integrity, the expression of tight junction proteins and protective factors in weaned piglets challenged by enterotoxigenic. Animal Feed Science and Technology, 2013, 186(3–4): 177–185
Tu YF, Song DJ. Fish gut tissue structure and its functional adaptability. Jiangxi Feed, 2004(4): 16–19 [涂永锋, 宋代军. 鱼类肠道组织结构及其功能适应性. 江西饲料, 2004, (4): 16–19]
Wang D, Ma W, She R,. Effects of swine gut antimicrobial peptides on the intestinal mucosal immunity in specific- pathogen-free chickens. Poultry Science, 2009, 88: 967–974
Wang J, Bi X, Tian YM. Effects of special lysozyme on growth performance and development of immune organs of broilers.Cereal and Feed Industry, 2013(11): 51–54 [王军, 毕雪, 田玉民. 一种专用溶菌酶对肉仔鸡生长性能和免疫器官发育的影响. 粮食与饲料工业, 2013(11): 51–54]
Wang XK, Wang XS, Wang GY,. Effect of lysozyme on growth performance of weaned piglets. Feed Industry Magazine, 2008, 29(22): 31–33 [王晓可, 王晓硕, 王根彦, 等. 溶菌酶对断奶仔猪生长性能的影响. 饲料工业, 2008, 29(22): 31–33]
Xing SH, Hua XM, Zhu ZY,. Effect of dietary lysozyme levels on growth and anti-infection ability of. Journal of Huazhong Agricultural University, 2013, 31(6): 731–736 [邢思华, 华雪铭, 朱站英, 等. 饲料中添加溶菌酶对草鱼生长性能和抗感染能力的影响. 华中农业大学学报, 2013, 31(6): 731–736]
Ye YT, Zhang Y, Zhang Y,. The effect of multi-enzyme premixes EA-Ⅱ and aspergillus BA-Ⅰ on activities of protease and diastase in intestine and hepatopancreas of carp. Journal of Dalian Fisheries University, 1993, 8(1): 79–82 [叶元土, 张勇, 张宇, 等. 酶制剂EA–Ⅱ和生物制剂BA–Ⅰ对鲤肠道、肝胰脏的蛋白酶和淀粉酶活力的影响. 大连海洋大学学报, 1993, 8(1): 79–82]
Yokooji T, Hamura K, Matsuo H. Intestinal absorption of lysozyme, an egg-white allergen, in rats: Kinetics and effect of NSAIDs. Biochemical and Biophysical Research Communications, 2013, 438(1): 61–65
Yu CL, Chang Q, Lü YY. Effects of mannan oligosaccharide on the growth, intestinal development and non-specific immunity of tongue sole (Günther) postlarvae. Progress in Fishery Sciences, 2014, 35(6): 53–59 [于朝磊, 常青, 吕云云. 甘露寡糖对半滑舌鳎(Günther)稚鱼生长、肠道发育和非特异性免疫水平的影响. 渔业科学进展, 2014, 35(6): 53–59]
Zhang JJ, Li XQ, Leng XJ,. Effects of supplemental protease on growth and intestinal tissue structure in rainbow trout. Journal of Dalian Ocean University, 2012, 27(6): 534–538 [张娟娟, 李小勤, 冷向军, 等. 外源蛋白酶对虹鳟生长和肠道组织结构的影响. 大连海洋大学学报, 2012, 27(6): 534–538]
Zhang L, Mai KS, Ai QH,. Effects of phytase and non- starch polysaccharide enzyme supplementation in diets on growth and digestive enzyme activity in large yellow croaker,R. Periodical of Ocean University of China (Natural Science), 2007, 36(6): 923–928 [张璐, 麦康森, 艾庆辉, 等. 饲料中添加植酸酶和非淀粉多糖酶对大黄鱼生长和消化酶活性的影响. 中国海洋大学学报(自然科学版), 2007, 36(6): 923–928]
Zhang SQ, Zhu ZK, Wang MC,. Effects of lysozyme on growth performance, metabolism and immune indices of broilers fed with corn-soybean basal diets. Chinese Journal of Animal Nutrition, 2008, 20(4): 463–468 [张世卿, 朱忠珂, 王明成, 等. 玉米–豆粕日粮添加溶菌酶对肉仔鸡生长性能、代谢及免疫指标的影响. 动物营养学报, 2008, 20(4): 463–468]
Effects of Dietary Lysozyme on the Digestive Tract Structure and Nutrient Digestibility of GIFT Tilapia ()
WANG Tan1,4, ZHAO Jinxin4, LIU Donglai5, KONG Chun1, HUA Xueming1,2,3①, WU Zhao1, WANG Gang1, FENG Yue1,2,3, YANG Jingfeng1,2,3, LIU Tao1,2,3
(1. Centre for Research on Environmental Ecology and Fish Nutrition (CREEFN) of the Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306; 2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306; 3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306; 4.Guangdong Haid Group Co., Ltd, Guangzhou 511400; 5. Zhonghan Town Fishery Station of Agricultural Comprehensive Service Center of Chaohu Anhui Province, Chaohu 238054)
To investigate the effects of lysozyme as a green feed additive on the development of the digestive tract and digestive utilization of nutrients in GIFT tilapia, a 60-day feeding trial was conducted with graded levels of dietary lysozyme (0, 18, 36, 54, 72, and 90 mg/kg, marked as L0, L18, L36, L54, L72, and L90 respectively). The results were as follows: The fish had a different feedback response on the digestive enzyme activity in the liver and the gastrointestinal tract among groups; the protease activity in the stomach, and the anterior and middle intestine of L36~L72 groups was significantly higher than that of the control group (<0.05); the lipase activity in the liver and the anterior intestine of the L54 and L72 groups was significantly higher than that of the control group (<0.05); and the amylase activity in the digestive tracts (anterior and middle intestine excluded) of the L72 and L90 groups was significantly higher than that of the control group (<0.05). The intestinal morphology showed that the values of villus density, villus height, and villus width of different intestinal parts in L36~L72 groups were higher than those of the control group, while the muscular thickness of the anterior and distal intestine was reduced in dietary lysozyme groups. The thickness of the middle intestines of the L18, L36, and L90 groups was significantly lower than that of the control group (<0.05), and there was a firstly increased and then decrease tendency. The thickness of the middle intestines of L36~L72 groups were all higher than the control group with no significant difference (>0.05). The goblet cell numbers were more in the L54 and L72 groups than in the control group (<0.05). The liver morphology showed that the liver cells were more voluptuous and denser in the L36 and L54 groups than in the control group, while worse health condition was found in the L90 group. With regards to apparent nutrient digestibility, the crude protein digestibility was significantly higher in the L36 and L540 groups than in the control group in periods I and Ⅱ (<0.05), and in periods Ⅲ and Ⅳ. The digestibility of dry matter, crude protein, and crude lipid were significantly higher in L36~L90 groups than in the control group (<0.05). The results above indicated that 36 and 54 mg/kg dietary lysozyme had the most stable efficacy, which could improve GIFT tilapia dry matter, crude protein, and crude lipid digestibility by promoting liver and intestine development and digestive enzyme activity.
GIFT tilapia; Lysozyme; Nutrient digestibility; Digestive enzyme; Digestive tract morphology
S963
A
2095-9869(2019)06-0076-12
10.19663/j.issn2095-9869.20180918001
http://www.yykxjz.cn/
王坛, 赵金鑫, 刘东来, 孔纯, 华雪铭, 吴钊, 王刚, 冯悦, 杨景丰, 刘韬. 饲用溶菌酶对吉富罗非鱼消化道组织结构和营养物质消化吸收的影响. 渔业科学进展, 2019, 40(6): 76–87
Wang T, Zhao JX, Liu DL, Kong C, Hua XM, Wu Z, Wang G, Feng Y, Yang JF, Liu T. Effects of dietary lysozyme on the digestive tract structure and nutrient digestibility of GIFT tilapia (). Progress in Fishery Sciences, 2019, 40(6): 76–87
* 广东省教育厅产学研结合项目(2012B091100372)资助[This work was supported by the Department of Education of Guangdong Province University-Industry Cooperation Project (2012B091100372)]. 王 坛,E-mail: wangtan0818@163.com
华雪铭,教授,E-mail: xmhua@shou.edu.cn
2018-09-18,
2018-10-21
HUA Xueming, E-mail: xmhua@shou.edu.cn
(编辑 冯小花)
