低温冷藏对带鱼肌肉蛋白的影响*
2019-12-06吴甜甜江杨阳陈士国胡亚芹
沈 妮 吴甜甜 李 苑 江杨阳 陈士国 胡亚芹
低温冷藏对带鱼肌肉蛋白的影响*
沈 妮 吴甜甜 李 苑 江杨阳 陈士国 胡亚芹①
(浙江大学生物系统工程与食品科学学院 馥莉食品研究院 智能食品加工技术与装备国家(地方)联合实验室 农业农村部农产品产后处理重点实验室 农业农村部农产品营养功能评价实验室 浙江省农产品加工技术研究重点实验室 浙江大学宁波研究院 杭州 310058)
选取蛋白丰富、营养价值高的舟山大眼带鱼(),分别置于0℃和4℃冷藏条件下贮藏15 d,通过测定肌原纤维蛋白TCA可溶性肽含量、巯基含量、表面疏水性、Ca2+-ATPase和Mg2+-ATPase活性等一系列可表征带鱼品质变化的理化指标,同时结合全溶性蛋白、水溶性蛋白和高盐溶性蛋白的电泳图,观察低温冷藏对带鱼肌肉蛋白的影响,比较2种贮藏温度下鱼肉蛋白的氧化变性以及降解情况。实验结果显示,在0℃和4℃条件下,随着贮藏时间的延长,TCA可溶性肽含量从1.446 μmol/g分别升至6.717和7.595 μmol/g,巯基含量从38.15 μmol/g MP降至35.82和30.36 μmol/g MP,Ca2+-ATPase活性从0.99 U/mg prot下降至0.092和0.134 U/mg prot,Mg2+-ATPase活性从0.76 U/mg prot下降至0.199和0.125 U/mg prot,表面疏水性先上升后下降,但数值都高于新鲜样。这一系列理化指标数值的改变,反映了0℃和4℃这2种冷藏条件不利于带鱼长期的贮藏,随着贮藏时间的延长,带鱼的蛋白氧化致使其新鲜度和品质都遭到破坏,散发出异味,以至于无法食用。从微观结构来看,带鱼肌肉的全溶性蛋白和水溶性蛋白基本没有变化,但肌原纤维蛋白逐渐降解,也是导致鱼肉品质下降的原因之一。相对于4℃冷藏条件,相同的贮藏天数,0℃冷藏条件下带鱼蛋白降解速率较慢,鱼肉腐败程度较低。
带鱼;冷藏;肌原纤维蛋白;理化指标;降解
舟山带鱼()是舟山渔场四大经济鱼类之一,分布较广,以东海产量最高(陈云龙等,2013)。带鱼属于洄游性鱼类,含有丰富的氨基酸、微量元素和DHA等,营养价值高,在市场上备受欢迎。带鱼对水压等生存条件比较敏感,所以捕获后很快就会死亡。由于微生物以及内源性蛋白酶等共同作用,新鲜的鱼非常容易腐败,所以运输贮藏过程中的保鲜方法对鱼肉品质影响较大。目前已有的保鲜方法为高压技术(Kouassi, 2007)、冷藏(Dileep, 2005)、冰库冻藏(Gallart-jornet, 2007)、生物保鲜剂(Prodpran, 2012)、电离辐射(Shi, 2015)和气调贮藏(Lund, 2007)等。其中,低温贮藏是维持鱼类新鲜度的主要方法之一。低温可以减少细菌和酶的作用,更好地保留带鱼肌肉蛋白的完整性和功能特性(Wang, 2003)。
肌肉氧化(Decker, 1993)一般包含脂肪氧化和蛋白氧化,通过改变风味、颜色、营养组成和质地等使食品品质下降。虽然脂肪氧化对蛋白氧化有一定的影响,但是无论脂质氧化是否发生,蛋白质氧化都会不可避免的发生。在特定的铁结合位点上过氧化氢产生了羟基自由基,并且导致酶活性和溶解度的下降,羰基、疏水性荧光度和蛋白水解度的增加以及氨基酸组成的变化(Meucci, 1991; Rivett, 1990),这被Stadtman等(1991)称之为由特异性金属催化引起的蛋白质氧化。众所周知,蛋白质的水解、变性或降解是鱼肉腐败变质的一个主要原因,其完整性与带鱼肌肉组织的功能特性密切相关。其中,最主要的是鱼肉肌原纤维蛋白。肌原纤维蛋白的凝胶特性是被广泛关注的重要的蛋白功能特性,与羰基含量、巯基含量、持水力、表面疏水性和ATPase酶活等理化指标有关,对鱼肉质地有很大的影响(Haard, 1994)。肌球蛋白和肌动蛋白是组成肌原纤维蛋白的两大主要蛋白,也是主要的研究对象。影响鱼肉蛋白性质的因素有很多(Park, 2006),例如鱼的品种、捕获季节、新鲜程度、运输和贮藏方式等。在带鱼储藏期间,由于鱼肉肌原纤维蛋白的变性、聚集、自溶和降解等,鱼肉蛋白会发生一系列的物理和化学变化(Lefevre, 2007)。鱼类肌肉的感官特征、营养品质和质构特性等影响着鱼类被消费者接受的程度。鱼类鲜度与品质保持技术方面的研究具有重要意义。
本研究以新鲜舟山大眼带鱼为原料,在0℃和4℃条件下贮藏15 d,测定了一系列理化指标,并结合蛋白电泳,比较了2种温度条件下带鱼肌原纤维蛋白的降解情况,探究低温冷藏对带鱼新鲜度及品质的影响。
1 材料与方法
1.1 材料与试剂
新鲜舟山大眼带鱼,购于浙江省舟山市沈家门水产码头。选取长度约70 cm,厚度约1.5 cm,腹部饱满,鳃色鲜红、眼球饱满、鳞片完整、体表光滑无黏液的新鲜带鱼,放入装有碎冰的泡沫盒中运回实验室。
Na2HPO4、NaH2PO4、乙二胺四乙酸(EDTA)、NaCl、三氯乙酸(TCA)、1-苯奈氨-8-磺酸(ANS)、C12H25SO4Na (SDS),均为分析纯;SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒、10X Tris-甘氨酸(C2H5NO2)电泳缓冲液(pH 8.3)、5X蛋白质加样缓冲液、RealBand蛋白预染Marker (宽范围、三色)、高灵敏快速考马斯亮蓝染色试剂盒,购自生工生物工程(上海)有限公司;总巯基测试盒(微板法)、ATP酶试剂盒,购自南京建成生物工程研究所。
1.2 仪器与设备
UV-2550紫外分光光度计,日本岛津制作公司;电子天平BS223 S,北京赛多利斯仪器系统有限公司;FSH-2A可调高速均质机;六孔六温磁力搅拌水浴锅,金坛市良友仪器有限公司;制冰机,斯科茨曼制冰系统(上海)有限公司;L500台式低速离心机,湖南湘仪实验室仪器开发有限公司;TGL-18MS高速冷冻离心机,上海卢湘仪离心机仪器有限公司;漩涡混合器G2-38B,海门市其林贝尔仪器制造有限公司;B-S/ FACT系列天平,梅特勒托利多(上海)仪器有限公司;全波长酶标仪,赛默飞世尔科技公司;海尔冰箱BCD- 186KB,青岛海尔股份有限公司;荧光分光光度计(型号Cary Eclipse),赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 鱼肉处理 将新鲜带鱼拭干表面多余水分,以自封袋分装置于0℃和4℃条件下低温贮藏。
1.3.2 肌原纤维蛋白的提取 肌原纤维蛋白提取参考Lefevre等(2007)的方法,并进行适当修改。称取3 g块状鱼肉,与30 ml缓冲液A (20 mmol/L磷酸盐缓冲液,含有100 mmol/L NaCl,1 mmol/L EDTA,pH 7.0)混合均匀,13000 r/min匀浆60 s,然后4℃、8000 r/min条件下离心10 min,弃上清液,将沉淀与15 ml缓冲液A混合均匀,重复洗涤2次,弃上清,最后沉淀中加入15 ml缓冲液B (25 mmol/L磷酸盐缓冲液,含有 0.6 mol/L NaCl,pH 7.0),混合均匀,13000 r/min匀浆60 s充分溶解后置于冰上2 h,然后用双层纱布过滤,除去不溶性物质,滤液即为肌原纤维蛋白溶液。
1.3.3 指标测定 TCA-可溶性肽的测定参考Benjakul等(2003)的方法,并进行适当修改。称取2 g块状鱼肉,加入18 ml质量分数5%的三氯乙酸(TCA),13000 r/min匀浆60 s。均质后置于冰上1 h,然后在4℃、8000 r/min条件下离心10 min。取上清液并稀释,Lowry法测定吸光度,以μmol酪氨酸/g表示。
巯基含量的测定使用总巯基测试盒(微板法)测定,购于南京建成生物工程研究所。
表面疏水性的测定参照Kobayashi等(2017)的方法,略有改动。以1-苯奈氨-8-磺酸(ANS)作为荧光探针,用10 mmol/L磷酸盐缓冲液(含有0.6 mol/L NaCl,pH 6.0)稀释肌原纤维蛋白溶液,使其浓度在0.05~ 0.50 mg/ml。取4 ml稀释后的肌原纤维蛋白溶液,加入20 μl 8 mmol/L ANS溶液(pH 7.0),使用荧光分光光度计测定,激发波长374 nm,发射波长485 nm。以荧光强度与蛋白浓度作图,用曲线斜率表示肌原纤维蛋白表面疏水性o。
Ca2+-ATPase、Mg2+-ATPase活性的测定使用ATP酶试剂盒测定,购于南京建成生物工程研究所。
带鱼肌肉蛋白的提取和SDS-PAGE分析(Li, 2014; 李艳青, 2013)。全蛋白的提取:称取3 g块状鱼肉,加入27 ml 50 g/L SDS (85℃),均质5 min,85℃恒温1 h,然后4000 r/min离心20 min,去除不溶物,取上清液。
水溶性蛋白提取:称取3 g块状鱼肉,加入15 ml双蒸水,均质5 min,然后在4℃、8000 r/min条件下离心15 min,取上清液,即为水溶性蛋白提取物。
低盐溶性蛋白提取:向水提后的沉淀中加入15 ml低盐溶液(20 mmol/LNaCl,1 mmol/L EGTA, 15 mmol/LMgCl2,200 μmol/L PMSF,5 mmol/L DTT,3.4 mmol/L NaH2PO4,1.6 mmol/L Na2HPO4,pH 6.5),均质5 min,然后在4℃、8000 r/min条件下离心15 min,取上清液,即为低盐溶性蛋白提取物。
高盐溶性蛋白提取:向提取低盐溶性蛋白后剩余的沉淀中加入15 ml高盐溶液(5 mmol/L EGTA, 15 mmol/L MgCl2, 200 μmol/L PMSF, 5 mmol/L DTT, 100 mmol/L Na4P2O7, pH 8.5),均质5 min,然后在4℃、8000 r/min条件下离心15 min,取上清液,即为高盐溶性蛋白提取物。
采用SDS-聚丙烯酰胺凝胶电泳分析肌肉蛋白的变化。将4 μl样品(浓度为3 mg/ml)加到由5%浓缩凝胶和12%分离凝胶制成的聚丙烯酰胺凝胶上,电泳结束后,用考马斯亮蓝染色,然后凝胶用10%(/)乙酸和40%(/)乙醇混合液脱色,观察蛋白条带。
2 结果与分析
2.1 冷藏过程中TCA可溶性肽含量变化
如图1所示,带鱼在0℃、4℃冷藏条件下贮藏 15 d,带鱼中TCA可溶性肽含量呈上升趋势,表明在贮藏过程中,鱼肉蛋白降解,肽键水解,从而生成小分子肽。从图1中可以看出,0~9 d TCA可溶性肽含量增长速率较快,12~15 d趋于平缓,可能是由于与蛋白降解相关的内源性蛋白酶含量逐渐稳定(Benjakul, 2003)。除第9天外,4℃贮藏的样品其TCA可溶性肽含量均高于0℃贮藏的样品,表明0℃冷藏条件下带鱼蛋白降解速度相对缓慢。新鲜带鱼和贮藏15 d后带鱼的TCA可溶性肽的含量有显著差异(0.05),而且4℃冷藏条件下的带鱼TCA可溶性肽的含量和贮藏时间有良好的线性关系,相关系数2达到0.93。因此,TCA可溶性肽的含量变化可以作为评价冷藏过程中带鱼的品质变化的指标之一,这与李婷婷(2013)的研究结论基本一致。
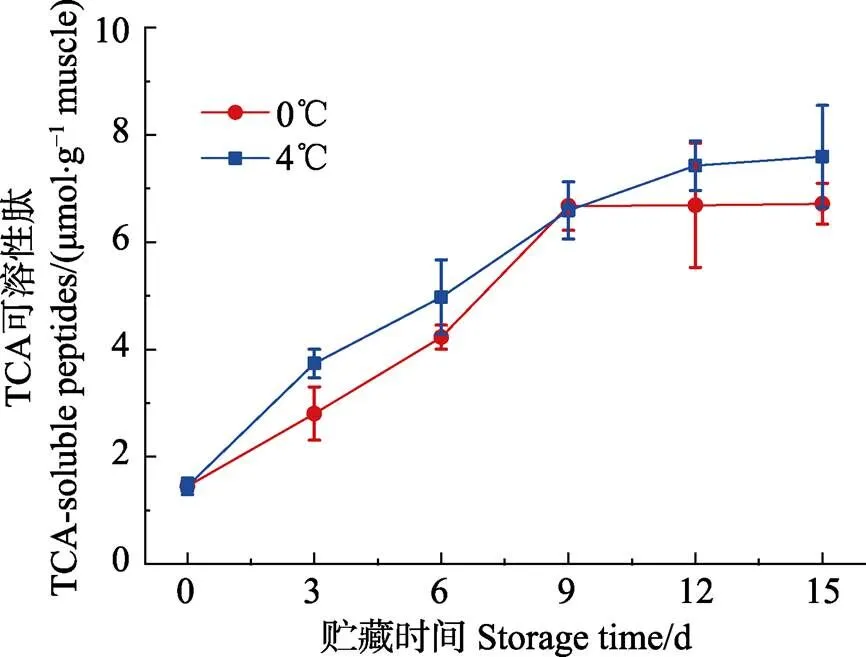
图1 带鱼在冷藏过程中TCA-可溶性肽含量的变化
2.2 冷藏过程中鱼肉蛋白巯基含量变化
半胱氨酸残基中的巯基是所有蛋白质氨基酸残基中最活泼的基团,在体内参加抗氧化、亚硝基化和巯基–二硫键交换等多种重要生理反应(田悦等,2007)。如图2所示,随着贮藏时间的延长,0℃和4℃冷藏条件下带鱼肌原纤维蛋白的巯基含量呈现下降趋势。0~ 6 d和9~15 d,4℃条件下巯基含量急剧下降,可能是贮藏过程中肌球蛋白和肌动蛋白转换被阻断,从而蛋白氧化速率加快(Wang, 2003)。第9天,巯基含量突然增加,可能是由于内源性酶自溶作用或微生物作用使蛋白变性或分解而释放出的(Noguchi, 1955; Wang, 2003),有报道(Benjakul, 1997)显示,太平洋白鱼在冷藏条件下,第2天肌原纤维蛋白的巯基含量也有所上升,本研究的实验现象与其相似。通过比较发现4℃条件下的样品巯基含量都低于0℃条件,这说明4℃条件下肌原纤维蛋白更易被氧化而变性,从而更多巯基的抗氧化作用削弱而被氧化,含量减少。
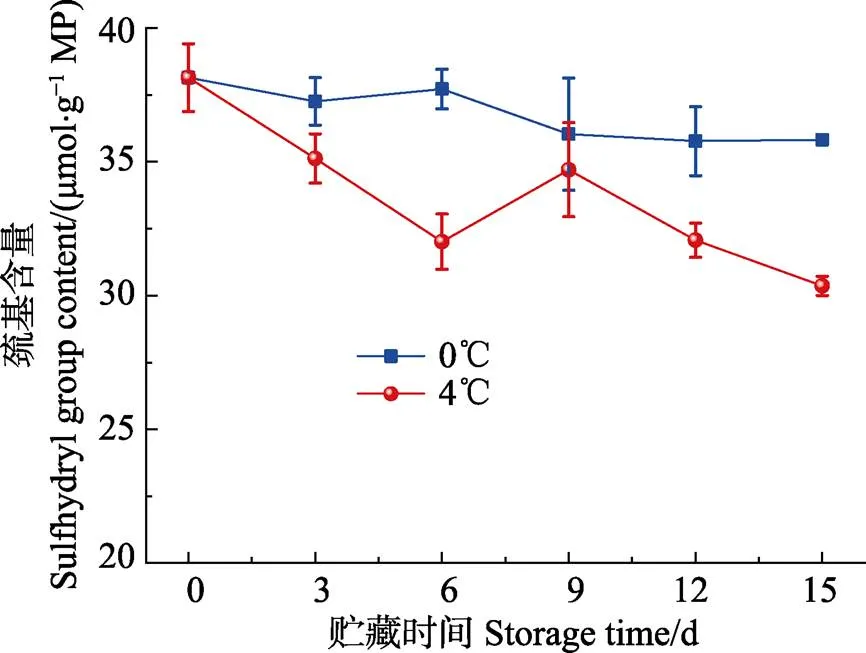
图2 带鱼在冷藏过程中巯基含量的变化
2.3 冷藏过程中鱼肉表面疏水性变化
蛋白质的表面疏水性可表征蛋白质的构象,衡量蛋白质的变性程度。通常认为蛋白质变性可提高蛋白质表面的疏水性,主要是因为埋藏在蛋白质空间构象内部的疏水性氨基酸残基的暴露引起的空间结构发生了改变(李艳青, 2013)。如图3所示,0℃和4℃冷藏条件下带鱼肌原纤维蛋白的表面疏水性随着时间的延长而呈先上升后下降趋势,0~6 d显著升高(0.05),于第6天上升至最高值,而后第9天蛋白质表面疏水性急剧下降,9~15 d其数值在482.05~568.05间波动,但都高于新鲜带鱼的表面疏水性。有报道表明(Leelapongwattana, 2005),蛋白质表面疏水性的降低可能是由于疏水作用使蛋白质表面的疏水基团相互作用,游离疏水基团减少,从而引起蛋白质的聚集。Leelapongwattana等(2005)在蛇鲻鱼的冻藏过程中发现了类似的现象。在相同的贮藏条件下,4℃贮藏条件下带鱼肌原纤维蛋白的表面疏水性高于0℃条件,表明相较于4℃,0℃贮藏条件减缓了鱼肉蛋白质氧化变性的速率,更能保持蛋白质的完整性。
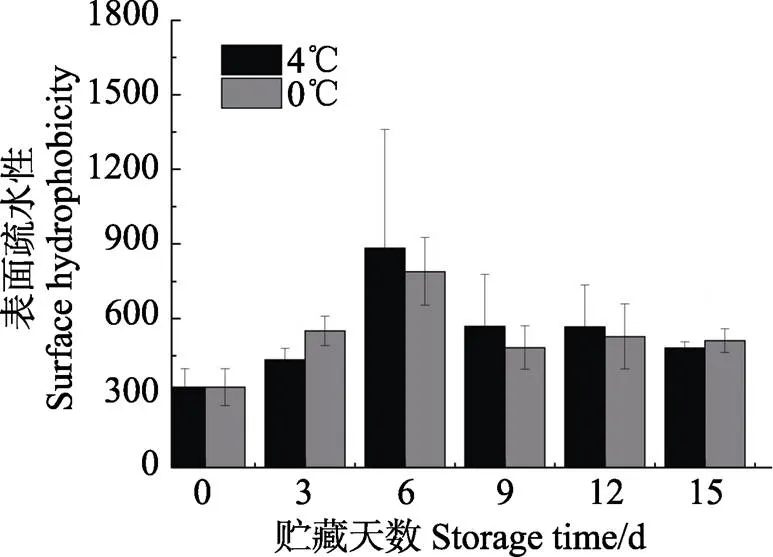
图3 带鱼在冷藏过程中表面疏水性的变化
2.4 冷藏过程中鱼肉蛋白Ca2+-ATPase、Mg2+-ATPase活性变化
肌原纤维蛋白容易被溶酶体酶和钙激活的中性蛋白酶降解,从而影响ATP酶活性,因此,肌原纤维蛋白的降解可以通过ATP酶活性的变化间接测量。同时,ATP酶活性已被广泛用作肌原纤维蛋白完整性的量度,其中Ca2+-ATPase、Mg2+-ATPase活性分别表征肌球蛋白、肌动球蛋白的完整性(Benjakul, 1997)。有报道(Ouali, 1981)表明,Ca2+-ATPase活性下降可能与肌球蛋白水解有关。如图4、图5所示,在0℃和4℃条件下贮藏15 d,Ca2+-ATPase和Mg2+-ATPase活性逐渐下降,这与蛋白水解引起的肌原纤维蛋白降解有关(Kobayashi, 2017)。0℃条件下样品的Ca2+-ATPase和Mg2+-ATPase活性高于4℃条件下的样品,表明贮藏温度越低,肌原纤维蛋白ATP酶活性下降越缓慢。贮藏到15 d时,0℃和4℃冷藏条件下,Ca2+-ATPase和Mg2+-ATPase活性分别下降至0.092、0.134、0.199和0.125 U/mg prot,与新鲜样的ATPase酶活性相比较,显著下降(0.05)。Benjakul等(1997)认为冻藏期间,太平洋白鱼肌原纤维蛋白的Ca2+-ATPase活性降低和蛋白酶活性有关,尤其是组织蛋白酶。另外,也有报道(Benjakul, 2003)指出冷藏条件下,蛇鲻鱼Ca2+-ATPase活性的降低,可能是由于肌钙蛋白的变性或降解,尤其是肌钙蛋白C,因为Ca2+-ATPase通过调节Ca2+含量来影响肌原纤维蛋白的完整性。
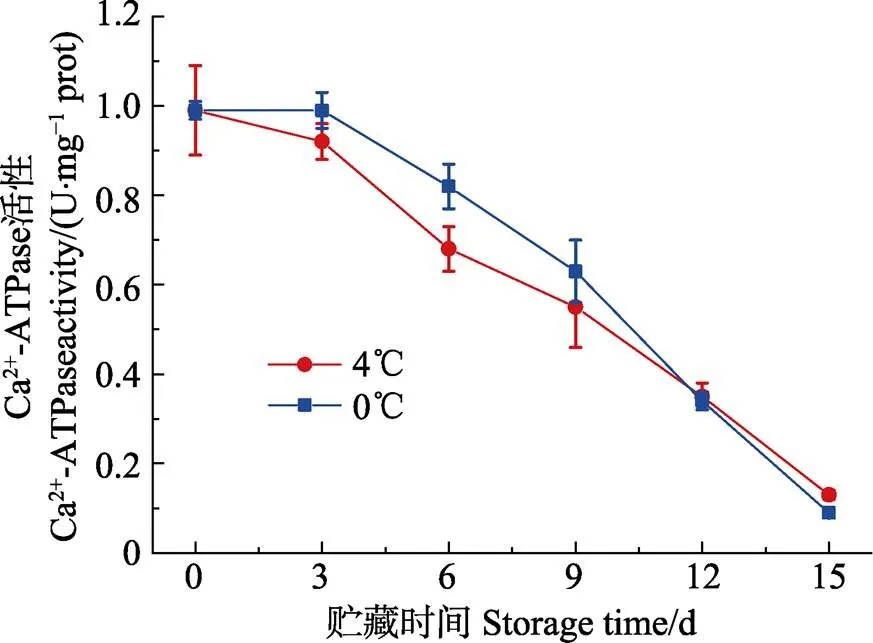
图4 带鱼在冷藏过程中Ca2+-ATPase活性的变化
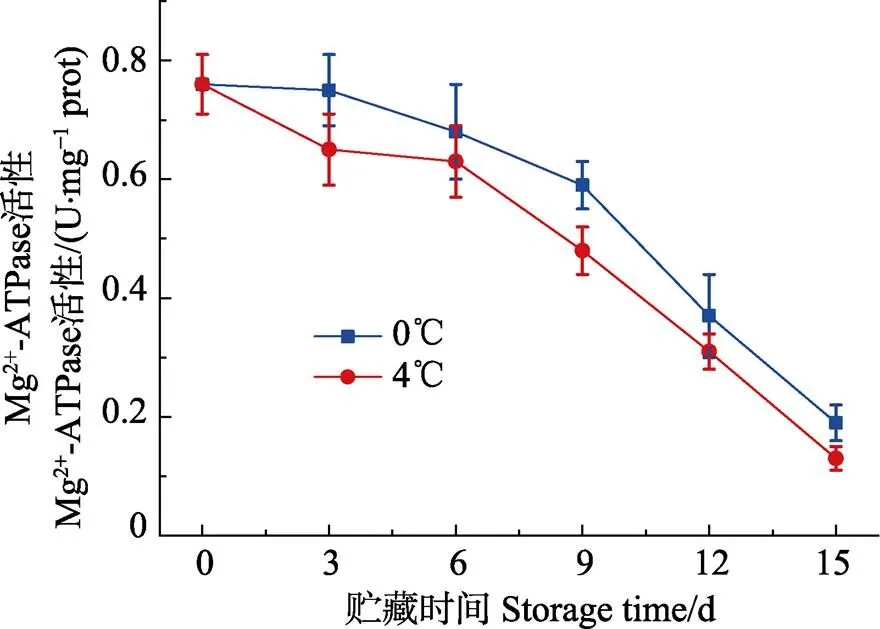
图5 带鱼在冷藏过程中Mg2+-ATPase活性的变化
2.5 冷藏过程中蛋白的SDS-PAGE条带变化
如图6所示,Real Band蛋白预染Marker左侧和右侧分别是0℃和4℃冷藏条件下的全蛋白电泳图。从图6中可以看出,全蛋白SDS-PAGE条带分布较广,分子量基本在25~245 kDa范围内,以肌球蛋白重链(MHC)和肌动蛋白为主。在贮藏的15 d内,MHC条带基本没有变化,既没有新条带的产生,已有条带也没有明显的消失,表明提取的带鱼肉全蛋白没有显著降解或聚集。这与Li等(2014)对死后大黄鱼的蛋白质变化研究结果相似。报道的研究表明,出现此现象的原因可能是与全蛋白提取方法有关,MHC和肌动蛋白在5% SDS溶液中不能完全溶解。有研究证明,海鲈鱼亦有类似情况,即在贮藏期间肌球蛋白和肌动蛋白几乎没有变化(Verrez-Bagnis, 2001)。说明在低温冷藏条件下,全溶性蛋白的MHC和Actin变化不大,基本不受0℃及4℃贮藏条件的影响。

图6 冷藏过程中带鱼肉全蛋白的SDS-PAGE
Std: Real Band蛋白预染Marker;MHC: 肌球蛋白重链;α-Actinin: α-辅肌动蛋白;Actin: 肌动蛋白。Std左侧0~15 d为0℃冷藏样品;Std右侧0~15 d为4℃冷藏样品。下同
Std: Real Band pre-dyed Marker; MHC: myosin heavy chain; Left of Std: samples stored for 0~15 d at 0℃; right of Std: samples stored for 0~15 d at 4℃. The same as below
带鱼肉水溶性蛋白的电泳图如图7所示,Real Band蛋白预染Maker左侧和右侧分别是0℃和4℃冷藏条件。水溶性蛋白主要是肌浆蛋白,从图7中可以看出,2种冷藏温度下蛋白条带分子量集中在25~ 60 kDa范围内。整个贮藏期内蛋白条带并没有明显的变化,由此可见,0℃及4℃低温冷藏条件下,水溶性蛋白几乎没有受到影响。
图8显示了0℃(左侧)和4℃(右侧)2种冷藏条件下带鱼肉高盐溶性蛋白的变化情况。高盐溶性蛋白的主要成分是肌原纤维蛋白,其条带分布很广,分子量在10~245 kDa之间,比较明显的是肌球蛋白(MHC)、肌动蛋白(Actin)、原肌球蛋白(Tropomyosin)、Ⅰ(41~42 kDa)、Ⅱ(19~20 kDa)和Ⅲ(13~15 kDa)蛋白条带。从图8中可以看出,在0℃和4℃贮藏期内,除了原肌球蛋白条带没有明显变化,其他上述蛋白条带均发生了不同程度的降解。另外,在4℃贮藏后期,图中肌动蛋白的条带变粗,可能是肌动蛋白含量增多或MHC降解。有文献(Li, 2014)报道过,将死后的大黄鱼贮藏在-2℃的条件下,在提取的高盐溶性蛋白电泳图中,分子量约为32~34 kDa和67 kDa的条带增加,可能是由于MHC降解引起的,本次实验的现象与其研究结果相似。
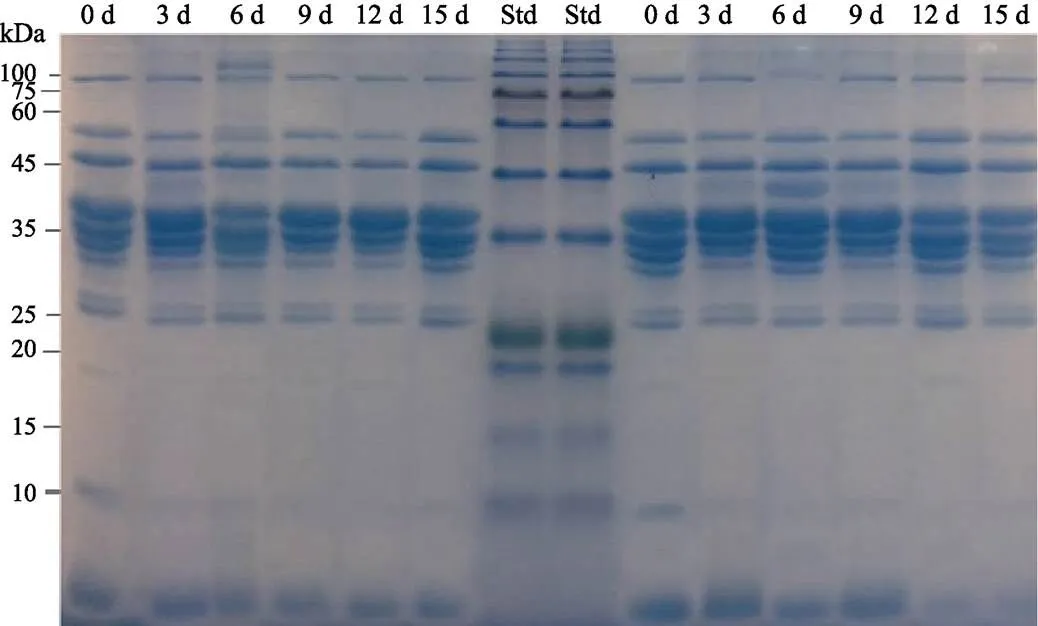
图7 冷藏过程中带鱼肉水溶性蛋白的SDS-PAGE
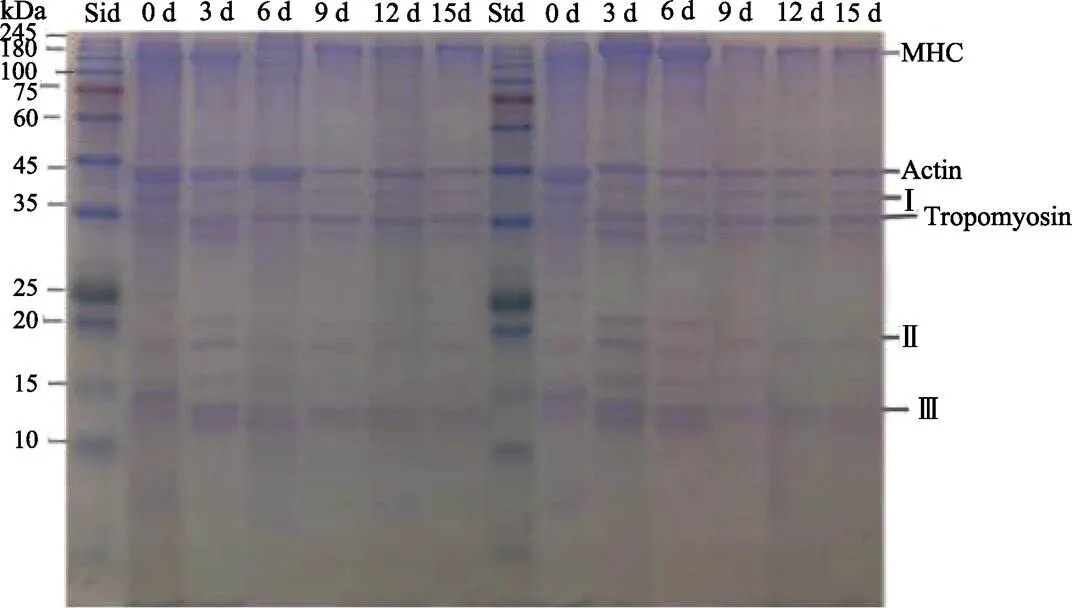
图8 冷藏过程中带鱼肉高盐溶性蛋白的SDS-PAGE
Tropomyosin:原肌球蛋白;Ⅰ、Ⅱ和Ⅲ为不同分子量的蛋白条带
Ⅰ,ⅡandⅢ: Protein bands with different molecular weights
3 结论
与4℃贮藏相比,0℃条件下贮藏减缓了带鱼肌原纤维蛋白的降解速率,但贮藏时间长达15 d时,2种冷藏条件下贮藏的带鱼蛋白都已变性,相互之间并没有显著差异性(<0.05)。TCA可溶性肽含量的上升、巯基含量的下降以及高盐溶性蛋白SDS-PAGE图表明,随着贮藏时间的延长,肌原纤维蛋白中的肌球蛋白和肌动蛋白出现了逐渐降解的现象(顾冰宁等, 2018)。带鱼肌原纤维蛋白的表面疏水性在贮藏期间总体呈上升趋势,说明了蛋白质变性引起的疏水基团的暴露,同时贮藏15 d后Ca2+、Mg2+-ATPase活性显著降低,可能是巯基氧化使得二硫键发生了交联,也表明了蛋白已经严重变性水解、降解,带鱼肉已不能食用。综上所述,虽然低温贮藏是目前常用的食物保鲜方法,但是对于带鱼的短期存贮,0℃和4℃这2种冷藏条件并不能很好的维持其新鲜度,也不能保持良好的鱼肉品质,所以探讨和研发更完善的贮藏方式很有必要。
Benjakul S, Seymour TA, Morrissey MT,. Physicochemical changes in Pacific whiting muscle proteins during iced storage. Journal of Food Science, 1997, 62(4): 729–733
Benjakul S, Visessanguan W, Tueksuban J. Changes in physico- chemical properties and gel-forming ability of lizardfish () during post-mortem storage in ice. Food Chemistry, 2003, 80(4): 535–544
Chen YL, Shan XJ, Dai FQ,. Relative stock density and distribution of hairtailand its spawning stock structure in coastal waters of the East China Sea. Progress in Fishery Sciences, 2013, 34(4): 8–15 [陈云龙, 单秀娟, 戴芳群, 等. 东海近海带鱼群体相对资源密度、空间分布及其产卵群体的结构特征. 渔业科学进展, 2013, 34(4): 8–15]
Decker EA, Xiong YL, Calvert JT,. Chemical, physical, and functional properties of oxidized turkey white muscle myofibrillar proteins. Journal of Agricultural and Food Chemistry, 1993, 41(2): 186–189
Dileep AO, Shamasundar BA, Binsi PK,. Effect of ice storage on the physicochemical and dynamic viscoelastic properties of ribbonfish (spp) meat. Journal of Food Science, 2005, 70(9): E537–E545
Gallart-Jornet L, Rustad T, Barat JM,. Effect of superchilled storage on the freshness and salting behaviour of Atlantic salmon () fillets. Food Chemistry, 2007, 103(4): 1268–1281
Gu BN, Liu X, Shen HD,. Molecular cloning and analysis of thegene in. Progress in Fishery Sciences, 2018, 39(4): 126–138 [顾冰宁, 刘欣, 沈和定, 等. 瘤背石磺肌球蛋白重链()基因的克隆与表达分析. 渔业科学进展, 2018, 39(4): 126–138]
Haard NF. Protein hydrolysis in seafoods//Seafoods: Chemistry, processing technology and quality. Springer US, 1994, 10– 33
Kobayashi Y, Park JW. Biochemical and physical characterizations of fish protein isolate and surimi prepared from fresh and frozen whole fish. LWT - Food Science and Technology, 2017, 77: 200–207
Kouassi GK, Anantheswaran RC, Knabel SJ,. Effect of high-pressure processing on activity and structure of alkaline phosphatase and lactate dehydrogenase in buffer and milk. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9520–9529
Leelapongwattana K, Benjakul S, Visessanguan W,. Physicochemical and biochemical changes during frozen storage of minced flesh of lizardfish (). Food Chemistry, 2005, 90(1–2): 141–150
Lefevre F, Fauconneau B, Thompson JW,. Thermal denaturation and aggregation properties of Atlantic salmon myofibrils and myosin from white and red muscles. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4761– 4770
Li T, Li J, Hu W,. Protein changes inlarge yellow croaker () monitored by SDS- PAGE and proteome analysis. Food Control, 2014, 41(1): 49–55
Li TT. Studies on bio-preservation techniques and protein Indicators of freshness in large yellow croaker (). Doctoral Dissertation of Zhejiang Gongshang University, 2013, 1–193 [李婷婷. 大黄鱼生物保鲜技术及新鲜度指示蛋白研究. 浙江工商大学博士研究生学位论文, 2013, 1–193]
Li YQ. Protein oxidation-induced structure and function changes of common carp () protein and its control technology. Doctoral Dissertation of Northeast Agricultural University, 2013, 1–114 [李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术. 东北农业大学博士研究生学位论文, 2013, 1–114]
Lund MN, Lametsch R, Hviid MS,. High-oxygen packaging atmosphere influences protein oxidation and tenderness of porcineduring chill storage. Meat Science, 2007, 77(3): 295–303
Meucci E, Mordente A, Martorana GE. Metal-catalyzed oxidation of human serum albumin: Conformational and functional changes. Implications in protein aging. Journal of Biological Chemistry, 1991, 266(8): 4692–4699
Noguchi E, Yamamoto J. Studies on the “Arai” phenomenon (the muscle contraction caused by perfusing water)-III. Nippon Suisan Gakkaishi, 1955, 20(11): 1020–1022
Ouali A, Valin C. Effect of muscle lysosomal enzymes and calcium activated neutral proteinase on myofibrillar ATPase activity: Relationship with ageing changes. Meat Science, 1981, 5(3): 233–245
Park D, Xiong YL, Alderton AL,. Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems. Journal of Agricultural and Food Chemistry, 2006, 54(12): 4445–4451
Prodpran T, Benjakul S, Phatcharat S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein. International Journal of Biological Macromolecules, 2012, 51(5): 774–782
Rivett AJ, Levine RL. Metal-catalyzed oxidation of, glutamine synthetase: Correlation of structural and functional changes. Archives of Biochemistry and Biophysics, 1990, 278(1): 26–34
Shi Y, Li RY, Tu ZC,. Effect of γ-irradiation on the physicochemical properties and structure of fish myofibrillar proteins. Radiation Physics and Chemistry, 2015, 109(10): 70–72
Stadtman ER, Oliver CN. Metal-catalyzed oxidation of proteins. Physiological consequences. Journal of Biological Chemistry, 1991, 266(4): 2005–2008
Tian Y, Du JB. Effect of disulfide bond and mercapto-group on structure and function of protein and analytical method. Journal of Applied Clinical Pediatrics, 2007, 22(19): 1499– 1501 [田悦, 杜军保. 二硫键和巯基在蛋白质结构功能中的作用及分析方法. 实用儿科临床杂志, 2007, 22(19): 1499–1501]
Verrez-Bagnis V, Ladrat C, Morzel M,. Protein changes insea bass () muscle monitored by one- and two-dimensional gel electrophoresis. Electrophoresis, 2001, 22(8): 1539–1544
Wang H, Liceaga-Gesualdo AM, Li-Chan ECY. Biochemical and physicochemical characteristics of muscle and natural actomyosin isolated from young Atlantic salmon () fillets stored at 0 and 4℃. Journal of Food Science, 2003, 68(3): 784–789
Effect of Chilling Storage on the Muscle Protein of Hairtail
SHEN Ni, WU Tiantian, LI Yuan, JIANG Yangyang, CHEN Shiguo, HU Yaqin①
(National Engineering Laboratory of Intelligent Food Technology and Equipment, Key Laboratory for Agro-Products Postharvest Handling of Ministry of Agriculture and Rural Affairs, Key Laboratory for Agro-Products Nutritional Evaluation of Ministry of Agriculture and Rural Affairs, Zhejiang Key Laboratory for Agro-Food Processing, Fuli Institute of Food Science, College of Biosystems Engineering and Food Science, Ningbo Research Institute, Zhejiang University, Hangzhou 310058)
The hairtail () is rich in protein and high in nutrition. In this study, the effects of chilling storage on the muscle protein of hairtail were studied by measuring a series of physical and chemical indicators that characterize changes in the fish quality, including TCA-soluble peptides, sulfhydryl group content, surface hydrophobicity, Ca2+-ATPase activity, and Mg2+-ATPase activity, as well as SDS-PAGE patterns of total soluble proteins, water-soluble proteins, low-salt-soluble proteins, and high-salt-soluble proteins. The effects of 0℃ and 4℃ chilling on the fish muscle protein were observed after 15 days of storage, and the oxidation, denaturation, and degradation of the fish protein under the two storage temperatures were compared. The results showed that after 0℃ and 4℃ storage for 15 days, the TCA-soluble peptides increased from 1.446 μmol/g to 6.717 μmol/g and 7.595 μmol/g, respectively. The Ca2+-ATPase activities were lower than the initial values, decreasing from 0.99 U/mg prot to 0.092 U/mg prot and 0.134 U/mg prot, respectively. The Mg2+-ATPase activities also decreased from 0.76 U/mg prot to 0.199 U/mg prot and 0.125 U/mg prot, respectively. In addition, the sulfhydryl group content decreased from 38.15 μmol/g MP to 35.82 μmol/g MP and 30.36 μmol/g MP, respectively. The surface hydrophobicity first increased and then decreased, but the values were higher than those of the fresh samples. The changes in the values of this series of physical and chemical indicators indicated that the refrigerating conditions of 0℃ and 4℃ were not conducive to the long-term storage of the hairtail. Prolonged storage time destroyed the freshness and quality of the hairtail owing to protein oxidation, which caused a bad odor and rendered the fish inedible. From the microstructure perspective, there were almost no changes in the total soluble proteins and water-soluble proteins. However, the high-salt-soluble proteins degraded under storage, indicating that the myofibrillar protein had degraded gradually, decreasing the fish quality. Moreover, the rate of myofibrillar protein degradation and corruption of the fish was slower at 0℃ than at 4℃ on the same day during storage.
Hairtail; Chilling storage; Myofibrillar protein; Physical and chemical indicators; Degradation
TS254.7
A
2095-9869(2019)06-0196-07
10.19663/j.issn2095-9869.20180818002
http://www.yykxjz.cn/
沈妮, 吴甜甜, 李苑, 江杨阳, 陈士国, 胡亚芹. 低温冷藏对带鱼肌肉蛋白的影响. 渔业科学进展, 2019, 40(6): 196–202
Shen N, Wu TT, Li Y, Jiang YY, Chen SG, Hu YQ. Effect of chilling storage on the muscle protein of hairtail. Progress in Fishery Sciences, 2019, 40(6): 196–202
* 国家自然科学基金面上项目(31671918)资助 [This work was supported by the National Natural Science Foundation of China (31671918)]. 沈 妮,E-mail:289262364@qq.com
胡亚芹,教授,E-mail:yqhu@zju.edu.cn
2018-08-18,
2018-09-13
HU Yaqin, E-mail: yqhu@zju.edu.cn
(编辑 陈辉)
