刺参养殖池塘中一株植物乳杆菌的分离及其生物学特性*
2019-12-06张永刚王印庚王金燕廖梅杰宁鲁光范瑞用
张永刚 李 彬 王印庚 王金燕 廖梅杰 张 正 宁鲁光 范瑞用
刺参养殖池塘中一株植物乳杆菌的分离及其生物学特性*
张永刚1,2,3李 彬2,3①王印庚2,3王金燕2,3廖梅杰2,3张 正2,3宁鲁光4范瑞用5
(1. 大连海洋大学水产与生命学院 大连 116023;2. 农业农村部海洋渔业可持续发展重点实验室中国水产科学研究院黄海水产研究所 青岛 266071;3. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 青岛 266071;4. 山东海跃水产科技有限公司 东营 257500;5. 青岛瑞滋海珍品发展有限公司 青岛 266400)
2017年5月,从山东东营刺参()养殖池塘底泥中分离获得49株乳酸菌。以刺参“腐皮综合征”的2株致病菌[灿烂弧菌()和假交替单胞菌()]为指示菌进行拮抗作用实验,获得1株具有显著抑菌活性的乳酸菌CLY-5,对该菌株进行了生理生化实验、16S rDNA序列分析、生长特性及其对刺参的安全性研究。结果显示,菌株CLY-5对灿烂弧菌和假交替单胞菌具有较好的抑制作用,且菌株的胞内产物与胞外产物均具有抑菌效果,抑菌圈分别为20 、23 mm和27 、38 mm,胞外产物的拮抗作用优于胞内产物。利用该菌对刺参进行高浓度浸浴测试其安全性,浓度为1×109、1×108和1×107CFU/ml,实验期间刺参状态良好,无死亡现象。16S rDNA序列分析表明,CLY-5与植物乳杆菌(NR117813.1)的相似性为100%,初步鉴定该菌株为植物乳杆菌。菌株CLY-5在30℃~44℃、pH 6~8范围内生长较快,20 h进入对数生长期,28~32 h达到生长高峰。筛选的植物乳杆菌具有良好的抑菌能力,且其生长特性适应刺参池塘的养殖环境,为刺参疾病的生态防控及乳酸菌资源的开发提供应用数据参考。
刺参;腐皮综合征;灿烂弧菌;假交替单孢菌;植物乳杆菌;抑菌活性
仿刺参()又称刺参,是营养价值和药用价值极高的海珍品,被誉为“海产八珍”之首,主要分布于辽宁、河北、山东沿海。2016年刺参养殖面积达到21.8万hm2,年产量达到20.4万t (农业部渔业渔政管理局, 2017)。然而,随着刺参养殖业的迅速扩展,特别是集约化与规模化养殖技术的推广,病害问题也接踵而至,严重影响了该产业的健康可持续发展。刺参的主要疾病为“腐皮综合征”,其发病率和死亡率高,是制约该养殖业的一大难题。已报道的主要致病菌有假交替单胞菌()(王印庚等, 2006)、灿烂弧菌()(张春云等, 2006)等。目前,水产动物疾病大多采用抗生素类化学药物控制,长期使用会导致病原菌产生耐药性和养殖环境微生物的生态平衡失调(Estefanía, 2013)。而乳酸菌既可抑制有害菌的生长,又能改善水质、增强免疫力、促进养殖动物生长,逐渐成为水产健康养殖的研究热点(Chi, 2014; Wang, 2015; Zhao, 2016)。
乳酸菌(Lactic acid bacteria, LAB)是一类可以利用碳水化合物产生大量乳酸且具有拮抗、免疫及营养等作用的细菌的总称,作为一种天然活性益生菌广泛分布于自然界中,在水产、畜禽及食品加工等产业中应用广泛(谯仕彦等, 2014; 王睿迪等, 2018; Navinchandran, 2014; Khouadja, 2017; Li, 2018)。而乳酸菌在刺参养殖的应用研究中,已初步揭示了乳酸菌对刺参生长、免疫及养殖环境的作用。宫魁等(2013)发现,在刺参基础饲料中添加乳酸菌及其代谢产物对刺参肠道菌群平衡、免疫力及生长均具有良好的促进作用。张涛等(2009)利用乳酸菌和芽孢杆菌以不同浓度配比添加到饲料中进行刺参饲养实验,发现对提高刺参的免疫功能有积极作用。然而,关于乳酸菌对刺参病害防控的研究鲜有报道,本研究从刺参养殖池塘底泥中筛选可抑制刺参主要病原菌的乳酸菌,并研究其生长特性,为刺参池塘健康养殖提供优良的乳酸菌株和应用数据参考。
1 材料与方法
1.1 材料
1.1.1 池塘条件 本研究在山东省东营市某刺参养殖场进行,池塘面积约为5.01 hm2,水深为1.5~2 m。水源来自近海海水,刺参密度为20万头/hm2,规格约为1~2 g/头,春秋季投喂鼠尾藻、海带等饵料。
1.1.2 样品采集 釆样时间为2017年5月,水温为23℃,盐度为29;利用调查船驶到池塘中预先标记好的采样点,使用采泥器在池塘中间的2个点位分别采集池底底泥的表层物(约5 cm),将其混合,4℃保存。
1.1.3 培养基 LB培养基和MRS培养基均购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 乳酸菌的培养与分离 称取底泥样品1 g,使用灭菌生理盐水进行梯度稀释,充分混匀,收集上清液。用灭菌生理盐水再对上清液进行稀释后,涂布MRS平板,37℃倒置培养24~48 h,进行平板计数、分离和保种,‒80℃保存。
1.2.2 拮抗菌的筛选 以刺参“腐皮综合征” 2种致病菌灿烂弧菌及假交替单胞菌为指示菌,采用牛津杯法测定分离的乳酸菌对2株致病菌的抑制效果。用接种环刮取少量指示菌,使用灭菌生理盐水稀释后,均匀涂布于牛津杯打孔的LB平板上。同样,用接种环刮取活化24 h的分离菌株,使用灭菌生理盐水稀释到1×108CFU/ml,取150 μl置于小孔内,37℃培养24~36 h,观察小孔周围抑菌圈情况。最后,选取对 2株具有最佳抑菌效果的乳酸菌CLY-5作为候选益生菌,并进一步开展菌株CLY-5胞内、胞外产物抑菌效果比较及对刺参的安全性评价。
1.2.3 菌株胞内、胞外产物的抑菌效果比较
1.2.3.1 胞内及胞外产物的制备 采用MRS液体培养基对乳酸菌CLY-5进行培养,37℃、180 r/min恒温培养24 h。培养液5000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤,得到无细胞上清液,即为供试菌胞外产物,于4℃冰箱保存备用。菌株CLY-5菌泥使用PBS冲洗3次后,用超声波细胞破碎仪进行细胞破碎,得到供试菌胞内产物,随即用于进一步实验。
1.2.3.2 胞内及胞外产物抑菌效果比较 以灿烂弧菌及假交替单胞菌为指示菌,采用牛津杯法分别测定所制备的乳酸菌CLY-5胞内产物和胞外产物对 2株致病菌的抑制效果。
1.2.4 菌株对刺参的安全性评价 实验用健康刺参来自山东省青岛瑞滋海珍品发展有限公司,规格为15~20 g/头。刺参在暂养7 d后随机分组,每组20头。实验水槽有效容积为25 L。分实验组和对照组,其中,实验组采用浸浴方式,浸浴浓度为1×107、1×108和1×109CFU/ml,每个组别设3个平行。
实验共进行30 d,实验期间的水温为16℃~18℃、盐度为29,保持连续充气,每天饵料按刺参重量的1%投喂,用虹吸法吸取水槽内残饵及粪便,日换水量为总水量的1/5,换水后,在水槽中加入相应浓度菌液。每天观察并记录刺参的活力、体色、摄食、排便、病征及死亡等情况。
1.2.5 菌株的生理生化鉴定 参照麦氏比浊法制备0.5麦氏浊度的菌悬液,以细菌微量检定管进行生理生化指标的测定。参照《常见细菌系统鉴定手册》(东秀珠等, 2001)和《乳酸细菌分类鉴定及实验方法》(凌代文等, 1999)进行归类判定。
1.2.6 菌株的16S rDNA序列分析 采用北京天根生物细菌基因组DNA提取试剂盒进行细菌DNA的提取。利用细菌16S rDNA基因通用引物27F(5′-AGAGT- TTGATCCTGGCTCAG-3′)和1492R(5′-TACGGCTAC- CTTGTTACGACTT-3′)对细菌总DNA的相应序列进行扩增,扩增产物经1%琼脂糖凝胶电泳检验后进行测序。将测序结果通过Blast检索程序与NCBI基因库中相关序列进行比对,并通过MEGA 6.0软件构建系统发育树。
1.2.7 菌株生长特性研究
1.2.7.1 不同温度条件对菌株生长的影响 参照孔彦卓等(2017),将筛选菌株CLY-5接种于已灭菌的300 ml MRS液体培养基中,置于16℃、23℃、30℃、37℃、44℃、51℃、58℃细菌振荡培养箱中,180 r/min恒温培养24 h,计数,确定菌株的最适温度。
1.2.7.2 不同pH条件对菌株生长的影响 参考杜静芳等(2017),用1 mol/L的NaOH和HCl将MRS液体培养基pH分别调至2、4、6、8、10和12,将筛选菌株CLY-5接种于不同pH的300 ml MRS液体培养基中,180 r/min恒温培养24 h,计数,确定菌株最适pH。
1.2.7.3 绘制菌株生长曲线 将乳酸菌CLY-5接种于已灭菌的300 ml MRS液体培养基中,根据菌株最适生长温度,180 r/min恒温培养52 h。培养过程中每间隔4 h取1次样品,计数,绘制菌株的生长曲线。
2 结果
2.1 拮抗菌的筛选
利用MRS培养基对刺参养殖池塘底泥样品中的乳酸菌进行培养、分离与纯化,共获得49株乳酸菌,分别编号为CLY-1~CLY-49。通过对指示菌的拮抗实验,筛选出1株具有显著拮抗作用的乳酸菌CLY-5,该菌株对灿烂弧菌和假交替单胞菌均有良好的抑制作用(图1)。该菌株形成的群落表面光滑、有光泽、中央隆起、不透明、乳白色或淡黄色、具有酸味。显微镜下呈直或弯杆状,两端呈圆形突起,革兰氏染色阳性,无鞭毛、无芽孢(图2、图3)。

图1 菌株CLY-5对病原菌的抑制作用
A:灿烂弧菌;B:假交替单孢菌
A:; B:

图2 菌株CLY-5的革兰氏染色

图3 菌株CLY-5的透射电镜
2.2 菌株胞内、胞外产物的抑菌效果比较
由图4可以看出,候选菌株CLY-5的胞内、胞外产物对指示菌灿烂弧菌和假交替单胞菌均具有较强的抑菌作用,胞内产物对上述2种指示菌的抑菌圈分别为20和23 mm,胞外产物对2种指示菌的抑菌圈分别为27和38 mm。结果显示,候选菌株的胞外产物对指示菌的拮抗作用明显优于胞内产物。
2.3 安全性实验
通过细菌高浓度胁迫实验测试筛选的乳酸菌CLY-5对刺参的安全性(表1),浸浴组1.0×107CFU/ml在整个实验过程中刺参健康,活力良好,摄食正常,无排脏、发病和死亡现象;浸浴浓度在1.0×108和1.0× 109CFU/ml的条件下,高浓度胁迫1 d后,分别有1和3头刺参出现排脏现象,但无死亡现象。

图4 菌株CLY-5胞内、胞外产物对病原菌的抑制作用
A、B为菌株CLY-5胞内产物对灿烂弧菌、假交替单孢菌的抑制作用;C、D为菌株CLY-5胞外产物对灿烂弧菌、假交替单孢菌的抑制作用
A, B: Effects of antibacterial activity of intracellular products of CLY-5 onand; C, D: Effects of antibacterial activity of extracellular products of CLY-5 onand
2.4 生理生化鉴定
通过对菌株CLY-5进行生理生化鉴定,由表2可知,菌株CLY-5能分解利用葡萄糖、山梨醇、蜜二糖、木糖、蔗糖和甘露醇;3% NaCl尿素酶、3% NaCl、ONPG、苦杏仁苷和丙二酸盐呈阳性,不液化明胶,不产生H2S气体,主要生理生化特征见表2。参照《常见细菌系统鉴定手册》和《乳酸细菌分类鉴定及实验方法》中乳杆菌属的特征,对菌株CLY-5进行分类地位的鉴定,初步鉴定筛选菌株属于乳杆菌科(Lactobacillaceae)。
2.5 菌株16S rDNA序列分析及系统发育树的构建
采用通用引物对菌株CLY-5的16S rDNA PCR扩增产物进行序列测定。使用Blast软件对所获得测序结果在NCBI数据库进行序列相似性比对分析,系统发育树如图5所示。结果显示,本研究分离获得的菌株CLY-5属于乳杆菌科乳杆菌属(),与植物乳杆菌(NR 117813.1)的相似性为100%。
表1 菌株CLY-5的安全性实验

Tab.1 Safety testing of strain CLY-5 onto sea cucumber A. japonicus
2.6 菌株的生长特性
2.6.1 菌株最适生长温度 菌株CLY-5在不同温度下的生长情况如图6所示。菌株在16℃~58℃范围内均可以生长,在16℃~23℃范围内生长速度较缓慢,菌落数没有显著差异,30℃~44℃范围内表现出明显的生长优势;37℃时生长速度最快,菌落数明显高于其他温度组。
2.6.2 不同pH条件对菌株CLY-5生长的影响 菌株CLY-5在不同pH条件下的生长情况如图7所示。pH在2~12范围内均可以生长,但菌株在pH为2和12时生长缓慢,pH为6时生长速度最快。
2.6.3 生长曲线 菌株CLY-5的生长曲线如图8所示。结果显示,CLY-5在0~16 h时生长较缓慢,20 h后进入对数生长期,在24~32 h时达到生长高峰,28 h时菌落数最高,达到2.13×1010CFU/ml,32 h后生长速度缓慢下降,逐渐进入稳定期。
3 讨论
本研究从山东省东营刺参养殖池塘底泥样品中分离获得49株乳酸菌,通过对刺参“腐皮综合征” 2株致病菌的拮抗实验,获得1株具有显著抑菌活性的菌株CLY-5,通过对其生理生化及16S rDNA序列分析,该菌株鉴定为植物乳杆菌。植物乳杆菌因具有良好的益生菌特性,其报道较多(Lee, 2010; Jiang, 2016; 李存玉等, 2017; 韩墨等, 2018)。但从刺参养殖池塘中分离且对“腐皮综合征”致病菌具有抑制作用的植物乳杆菌尚未见报道。
表2 菌株CLY-5的生理生化特征

Tab.2 Physiological and biochemical characteristics of strain CLY-5
注:+表示阳性,-表示阴性
Note:+means positive reaction,-means negative reaction
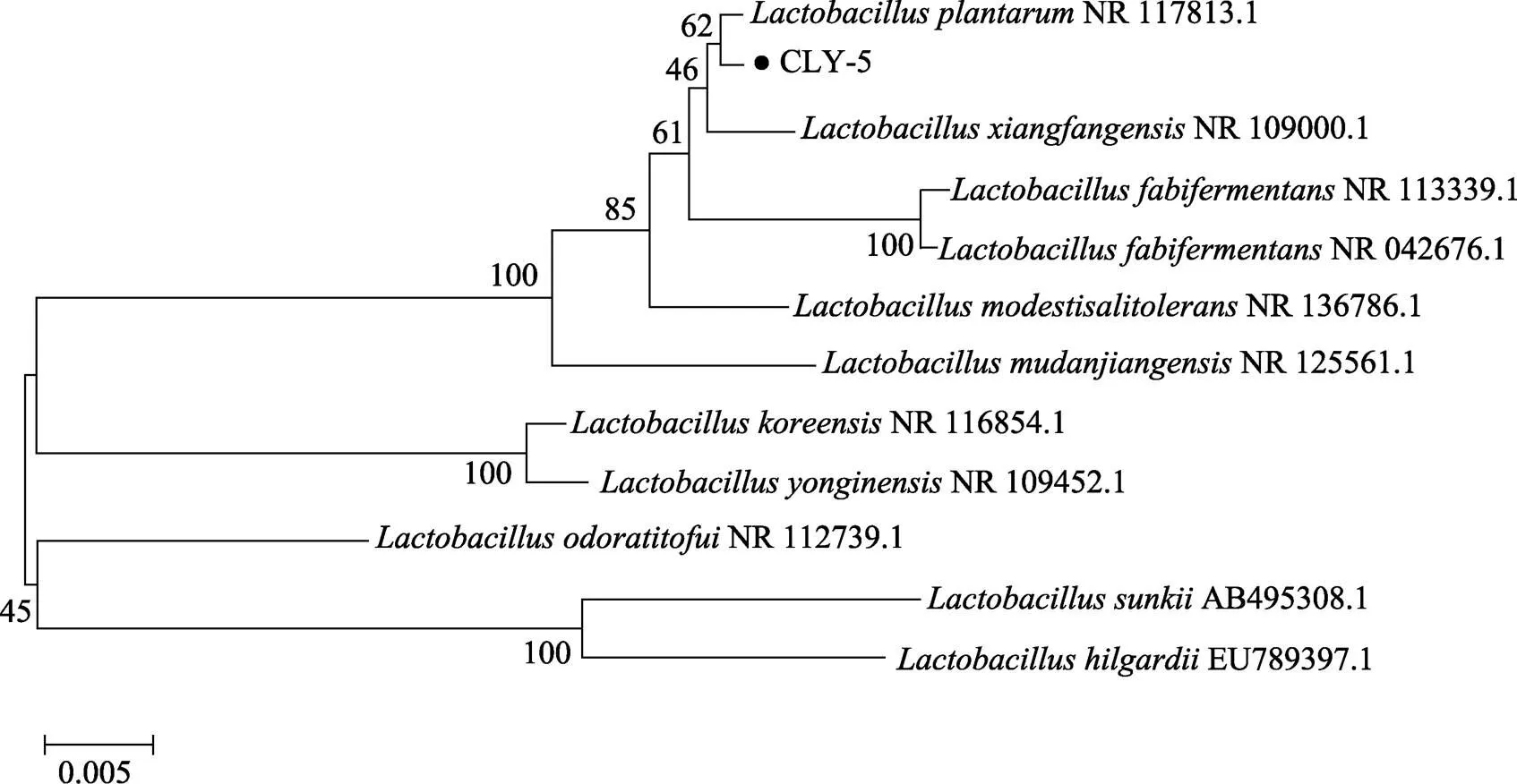
图5 基于16S rDNA序列的菌株CLY-5系统发育树
乳酸菌广泛分布于动物肠道中,能够抑制肠道内致病菌的生长繁殖,并与肠粘膜免疫系统间相互作用,维持肠道内的微生态平衡,使用乳酸菌逐渐成为预防动物疾病的一项重要措施(Balcázar, 2008)。目前,关于乳酸菌抑菌作用机理的研究较多。Cai等(1998)证实了乳酸菌的抑菌物质为乳酸;Lash等(2005)研究发现,植物乳杆菌ATCC8014的胞外产物对多种革兰氏阳性和阴性细菌的生长具有抑制作用,且发现起到抑制作用的物质是植物乳杆菌分泌的一种细菌素。本研究也发现,植物乳杆菌CLY-5的胞内、胞外产物对刺参腐皮综合征2株致病菌(假交替单胞菌和灿烂弧菌)均具有显著抑菌活性,且胞外产物抑菌活性优于胞内产物。下一步将针对具有抑制作用的胞外产物进行成分分析和鉴定,阐明胞外产物的抑菌机理。
温度、pH是影响乳酸菌生长的重要因素,探究乳酸菌的生物学特性对掌握其最适培养条件具有重要意义,可为其发酵生产提供理论依据。本研究筛选的植物乳杆菌CLY-5最适生长温度为37℃,最适pH为6,20 h后进入对数生长期,28 h时生长进入高峰期,活菌数量可达2.13×1010CFU/ml。本研究结果与杜斌等(2018)对植物乳杆菌CJY1-1的生物学特性研究结论相似。曲磊等(2018)研究1株鱼源植物乳杆菌C20015的生物学特性发现,菌株在10 h开始进入生长稳定期,20 h时细菌数达到最大值3.6×109CFU/ml,50℃时,C20015活菌数下降不明显,其生物学特性与本研究结果有一定差异。菌株CLY-5与C20015相比,前者进入对数生长期虽然时间较晚,但在生长高峰时菌量远远高于后者。从生物学特性来看,植物乳杆菌CLY-5的发酵可在温度、酸碱度较大阈值范围内进行,进入高峰期快,且高峰期活菌数量大,适宜进行规模化生产和产品开发。

图6 不同温度下菌株CLY-5的生长情况

图7 不同pH对菌株CLY-5生长的影响

图8 菌株CLY-5的生长曲线
益生菌的安全性和合理性使用引起研究学者的高度重视,一些益生菌的过量使用会引发水产动物出现病症,枯草芽孢杆菌()可引起斑节对虾()细菌性白斑综合征(Wang, 2000);蜡样芽孢杆菌()可引起刺参“腐皮综合征”及凡纳滨对虾()白斑病(骆艺文等, 2009; Velmurugan, 2015)。目前,尚未发现关于乳酸菌造成水产养殖动物发病的报道。本研究筛选的植物乳杆菌CLY-5以1.0×107CFU/ml浸浴健康刺参,供试刺参在30 d时均无发病体征和死亡现象,刺参健康、摄食正常、活力良好。虽然,乳酸菌浸浴浓度为1.0×108和1.0×109CFU/ml实验组少量刺参个体出现了不同程度的排脏现象,这可能是刺参在高浓度乳酸菌胁迫下出现的应激反应。关于植物乳杆菌在水产养殖动物的应用方面,Talpur等(2013)在远海梭子蟹()幼蟹养殖水体中添加浓度为5.0×106CFU/ml的植物乳杆菌,可以显著提高幼蟹的成活率及蛋白酶和淀粉酶活性,同时可以改善养殖水质。刘长军(2018)在罗非鱼饲料中添加浓度为1.0×107CFU/ml的植物乳杆菌,可显著提高罗非鱼的增重率和特定生长率。Suzer等(2008)在黑鲷()仔鱼水体中加入含植物乳杆菌的复合乳酸菌,可提高仔鱼的生长性能及消化酶活性。对植物乳杆菌CLY-5进行了刺参大水面池塘养殖应用发现,其对刺参池塘水质具有良好调控作用,同时对刺参生长也有良好的促进作用(另文报道)。初步的养殖实践显示,将植物乳杆菌CLY-5发酵生产后泼洒到刺参养殖池水中,对刺参是安全的。然而,我国刺参养殖以池塘养殖为主,这种开放式养殖模式的废水大多数是直接排放入海,大量使用植物乳杆菌作为水产微生态制剂是否对其他海水养殖种类、浅海生态环境及菌群结构产生影响,还需进一步研究探讨。
综上所述,植物乳杆菌CLY-5具有对外界适应能力强、生长温度范围广、抑菌能力强,且该菌株对刺参是安全的。今后将进一步对植物乳杆菌CLY-5进行深入研究,探索其对刺参生长、生殖、免疫和养殖池塘菌群结构的影响,开展水域生态环境的安全性评价,为水产动物乳酸菌类微生态制剂的规模化及商品化推广奠定基础。
Balcázar JL, Vendrell D, de Blas I,Characterization of probiotic properties of lactic acid bacteria isolated from intestinal microbiota of fish. Aquaculture, 2008, 278(1–4): 188–191
Cai Y, Benno Y, Nakase T,Specific probiotic characterization ofDS-12 isolated from flounder intestine. Journal of General and Applied Microbiology, 1998, 44(5): 311–316
Chi C, Liu JY, Fei SZ,Effect of intestinal autochthonous probiotics isolated from the gut of sea cucumber () on immune response and growth of. Fish and Shellfish Immunology, 2014, 38(2): 367–373
Dong XZ, Cai MY. Common bacteria system identification manual. Beijing: Science Press, 2001, 45–65 [东秀珠, 蔡妙英. 常见细菌系统鉴定手册. 北京: 科学出版社, 2001, 45–65]
Du B, Wu WN, Wang JY,. Isolation, identification and biological characteristics of lactic acid bacteria from Gaeml traditional preserved fish. Jiangsu Agricultural Sciences, 2018, 46(7): 185–188 [杜斌, 吴文能, 王继玥, 等. 侗族传统腌鱼中乳酸菌的分离鉴定与生物学特性. 江苏农业科学, 2018, 46(7): 185–188]
Du JF, Miao LH, Ma HH,Screening and identification of lactic acid bacteria with antagonisticderived from freshwater fish intestinal. Journal of Chinese Institute of Food Science and Technology,2017, 17(5): 168– 175 [杜静芳, 缪璐欢, 马欢欢, 等. 淡水鱼肠道中拮抗副溶血弧菌乳酸菌的筛选及鉴定. 中国食品学报, 2017, 17(5): 168–175]
Estefanía MA, Beatriz GS, Carlos A,Antimicrobial activity, antibiotic susceptibility and virulence factors of lactic acid bacteria of aquatic origin intended for use as probiotics in aquaculture. BMC Microbiology, 2013, 13(1): 1–22
Fisheries and Fisheries Administration Bureau of the Ministry of Agriculture. China fishery statistics yearbook. Beijing: China Agriculture Press, 2017 [农业部渔业渔政管理局. 中国渔业统计年鉴. 北京: 中国农业出版社, 2017]
Gong K, Wang BJ, Liu M,The influence of lactic acid bacteria and metabolites on intestinal microflora and nonspecific immunity of juvenile sea cucumber ().Marine Sciences, 2013, 37(7): 7–12 [宫魁, 王宝杰, 刘梅, 等. 乳酸菌及其代谢产物对刺参幼体肠道菌群和非特异性免疫的影响. 海洋科学, 2013, 37(7): 7–12]
Han M, Wang Y, Yang ZP,Screening of lactic acid bacteria in traditional yoghurt of Inner Mongolia and evaluation of its benefitFood Research and Development, 2018, 39(1): 152–156 [韩墨, 王燕, 杨志鹏, 等. 内蒙古传统酸奶乳酸菌的筛选及体外益生效果评价. 食品研究与开发, 2018, 39(1): 152–156]
Jiang ML, Zhang F, Wan CX,Evaluation of probiotic properties ofWLPL04 isolated from human breast milk. Journal of Dairy Science, 2016, 99(3): 1736–1746
Khouadja S, Haddaji N, Hanchi M,Selection of lactic acid bacteria as candidate probiotics fordepuration in Pacific oysters (). Aquaculture Research, 2017, 48(4): 1885–1894
Kong YZ, Yin LB, Lei ZM,Study on isolation and characterization of high acid-producing lactic acid bacteria. China Food Additives, 2017(9): 88–94 [孔彦卓, 尹乐斌, 雷志明, 等. 一株高产酸乳酸菌的分离鉴定及生物学特性研究. 中国食品添加剂, 2017(9): 88–94]
Lash BW, Mysliwiec TH, Gourama H. Detection and partial characterization of a broad-range bacteriocin produced by(ATCC8014). Food Microbiology, 2005, 22(2-3): 199-204.
Lee HI, Kim MH, Kim KY,Screening and selection of stress resistantspp. isolated from the marine oyster (). Anaerobe, 2010, 16(5): 522–526
Li C, Ren Y, Jiang S,. Effects of dietary supplementation of four strains of lactic acid bacteria on growth, immune- related response and genes expression of the juvenile sea cucumberSelenka. Fish and Shellfish Immunology, 2018, 74: 69–75
Li CJ. The effect of08.923 ongut mucosal immunity and growth performanceFeed Industry, 2018, 39(12): 43–48 [刘长军. 植物乳杆菌对尼罗罗非鱼的肠道黏膜免疫调节及生长性能的影响. 饲料工业, 2018, 39(12): 43–48]
Li CY, Liu XZ, Xu YJ,Isolation, culture, and identification of two strains of probiotics and their effects on water quality control. Progress in Fishery Sciences, 2017, 38(1): 120–127 [李存玉, 柳学周, 徐永江, 等. 两株有益菌的分离、培养、鉴定及其水质调控效果评价. 渔业科学进展, 2017, 38(1): 120–127]
Ling DW, Dong XZ. Classification and identification of lactic acid bacteria and experimental methods. Beijing: China Light Industry Press, 1999, 130–137 [凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法. 北京: 中国轻工业出版社, 1999, 130–137]
Luo YW, Hao ZK, Wang YG,Acausing “skin ulcer syndrome” of sea cucumber. Fisheries Science and Technology Information, 2009, 36(2): 60–63 [骆艺文, 郝志凯, 王印庚, 等. 一株引起刺参“腐皮综合征”的蜡样芽胞杆菌. 水产科技情报, 2009, 36(2): 60–63]
NavinChandran M, Iyapparaj P, Moovendhan S,Influence of probiotic bacteriumisolated from the gut of wild shrimpin turn as a potent growth promoter and immune enhancer in. Fish and Shellfish Immunology, 2014, 36: 38–45
Qiao SY, Hou CL, Zeng XF. Regulation and mechanism of lactic acid bacteria on porcine intestinal barrier function. Chinese Journal of Animal Nutrition, 2014, 26(10): 3052–3063 [谯仕彦, 侯成立, 曾祥芳. 乳酸菌对猪肠道屏障功能的调节作用及其机制. 动物营养学报, 2014, 26(10): 3052–3063]
Qu L, Kang YH, Sun WW,Research on some biological characteristics of astrain isolated from fish. Heilongjiang Animal Science and Veterinary Medicine, 2018(5): 181–184 [曲磊, 康元环, 孙武文, 等. 一株鱼源植物乳杆菌的部分生物学特性研究. 黑龙江畜牧兽医, 2018(5): 181–184]
Suzer C, Coban D, Kamaci HO,.spp. bacteria as probiotics in gilthead sea bream (L) larvae: Effects on growth performance and digestive enzyme activities. Aquaculture, 2008, 280(1–4): 140–145
Talpur AD, Ikhwanuddin M, Abdullah MDD,. Indigenousas probiotic for larviculture of blue swimming crab,(Linnaeus, 1758): Effects on survival, digestive enzyme activities and water quality. Aquaculture, 2013, 416–417: 173–178
Velmurugan S, Palanikumar P, Velayuthani P,Bacterial white patch disease caused by, a new emerging disease in semi-intensive culture of. Aquaculture, 2015, 444(3): 49–54
Wang JH, Zhao LQ, Liu JF,Effect of potential probioticD30 on the growth performance, digestive enzyme activity and immunity in juvenile sea cucumber. Fish and Shellfish Immunology, 2015, 43(5): 330–336
Wang RD, Liu SN, Wang Y,Analysis on quality characteristics and dominant strains of dried salted Spanish mackerel. Progress in Fishery Sciences, 2019, 40(2): 141– 147 [王睿迪, 刘胜男, 王玉, 等. 咸干蓝点马鲛品质特征与优势菌群分析. 渔业科学进展, 2019, 40(2): 141–147]
Wang YG, Fang B, Zhang CY,Etiology of skin ulcer syndrome in cultured juveniles ofand analysis of reservoir of the pathogens. Journal of Fishery Sciences of China, 2006, 13(4): 610–616 [王印庚, 方波, 张春云, 等. 养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析. 中国水产科学, 2006, 13(4): 610–616]
Wang YG, Lee KL, Najiah M,A new bacterial white spot syndrome (BWSS) in cultured tiger shrimpand its comparison with white spot syndrome (WSS) caused by virus. Diseases of Aquatic Organisms, 2000, 41(1): 9–18
Zhang CY, Wang YG, Rong XJ. Isolation and identification of causative pathogen for skin ulcerative syndrome inJournal of Fisheries of China, 2006, 30(1): 118–123 [张春云, 王印庚, 荣小军. 养殖刺参腐皮综合征病原菌的分离与鉴定. 水产学报, 2006, 30(1): 118–123]
Zhang T, Bai L, Li L,Effect of different combinations of probiotics on digestibility and immunity index in sea cucumberJournal of Dalian Fisheries University, 2009, 24(S1): 64–68 [张涛, 白岚, 李蕾, 等. 不同添加量的益生菌组合对仿刺参消化和免疫指标的影响. 大连水产学院学报, 2009, 24(S1): 64–68]
Zhao YC, Yuan L, Wan JL,Effects of potential probioticEN25 on growth, immunity and disease resistance of juvenile sea cucumber. Fish and Shellfish Immunology, 2016, 49: 237–242
Screening and Characteristic Analysis offrom Ponds for Sea Cucumber Farming
ZHANG Yonggang1,2,3, LI Bin2,3①, WANG Yingeng2,3, WANG Jinyan2,3, LIAO Meijie2,3, ZHANG Zheng2,3, NING Luguang4, FAN Ruiyong5
(1. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116023; 2. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences, Qingdao 266071; 3. Pilot National Laboratory for Marine Science and Technology (Qingdao), Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao 266071; 4. Shandong Haiyue Aquatic Science and Technology Co. Ltd, Dongying 257500; 5. Qingdao Ruizi Seafood Development Co. Ltd, Qingdao 266400)
Forty-nine lactic acid bacteria strains were isolated from sediment samples from cultured ponds of sea cucumbers () in Dongying, Shandong Province, in May 2017. First, antagonistic bacterial experiments were conducted usingand, which are the main pathogenic bacteria of “skin ulcer syndrome” for sea cucumbers, and a lactic acid bacteria CLY-5, which has demonstrated significant bacteriostatic activity. Next, physiological and biochemical experiments and a similarity analysis of 16S rDNA sequences as well as the growth character of CLY-5 were carried out. A safety experiment for sea cucumbers was also performed. The results revealed that CLY-5 strain successfully inhibitedand. Meanwhile, the strain’s intracellular and extracellular products effectively inhibitedandas demonstrated by inhibition zone diameters of 20 mm, 23 mm, and 27 mm, 38 mm, respectively,with extracellular products showing superior performance compared with intracellular products. Dipping bath concentrations were set to 1×109, 1×108, and 1×107CFU/ml to test the safety of CLY-5 for sea cucumbers. During the experiment, all sea cucumbers were in good conditions. Based on the 16S rDNA sequence analysis, strain CLY-5 was determined to be identical toNR117813.1. In addition, strain CLY-5 exhibited superior growth at 30℃~44℃ and salinities of 6 to 8. Moreover, CLY-5 came into a logarithmic growth phase after 20 h of cultivation and reached peak growth after 28~32 h. In summary, strain CLY-5 could be used to reduce the occurrence of sea cucumber disease and is also suitable for pond culture environment. These results provide a basis for ecological prevention strategies in disease control, and should prove useful in the development and utilization of lactic acid bacteria.
;Skin ulcer syndrome;;;;Antagonistic activity
S9174;S968.9
A
2095-9869(2019)06-0154-09
10.19663/j.issn2095-9869.20180912002
http://www.yykxjz.cn/
张永刚, 李彬, 王印庚, 王金燕, 廖梅杰, 张正, 宁鲁光, 范瑞用. 刺参养殖池塘中一株植物乳杆菌的分离及其生物学特性. 渔业科学进展, 2019, 40(6): 154–162
Zhang YG, Li B, Wang YG, Wang JY, Liao MJ, Zhang Z, Ning LG, Fan RY. Screening and characteristic analysis offrom ponds for sea cucumber farming. Progress in Fishery Sciences, 2019, 40(6): 154–162
* 中国水产科学研究院黄海水产研究所基本科研业务费(20603022016008)、中央级公益性科研院所基本科研业务费专项资金(2018GH10)、山东省农业良种工程重大课题(2017LZGC010)、威海市海洋经济创新发展示范城市产业链协同创新类项目和山东省自主创新成果转化专项(2013ZHZX2A0801)共同资助[This work was supported by the Special Scientific Research Funds for Central Non-Profit Institutes, Yellow Sea Fisheries Research Institute, CAFS(20603022016008), Central Public-Interest Scientific Institution Basal Research Fund, CAFS(2018GH10), Agriculture Seed Improvement Project of Shandong Province(2017LZGC010), Industrial Chain Collaborative Innovation Project for Marine Economic Innovation and Development Demonstration in Weihai, and Independent Innovation and Achievements Transformation of Shandong Province (2013ZHZX2A0801)]. 张永刚,E-mail: 2418342572@qq.com
李 彬,E-mail: libin@ysfri.ac.cn
2018-09-12,
2018-10-08
LI Bin, E-mail: libin@ysfri.ac.cn
(编辑 马璀艳)
