加减薯蓣丸对阿尔茨海默病模型大鼠海马区TREM2及Iba1蛋白表达的影响
2019-12-05谭子虎谢文婷王小燕
邱 静,杨 琼,谭子虎,谢文婷,王小燕
(1.湖北中医药大学中医临床学院,湖北 武汉 430061;2.湖北省中医院老年病科,湖北 武汉 430061)
阿尔茨海默病(Alzheimer’s disease AD)是发生于老年和老年前期,以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变[1]。其患病率随年龄增长而逐渐升高[2]。目前AD发病机制尚未阐明,其中β淀粉样蛋白(amoyloid-beta,Aβ)沉积是AD发生发展的关键,也是导致其他病理改变的起始环节。Aβ沉积诱导小胶质细胞(microglial,MG)激活被认为是AD发病的核心病理机制之一。髓细胞触发受体2(triggering receptor expressed on moyeloid cells 2,TREM2)是MG上表达的特异性基因,其R47H位点基因突变可以增加近3倍罹患AD的风险[3]。研究发现,调节TREM2表达水平可以影响MG功能,改善AD病理改变[4]。
AD属于中医“痴呆”“健忘”等范畴,中医认为其病机为“髓减脑消、神机失用”,笔者临证以健脾补肾、化痰祛瘀为法,拟方加减薯蓣丸,取得显著疗效。前期研究显示,加减薯蓣丸可以抑制Aβ沉积,改善痴呆模型大鼠的认知功能,但其是否影响TREM2表达尚未进行相关研究。本实验拟通过加减薯蓣丸干预AD模型大鼠,观察其对AD模型大鼠海马区TREM2和Iba1蛋白表达水平及对Iba1+细胞数量的影响,探讨其改善AD认知功能的可能机制,为临床应用提供更多证据支持。
1 材料
1.1 实验动物 SPF级健康雄性SD大鼠30只,购于湖北省实验动物研究中心,生产许可证号:SCXK(鄂)2015-0018,体质量(200±20)g,饲养于湖北省中医院实验动物中心,通过Morris水迷宫测试筛选出健康大鼠,随机分为正常组、模型组、中药组,每组10只。
1.2 实验药物 加减薯蓣丸:现为湖北省中医院的院内制剂——薯蓣健脾益智合剂,批准文号为鄂药制字Z20150027,由山药、熟地黄、党参、白芍、当归等14味中药组成,由湖北省中医院药材制剂科进行煎煮浓缩提纯制备为口服液250 mL,真空包装,每毫升含原药材1 g。
2 方法
2.1 AD模型大鼠制备
2.1.1 Aβ1-42寡聚体制备 将Aβ1-42粉末加入预冷的200 μL六氟异丙醇(Hexafluoroisopropanol,HFIP),使其最终浓度为1 mmoL/L;轻轻吹打瓶壁,使Aβ粉末充分溶解,在常温下孵育60 min。随后将其放在冰上5~10 min,转移并分装至离心管中,在室温下使HFIP挥发,第2日用真空浓缩离心机使HFIP彻底蒸发,在离心管底可见一层薄膜,将薄膜置于-80 ℃中冻存。需要时再将膜取出,在二甲基亚砜中溶解,使其最终浓度为5 mmol/L;用F12培养基(不含有酚红)进行稀释,4 ℃下孵育24 h;14 000 r/min冰冻离心机离心10 min,最终形成的清液即为Aβ1-42寡聚体。
2.1.2 SD大鼠双侧侧脑室注射Aβ1-42建立AD模型 参照文献[5]制备AD大鼠模型,使用异氟烷对大鼠进行吸入麻醉。将处于麻醉状态的大鼠固定于脑立体定位仪上,将大鼠颅顶正中部皮肤切开以充分暴露颅骨,用H2O2轻轻擦拭清理周围组织,使前囟和中线都充分暴露。在中线旁左侧1.5 mm,用钝性注射器针头轻钻颅骨,用脑定位仪及微量进样器在大鼠左侧侧脑室进行定位(前囟后0.8 mm,中线旁左侧1.5 mm,深度4 mm)。用微量进样器注射针,缓慢注入Aβ1-42 2 μL,注射时间>3 min,留针2 min,并缓慢撤针,防止注射的Aβ1-42从针道溢出。用同样方法进行右侧侧脑室立体定位下注射Aβ1-42。注射完成后清理创口,缝合皮肤,并给予常规抗感染治疗,注意观察大鼠一般情况。模型复制1周后,采用行为学评分筛选模型复制成功大鼠。
2.2 给药方法 各组模型复制成功的大鼠,7 d后开始灌胃:正常组、模型组大鼠每日给予10 mL/kg生理盐水灌胃,参考前期研究文献,加减薯蓣丸10 g/kg对大鼠发挥最佳剂量效应[6],因此中药组大鼠每日给予加减薯蓣丸10 g/kg灌胃,共灌胃4周。
2.3 检测指标及方法
2.3.1 Western blot法检测TREM2、Iba1蛋白表达水平 大鼠腹腔麻醉后直接断头取脑,冰上迅速分离双侧海马,用于指标检测。海马组织匀浆后加入裂解液进行裂解,并对蛋白浓度进行定量;取等量组织加入蛋白变性剂,在100 ℃水中煮10 min使蛋白变性;取50 μg变性后蛋白用15% 蛋白凝胶电泳进行分离,后转移到聚偏二氟乙烯膜上,使用5%脱脂牛奶进行封闭1 h后,孵育一抗(TREM2浓度为1∶100,Iba1及GADPH浓度为1∶1 000)4 ℃过夜;进行洗脱后滴加二抗,37 ℃下孵育2 h,洗脱后进行化学发光液显色、曝光并进行定量分析。晾干胶片,扫描胶片,用BandScan分析胶片灰度值。
2.3.2 免疫荧光染色观察各组海马区MG数量 大鼠腹腔麻醉后,生理盐水灌注心脏。取大鼠海马组织,用4%中性甲醛缓冲液实施固定。梯度乙醇进行脱水,二甲苯透明处理,采用石蜡包埋切片(4 μm)。用二甲苯脱蜡处理,经不同浓度梯度乙醇进行水化处理,然后蒸馏水浸洗。用修复液(0.01 mmol/L枸橼酸缓冲液,pH 6.0)95 ℃孵育10~15 min,放置40 min使其冷却到室温。用山羊血清在常温条件下封闭30 min;在避光的条件下采用标准化荧光素进行标记抗体,并在37 ℃的条件下孵育30 min,并用缓冲液冲洗浸泡处理,每次3 min。封片,并于暗室条件下采用荧光显微镜观察。使用IPP 6.0软件对免疫荧光照片进行光密度分析,每张切片选取3张400倍照片。

3 结果
3.1 各组大鼠海马区TREM2、Iba1蛋白表达水平比较 与正常组比较,模型组TREM2蛋白表达水平显著增加(P<0.05);与模型组比较,中药组TREM2蛋白表达水平显著降低(P<0.05),Iba1蛋白表达水平显著增加(P<0.05)。见图1、图2。
3.2 免疫荧光染色 中药组Iba1+细胞平均光密度值为(0.019 8±0.003 1),模型组平均光密度值为(0.018 7±0.003 1),正常组平均光密度值为(0.015 7±0.003 5),组间比较差异均有统计学意义(P<0.05),与模型组比较,中药组海马区Iba1+细胞数量明显增加(P<0.05)。见图3。

图1Westernblot法检测加减薯蓣丸对AD模型大鼠海马区TREM2及Iba1蛋白表达水平的影响
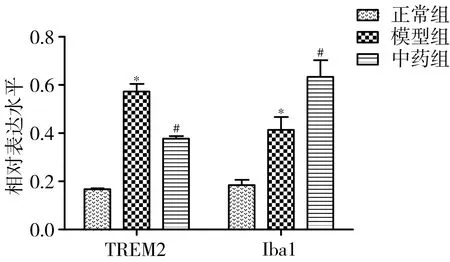
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05
4 讨论
TREM2是在MG上表达的免疫受体,可通过与各种配体结合,如Aβ、载脂蛋白、脂蛋白或阴离子脂质,激活Wnt/β-catenin信号通路促进MG增殖,并通过Akt/GSK3β通路抑制MG凋亡;TREM2可以调节炎症小体的关键成分,以抑制MG增生;TREM2还可以激活PI3K/AKT/mTOR通路,调节MG自噬并维持细胞能量和生物合成代谢,从而促进MG的存活[7]。TREM2作为感受因子探测细胞受损后释放的脂类物质从而进一步引发细胞吞噬作用,TREM2在R47H位点突变会抑制细胞对脂类物质的敏感性,降低MG介导的吞噬作用,从而促进中枢神经系统(central nervous system,CNS)中的炎症反应。TREM2除了上调参与AD调控,下调之后同样可以参与AD调控。本研究发现,加减薯蓣丸可以降低AD模型大鼠海马区TREM2蛋白表达水平。在AD患者及动物模型中本身存在TREM2蛋白的大量表达,这种表达的上调与Aβ区域分布及Aβ含量呈正相关[9]。减少TREM2表达,可以减少Aβ斑块周围相关巨噬细胞的聚集,减少神经炎症因子的表达,同时可以减少Aβ的沉积[10]。6月龄SD大鼠比2月龄大鼠探究行为增多、学习记忆能力增强,其机制与海马区TREM2蛋白水平下降有关[11]。阻断MG上的TREM2信号可以减轻神经炎症,可以在Tau蛋白病变环境中防治神经退行性变[12]。
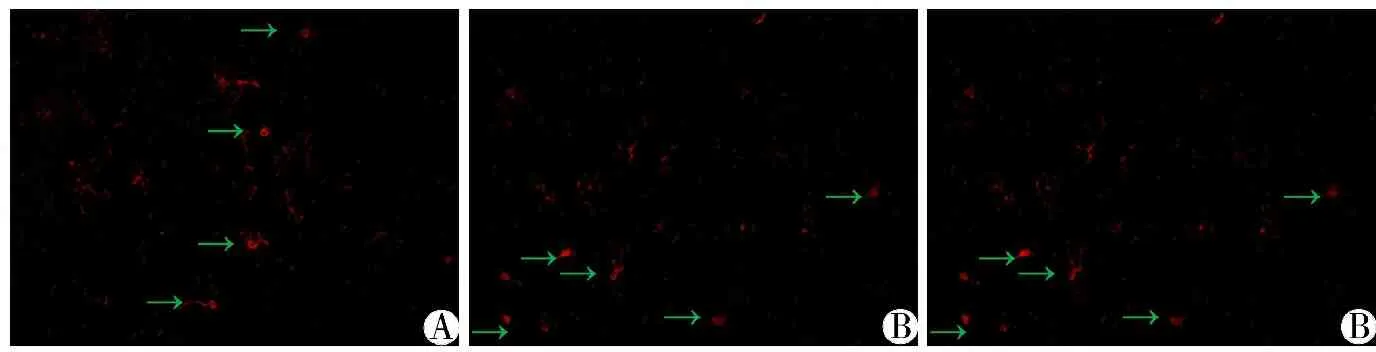
图3免疫荧光染色显示各组大鼠海马区Iba1+细胞(10×40倍,绿色箭头示Iba1+细胞)
MG在CNS的损伤和修复中发挥重要作用,是CNS最重要的免疫防线[13]。MG参与AD发生和发展,Aβ沉积导致的MG激活在发病过程中起着双重作用:Aβ沉积可以诱导MG趋化,使MG向Aβ沉积区域聚集,发挥吞噬作用;而激活MG可以分泌促炎因子和神经毒素,导致神经细胞损伤和死亡[14]。骨髓来源的巨噬细胞具有更强的Aβ吞噬能力,促进骨髓来源巨噬细胞向Aβ沉积区域趋化,增加其吞噬Aβ的能力,同时调节脑内MG的活化状态由致炎的M1型向抗炎的M2型转变,是AD防治的潜在靶点。Iba1是在一个17 kDa的钙结合蛋白,可以同时标记巨噬细胞和MG[16]。在CNS内Iba1是MG特异性标记物[17],但在本研究中,Iba1可能既标记了CNS内的MG,同时也标记了外周来源的巨噬细胞。正常情况下大脑存在完整的血脑屏障,外周巨噬细胞不容易穿过血脑屏障进入脑实质内,但本实验模型复制过程中对大鼠脑结构完整性造成创伤,巨噬细胞通过损伤部位进入到CNS内,导致模型组海马区Iba1的蛋白水平升高,免疫荧光染色显示海马区Iba1+数量明显增多。经加减薯蓣丸干预后,中药组Iba1蛋白水平和Iba1+细胞增加较模型组更多,加减薯蓣丸具有健脾补肾、化痰祛瘀的功效,肾藏精、主骨生髓、通于脑,通过补肾作用促进外周骨髓来源的巨噬细胞向脑内趋化,这与中医“肾生髓充脑”理论具有一定的相似性,同时加减薯蓣丸组方中白芍、当归、川芎等活血化瘀药物可能在其中也起到重要促进作用。
加减薯蓣丸来源于汉代张仲景《金匮要略》中的薯蓣丸,由已故名老中医吕继端教授去其祛风之药,取其补中之效,同时加用补肾填精、化痰开窍药物以切合痴呆脾肾亏虚、痰瘀互结的病机化裁形成,方中山药、熟地黄、制何首乌、杜仲、枸杞子、五味子滋补肝肾、填精益髓;党参、白术、茯苓健脾益气;石菖蒲、远志化痰开窍益智;白芍、当归、川芎活血祛瘀;全方共奏健脾补肾、化痰祛瘀、开窍益智之效。前期临床研究显示加减薯蓣丸可有效改善AD患者的简易智力状态检查量表评分、AD评定量表认知部分评分及中医证候积分[18]。前期动物实验发现加减薯蓣丸可以减少脑低灌注模型Aβ沉积并减少Tau蛋白磷酸化水平[19]。现代药理学研究也证实,加减薯蓣丸方中多种中药及其有效成分可以起到改善AD病理和认知功能的作用。如石菖蒲中有效成分β细辛醚可以通过核因子κB信号通路抑制MG的活化,从而发挥抗炎作用[20]。白芍总苷可以通过抑制MG过度激活及炎症细胞因子的过表达,改善Aβ沉积导致的海马区炎症反应[21]。远志提取物可以通过调节脑源性神经营养因子及其受体酪氨酸受体激酶受体B信号通路促进Aβ降解,改善AD小鼠的学习记忆功能[22];远志总皂苷可通过提高AD模型大鼠海马区nAChRα7的表达,改善AD大鼠的认知功能[23]。山药可以通过增强脑组织ATP酶活性提高机体抗氧化能力,改善痴呆小鼠认知功能[24]。
AD的发病机制存在多种假说,Aβ瀑布学说在其中占据核心地位,Aβ可与MG上多种受体结合,引起多条信号通路激活的级联反应,而这些激活的通路又经过彼此之间的相互作用而影响器官、细胞等最终功能状态。本研究发现,加减薯蓣丸可以降低海马区TREM2蛋白水平表达,同时增加海马区Iba1+细胞数量,推测加减薯蓣丸可能通过减少Aβ介导的神经炎症,同时增加发挥吞噬Aβ作用的外周巨噬细胞数量来发挥改善AD病理的作用。但AD本身发病机制复杂,加减薯蓣丸作用于AD的相关机制仍需要进行深入研究。
