桑黄正丁醇提取物对白念珠菌生物膜形成的抑制作用
2019-12-05汪天明施高翔刘慧敏汪长中
汪天明,邸 磊,施高翔,刘慧敏,汪长中,李 宁
(1.安徽医科大学药学院,安徽 合肥 230032;2.安徽中医药大学中西医结合学院,安徽 合肥 230012;3.安徽中医药大学药学院,安徽 合肥 230012)
白念珠菌(Candidaalbicans)是一种常见的条件致病真菌[1],平时定植于人体的皮肤、口腔、胃肠道及阴道等部位,当机体抵抗力降低或菌群失调时,白念珠菌会过度增殖,引起上述部位的感染[2]。有研究表明,医院内条件性真菌感染中78%~80%是由该菌引起[3]。
在体外,白念珠菌在一定条件下还可附着在植入的医疗设备上,形成能够耐受高浓度抗真菌药物的生物膜。生物膜主要由包埋于其中的菌体及β-葡聚糖和细胞外DNA等组成。生物膜状态的菌体不仅耐药,还能够引起慢性感染。对于白念珠菌生物膜,目前尚无有效的西药进行干预[4]。
中药桑黄(Phellinusigniarius)在临床上具有活血、止血、化瘀、抑菌、止泻之功效[5-7]。课题组前期研究发现,桑黄提取物对白念珠菌具有一定的抑制作用。故本实验拟探讨桑黄正丁醇提取物(butyl alcohol extract ofphellinusigniariusdecoction,BAEP)对白念珠菌主要致病因素之一即生物膜的影响,旨在为其可能用于治疗白念珠菌提供实验依据。
1 材料
1.1 药物与菌株 ①白念珠菌(Candidaalbicans)标准株SC5314:由海军军医大学药学院姜远英教授惠赠。②桑黄:由安徽医科大学药学院李宁教授实验室提供。③BAEP制备:取桑黄子实体粉适量,加8倍70%甲醇回流提取3次,每次2 h,合并滤液,真空回收溶剂,得浓缩物,浓缩物水分散后,依次用10倍容积石油醚、乙酸乙酯、正丁醇萃取5次,真空挥干溶剂,分别得到桑黄石油醚、乙酸乙酯、正丁醇和水4部分提取物。④阳性对照药物为氟康唑(fluconazole,FLZ)(批号 J09M6B1):由上海源叶生物科技有限公司提供。
1.2 试剂及材料 XTT粉(批号 F523BA0012):加拿大BBI公司;荧光素二乙酸酯(fluorescein diacetate,FDA)(批号 F16551):上海翊圣科技有限公司;25%戊二醛(批号 0715A19)、PBS(批号 0428A16):雷根生物技术有限公司;ALS1、HWP1引物:上海生工生物工程有限公司;Total RNA提取试剂(批号 742100)、PCR反应试剂(批号 841200):日本ToyoBo公司;DEPC处理水、Zemolyase酶(批号 SLBP5261V):金克隆(北京)生物技术有限公司;无水乙醇(批号 20190710JN):天津市大茂化学试剂厂;琼脂糖(批号 182195):上海沪试分析仪器有限公司;TAE(批号 690674223):上海联迈生物工程有限公司;RPMI 1640(批号 2023235):美国Life technologies;沙氏培养基(批号 20190425):青岛高科技海博生物科技有限公司。
1.3 实验仪器 电热恒温培养箱:上海一恒科技有限公司;血细胞计数板:上海求精生化试剂仪器有限公司;CKX41-32型倒置显微镜:日本Olympus公司;DMI60000B倒置荧光显微镜:德国徕卡光学仪器公司;Regulus 8100冷场发射式扫描电镜:日本日立公司;K3型酶标仪:赛默飞世尔科技公司;ABI 7500荧光定量PCR仪:美国应用生物系统公司。
2 方法
2.1 菌液配制 按文献[8]方法配制菌液。从4 ℃保存的沙氏琼脂平板上挑取白念珠菌单菌落,接种至液体沙氏培养液,37 ℃恒温过夜培养,血细胞计数板计数,RPMI 1640(pH 7.0)培养液稀释集落形成单位(colony forming unit, CFU)至2×106/mL,备用。
2.2 BAEP对白念珠菌的最低抑菌浓度(minimal inhibitory concentration,MIC)及抑制50%生物膜的最低抑制浓度(sessile minimal inhibitory concentration,SMIC50)的测定 按照文献[8]方法,取100 μL菌液(CFU 2×103/mL)与100 μL终浓度分别为32、64、128、256、512、1 024 μg/mL BAEP及0.5、1、2 μg/mL FLZ于96孔板中混合,另设不含药物的阴性对照孔,于37 ℃培养48 h后,以肉眼观察不到菌落的最低药物稀释度为MIC,实验平行重复3次。
取CFU为2×106/mL的菌液100 μL,与100 μL终浓度分别为32、64、128、256、512、1 024 μg/mL BAEP及64、128、256 μg/mL FLZ于96孔板中混合,另设不含药物的阴性对照孔,37 ℃培养24 h后,每孔中加入50 μL XTT-维生素K3溶液,避光孵育2 h。使用多功能酶标仪检测492 nm处各孔的吸光度(optical density, OD)值。与空白组比较,以OD值降低50%的药物浓度为SMIC50。SMIC50的测定实验独立重复3次。
2.3 固体培养基上观察BAEP对白念珠菌菌落形态的影响 按文献[9]方法配制沙氏固体培养基,加入终浓度为256、512、1 024 μg/mL的BAEP,另设不含药物的空白对照组。用倍比稀释法将白念珠菌悬液中CFU稀释至20/mL,取100 μL于固体培养基上,用稀释涂布法涂布均匀。37 ℃培养6 d后,以数码相机拍摄菌落形态。
2.4 倒置显微镜下观察白念珠菌酵母生物膜形态 取CFU为2×106/mL的菌液1 mL,与1 mL终浓度分别为256、512、1 024 μg/mL BAEP及64 μg/mL FLZ于6孔板中混合,另设不含药物的阴性对照孔,37 ℃培养24 h后,以倒置显微镜拍摄生物膜形态[8]。
2.5 荧光显微镜下观察白念珠菌生物膜活性 取CFU为2×106/mL的菌液1 mL,与1 mL终浓度分别为256、512、1 024 μg/mL BAEP及64 μg/mL FLZ于6孔板中混合,另设不含药物的阴性对照孔,37 ℃培养24 h后,吸弃上清液,之后加入100 μg/mL的FDA荧光染料溶液,避光37 ℃染色30 min,以荧光显微镜拍摄生物膜形态。
2.6 扫描电镜下观察白念珠菌生物膜形态结构 取CFU为 2×106/mL菌液2 mL与2 mL终浓度分别为256、512、1 024 μg/mL BAEP及64 μg/mL FLZ混合置于6孔板,另设不含药物的阴性对照孔,分别放入经高温灭菌处理的硅橡胶导管,恒温37 ℃培养24 h后,将导管取出,置2.5%戊二醛中,避光4 ℃放置2 h,依次置于35%、50%、75%、95%、100%乙醇逐级脱水各10 min,经室温过夜干燥后,经HVS-GB型真空蒸镀仪喷金,用扫描电镜观察拍照。
2.7 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测白念珠菌生物膜特异性基因的转录水平 ①RNA的提取及逆转录:CFU为2×106/mL的菌液2 mL与2 mL终浓度分别为1 024、512、256 μg/mL BAEP混合,37 ℃共培养24 h后,离心,收集菌体,用无菌PBS洗2次后进行RNA的提取(参照MagExtractor-RNA试剂盒说明书操作)。②引物的设计与合成:委托上海生工合成引物。ACT1的正向引物(5′→3′)为GCTGAACGTATGCAAAAGGAA,反向引物(3′→5′)为TGTGGTGAACAATGGATGGA;ALS1的正向引物为CACCAAACTACACGGTTAC,反向引物为ATAATGAGGACGGGAAAA;HWP1的正向引物为TGACTATCCACAACAGCCACAAGAAC,反向引物为GTCACAAGGAACACTAGGTTGAGGAG。③实时荧光定量PCR反应:采用SYBR Green Realtime PCR Master Mix试剂盒,配制PCR反应体系25 μL,反应在ABI7 500荧光定量PCR仪器上进行,实时荧光定量PCR分析分别测定目的基因ALS1、HWP1和内参基因ACT1的Ct值,实验平行重复3次,结果取其平均值。采用2-ΔΔCt法[10]检测基因转录水平。

3 结果
3.1 BAEP对白念珠菌SC5314的MIC和SMIC50BAEP对白念珠菌菌落吸光度有明显影响,并且随BAEP浓度升高,白念珠菌菌落OD明显降低;BAEP对白念珠菌SC5314的MIC是1 024 μg/mL,1 024 μg/mL BAEP对白念珠菌生物膜的抑制率可达60%以上,128、256、512 μg/mL BAEP抑制生物膜效果明显。
3.2 BAEP对白念珠菌在固体培养基上菌落形态的影响 观察固体培养基上菌落形态发现,空白对照组菌落出现大量褶皱,边缘不光滑,256 μg/mL BAEP组出现大量褶皱,边缘不光滑,边缘不光滑程度小于空白对照组;512 μg/mL BAEP组表面出现少量褶皱,边缘略光滑,1 024 μg/mL组表面光滑,边缘光滑。见图1。

注:A.空白对照组;B. 256 μg/mL BAEP组;C. 512 μg/mL BAEP组;D. 1 024 μg/mL BAEP组
图1各组白念珠菌在固体培养基上的菌落形态
(上行图片:1倍大小;下行图片:倒置显微镜下观察,10×40倍)
3.3 倒置显微镜下BAEP对白念珠菌生物膜形态的影响 倒置显微镜下发现,空白对照组出现大量菌丝,FLZ组未发现明显菌丝,256 μg/mL BAEP组菌丝数量较阴性对照组有所减少,512 μg/mL BAEP组更进一步减少,1 024 μg/mL BAEP组不仅菌丝数量明显减少,且长度也明显缩短。见图2。
3.4 荧光显微镜下BAEP对白念珠菌生物膜活性的影响 经FDA染色,荧光显微镜下发现,空白对照组因真菌活力最高,荧光最强;FLZ组荧光强度最弱;256、512、1 024 μg/mL BAEP组白念珠菌的活性、荧光强度随药物浓度递增而减弱。见图3。
3.5 扫描电镜下BAEP对白念珠菌生物膜形态的影响 扫描电镜结果显示,空白对照组的白念珠菌生物膜由密集的纵横交错的菌丝构成,256 μg/mL BAEP对白念珠菌生物膜的抑制效果并不明显,512 μg/mL BAEP有一定抑制作用,1 024 μg/mL BAEP对白念珠菌生物膜有明显的抑制作用,未见构成生物膜的主要组分即菌丝。见图4。
3.6 BAEP对白念珠菌生物膜相关基因表达的影响 256 μg/mL HAEP显著下调HWP1基因的表达水平(P<0.05),显著上调ALS1基因的表达水平(P<0.05),而512 μg/mL HAEP对ALS1和HWP1基因的表达水平无显著影响(P>0.05)。见表1。

表1 BAEP对白念珠菌生物膜ALS1、
注:与空白对照组比较,*P<0.05;与FLZ组比较,#P<0.05;与256 μg/mL BAEP组比较,△P<0.05
4 讨论
近年来,随着广谱抗生素、糖皮质激素和免疫制剂的广泛使用,外科介入疗法的不断增多,免疫功能低下患者不断增多,真菌尤其是深部真菌感染的发生率日渐增高,其中以白念珠菌的感染最为常见[12]。
在自然界以及人体中,白念珠菌往往以生物膜状态形式存在。不同于单个的浮游菌体,生物膜是菌体不可逆地粘附在无活力物体或活组织表面形成的一个由自身产生的细胞外基质包裹菌体集群体[13]。白念珠菌生物膜主要由大量菌丝及其分泌的基质所组成,生物膜对所包裹的菌体形成一种保护,使其对临床上目前所用的抗真菌药物高度耐受[14]。因此,近年来针对白念珠菌生物膜状态的药物研发成为药学和真菌学领域的研究热点。现有的抗真菌西药不仅研发周期长,且对人体的毒性和不良反应也较大,故而从中药中筛选发现抗生物膜活性的药物成为一个重要渠道。本课题组前期研究表明,中药及其有效成分具有良好的抑制白念珠菌作用[15-16]。
已有研究表明,中药桑黄具有抗肿瘤、调节免疫、抗肝纤维化、抗氧化、降血糖、消炎抗菌等药理作用[17]。本实验采用XTT还原法测试BAEP对白念珠菌生物膜形成能力,结果发现,1 024 μg/mL的BAEP可以抑制白念珠菌60%生物膜形成能力。在固体培养基上,对照组菌落边缘不光滑,大量褶皱,512 μg/mL BAEP组菌落有少量褶皱,边缘略光滑;1 024 μg/mL BAEP组菌落表面光滑,边缘光滑。这说明BAEP对白念珠菌生物膜的形成有一定的抑制作用。

注:A.空白对照组;B.FLZ组;C.256 μg/mL BAEP组;D.512 μg/mL BAEP组;E.1 024 μg/mL BAEP组

注:A. 空白对照组;B. FLZ组;C.256 μg/mL BAEP组;D.512 μg/mL BAEP组;E.1 024 μg/mL BAEP组
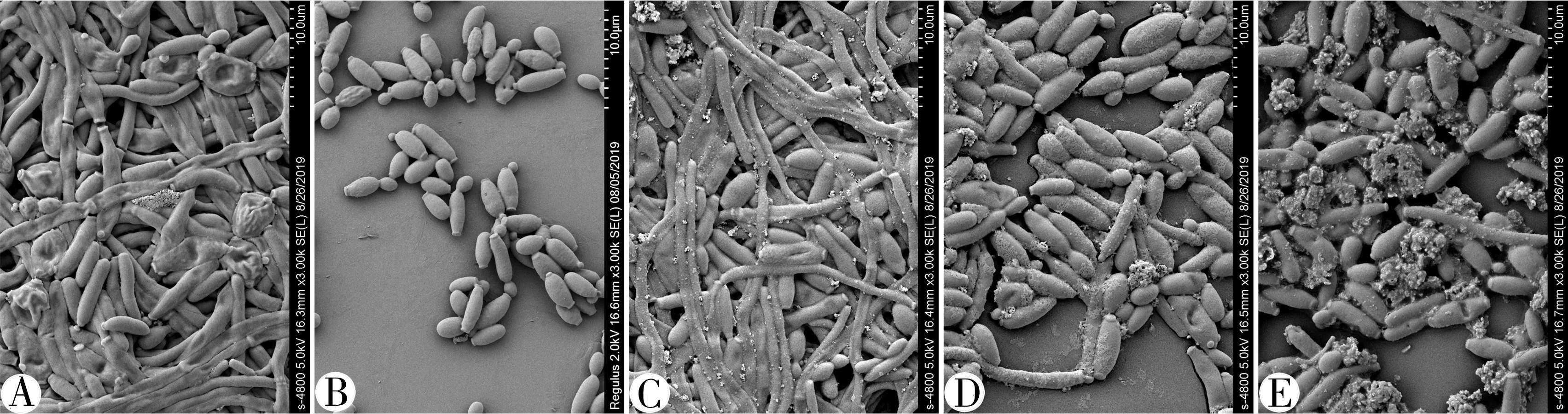
注:A. 空白对照组;B.FLZ组;C.256 μg/mL BAEP组;D.512 μg/mL BAEP组;E.1 024 μg/mL BAEP组
倒置显微镜下观察到空白对照组生物膜较厚,菌丝密集;256、512 μg/mL BAEP组生物膜较厚,但小于空白对照组;1 024 μg/mL BAEP组菌丝较少且长度也明显缩短,生物膜不明显。结果说明BAEP对白念珠菌生物膜的形成有一定的抑制作用。
FDA是一种用于细胞活力测定的荧光载体。只能染活细胞,且细胞活力越强,荧光强度越强[18]。在本实验中,不同浓度的BAEP作用后的生物膜经FDA染色后,发现空白对照组的荧光强度最高,并且随着BAEP浓度递增,荧光强度逐渐减弱。这说明在BAEP 的作用下白念珠菌活力减退,故被FDA染色后荧光强度较弱。
扫描电镜结果显示,1 024 μg/mL BAEP对白念珠菌生物膜有明显的抑制作用,主要表现在抑制其菌丝的形成。
白念珠菌生物膜形成受相应的基因调控。HWP1与ALS1是已经发现的参与白念珠菌生物膜形成的基因。qRT-PCR检测结果发现,BAEP明显降低HWP1的表达水平,但同时上调ALS1的表达水平。这可能是白念珠菌受到环境压迫(本研究中的药物BAEP)时采取的一种本能性的代偿反应。
本研究表明,BAEP对白念珠菌生物膜具有一定的抑制作用,抗菌效果明确,但其抗菌的有效组分以及详细的作用机制尤其是体内的抗真菌作用尚有待于进一步深入研究,这将为拓宽桑黄潜在的临床用途提供一定的科学依据。
