Cofilin-1与肝癌细胞迁移侵袭能力的相关性研究
2019-12-05
(1.湘潭市第一人民医院病理科,湖南 湘潭 411010;2.湖南环境生物职业技术学院,湖南 衡阳 421001)
我国肝癌发病率排第4位,死亡率排第3,每年的新增病例约36.6万,死亡病例大约32.1万[1]。最常见肝癌的组织类型是肝细胞癌,大约占原发性肝癌的90%[2]。目前治愈肝细胞癌的主要挑战是肝细胞癌易转移,且分子机制尚未完全明确[3]。
研究发现上皮生长因子受体(EGFR)可以促进肝癌细胞(Huh-7细胞)的迁移、侵袭。课题组前期研究在Huh-7细胞中发现上皮生长因子受体突变体Ⅲ(EGFRvⅢ)。将EGFR和EGFRvⅢ分别转染至Huh-7细胞中,构建了转染上皮生长因子受体的人肝癌细胞(Huh-7-EGFR细胞)与转染上皮生长因子受体突变体Ⅲ的人肝癌细胞(Huh-7-EGFRvⅢ细胞)。研究证明Huh-7-EGFR细胞的迁移、侵袭的能力强于Huh-7细胞;而 Huh-7-EGFRvⅢ细胞的迁移、侵袭的能力强于Huh-7-EGFR细胞[4];从而证实EGFR vⅢ促进肝癌细胞的迁移、侵袭的能力强于EGFR。
在运用比较蛋白质组学方法对比分析Huh-7-EGFR细胞与Huh-7-EGFRvⅢ细胞这两种细胞的差异表达蛋白中,发现丝切蛋白1(Cofilin-1)在Huh-7-EGFRvⅢ细胞中的表达显著高于在Huh-7-EGFR细胞中的表达[5]。因Huh-7-EGFRvⅢ细胞的迁移、侵袭能力强于Huh-7细胞和Huh-7-EGFR细胞,并且Huh-7-EGFRvⅢ细胞中的Cofilin-1表达显著高于Huh-7-EGFR细胞和Huh-7细胞,所以推测Cofilin-1与肝癌细胞的迁移与侵袭能力可能有关。
1 材料与方法
1.1 细胞培养
293T细胞购自中国科学院上海生化细胞所,其来源是转染腺病毒E1A基因用生化的人肾上皮细胞(293细胞);Huh-7细胞是人肝癌细胞;本实验室前期构建Huh-7-EGFR,Huh-7-EGFRvⅢ细胞。用含10%胎牛血清的DMEM培养液培养细胞,放置于37 ℃,含5%CO2的培养箱中。待细胞生长密度80%~90%时,进行蛋白样品提取后存于-80 ℃待用。
1.2 免疫印迹试验(Western-blot)
用BCA测定试剂盒(Pierce 公司)测提取好的蛋白的蛋白浓度,并按说明书绘制标准曲线。剩余蛋白加入总体积1/5的5×SDS凝胶上样缓冲液混匀后,放置于100 ℃沸水中,5 min使蛋白变性。按标准曲线公式计算蛋白含量,明确上样蛋白量。用12%的SDS-PAGE分离胶,5%的浓缩胶,电泳,并将其转移至PVDF膜上,然后用PBST配制5%脱脂奶粉,室温封闭2 h。孵育一抗并于4 ℃过夜。PVDF膜用0.5%PBST洗3次,10 min/次。再在室温下孵育二抗1 h。重复洗膜3次,10 min/次。最后ECL化学发光检测并显影。
1.3 构建过表达Cofilin-1的Huh-7细胞系
慢病毒表达载体质粒构建方法见本课题组前期研究[6],构建的质粒送上海美吉生物医药科技有限公司测序并鉴定。
1.4 沉默Huh-7-EGFRvⅢ细胞中的Cofilin-1
1.4.1 干扰小RNA工作母液的配制及重退火 加入125 μL 1×通用缓冲液于2.5 nmol的双链siRNA中,得到浓度为20 μmol的siRNA母液,将工作母液放于90 ℃,2 min,待自然冷却至室温后于4 ℃过夜备用。
1.4.2 干扰小RNA的转染 在转染的前一天,于无菌6孔培养板中将细胞传代,培养24 h,直至细胞融合率达40%~50%。每个孔取一无菌的eppendoff管将6 μL 20 μmol的siRNA双链与100 μL无血清DMEM混合。取摇匀后的LipofectamineTM2000 (1 μg/μL)3 μL 置于另一无菌eppendorf管中与100 μL无血清DMEM混合,室温孵育5 min。混合两管液体,室温静置20 min形成siRNA.Lipofectamine 复合物。弃去细胞培养旧液,加1 mL含10%FCS的DMEM,再加入已配制的转染混合物200 μL,转染终浓度为100 nmol/L。于37 ℃,5%CO2的细胞孵箱中孵育转染48 h后,收集细胞进行细胞生物学功能实验的检测。
1.5 体外细胞迁移和侵袭实验
细胞迁移实验:取对数生长期细胞,用含0.1%BSA的无血清培养基将细胞制成5×105个/mL的悬液。将Transwell小室放入在每孔加入500 μL含有10%胎牛血清的DMEM培养基的24孔培养板中。每个小室内加细胞悬液200 μL后,盖好培养板,置于5%CO2、37 ℃培养箱中孵育。8 h后取出Transwell小室,吸走小室内液体,加500 μL 4%多聚甲醛室温固定,1 h后去除小室内液体,并用0.1%结晶紫染色30 min。在倒置显微镜下观察细胞数,并在高倍镜下随机取5个视野,拍照,计数穿膜细胞数并取平均值。穿膜细胞数的相对数代表迁移力。细胞侵袭实验:将存放于-20 ℃冰箱的BD Matrigel于4 ℃ 过夜融解,将液态的Matrigel用4 ℃无血清培养基稀释(稀释比例为1∶8)。将Transwell小室放入24孔培养板中,均匀铺好100 μL稀释后的Matrigel后,置于含5% CO2的37 ℃培养箱中孵育4 h,形成均匀薄层凝胶后,用无血清DMEM培养基清洗凝胶2遍,在Transwell小室内加入密度为2.5×106个/mL 的细胞悬液200 μL,盖好培养板并放入含5%CO2的37 ℃ 培养箱中孵育14 h。余下的实验方法同迁移实验。
1.6 统计学处理
实验均重复三次,数据以均数±标准差表示,运用SPSS13.0统计学软件采用成组设计的两样本均数比较(两样本t检验),P<0.05为差异有显著性。
2 结 果
2.1 Cofilin-1在Huh-7和Huh-7-EGFR 和Huh-7-EGFRvⅢ三种细胞中的表达
通过Western-blot方法检测Cofilin-1在Huh-7、Huh-7-EGFR 和 Huh-7-EGFRvⅢ中的表达情况,通过灰度值进行半定量分析,结果如图1所示:Cofilin-1在Huh-7-EGFRvⅢ细胞中的表达水平明显高于Huh-7和Huh-7-EGFR细胞(P<0.05)。

图1 Coflin-1蛋白表达A:Western-blot方法检测Cofilin-1;B:灰度值对比的百分值的统计图与Huh-7和Huh-7-EGFR比较,*P<0.05
2.2 构建转染丝切蛋白1的人肝癌细胞(Huh-7-Cofilin-1细胞)
通过实时定量PCR(RT-PCR)扩增Cofilin-1后,得到Cofilin-1 的编码序列531 bp,如图2A所示。鉴定pWPT-Cofilin-1与慢病毒载体质粒(pWPT-GFP)酶切,结果显示其大小,位置正确,如图2B所示。测序的结果和GenBank中的标准序列进行 Blast 比对,显示一致,测序结果见图2C。慢病毒包装系统共转染293T细胞48 h后,用荧光显微镜观察,显示慢病毒包装成功(可见明显绿色荧光,共转染细胞已停止生长)。Huh-7细胞感染慢病毒48 h后,GFP阳性率大于95%,结果如图2D。为了进一步验证转染Cofilin-1后Huh-7细胞(Huh-7-Cofilin-1细胞)构建是否成功,通过RT-qPCR方法检测Huh-7-Cofilin-1细胞中Cofilin-1mRNA的表达情况,结果显示Cofilin-1在Huh-7-Cofilin-1细胞中的mRNA水平明显高于加入空转染试剂的Huh-7细胞(Huh-7-GFP细胞,阴性对照组)和未加任何试剂的Huh-7细胞(空白对照组),见图2E。WB结果与RT-qPCR的结果显示一致,见图2F。
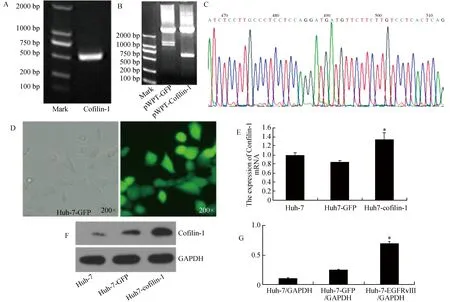
图2 构建过表达Cofilin-1的Huh-7细胞系结果图A:经RT-PCR扩增后,Cofilin-1的产物电泳图,编码序列为531bp;B:pWPT-Cofilin-1和pWPT-GFP酶切之后的电泳图;C:测序结果图;D:慢病毒包装和感染后的细胞的显微镜和荧光显微镜展示图;E:RT-qPCR检测Cofilin-1mRNA在Huh-7-Cofilin-1细胞中的表达情况;F:WB验证Cofilin-1蛋白在Huh-7-Cofilin-1细胞中的表达情况 ;G:为F图的统计图.与Huh-7和Huh-7-EGFR比较,*P<0.05
2.3 转染Cofilin-1后,Huh-7-Cofilin-1细胞的迁移、侵袭能力检测
运用Transwell/Matrigel实验分别检测转染Cofilin-1后Huh-7细胞(即Huh-7-Cofilin-1细胞)、加入空转染试剂的Huh-7细胞(Huh-7-GFP细胞,阴性对照组)和未加任何试剂的Huh-7细胞(空白对照组)的迁移、侵袭能力。结果如图3A,3B所示:Huh-7-Cofilin-1细胞的侵袭能力强于Huh-7-GFP细胞(P=0.001)和Huh-7细胞(P=0.003),差异具有统计学意义(P<0.05),空白对照组与阴性对照组之间无差异(P=0.437);Huh-7-Cofilin-1细胞的迁移能力强于Huh-7-GFP细胞(P=0.004)和Huh-7细胞(P=0.004),差异具有统计学意义(P<0.05),空白对照组与阴性对照组之间差异无显著性(P=0.682)。
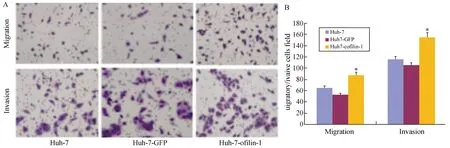
图3 Huh-7-Cofilin-1迁移、侵袭能力检测结果图A:Huh-7、Huh-7-GFP、Huh-7-Cofilin-1细胞在显微镜下的观察结果图,染成紫色的穿膜细胞数的相对数代表迁移力;B:为A图的统计图与Huh-7和Huh-7-GFP比较,*P<0.05
2.4 沉默Huh-7-EGFRvⅢ细胞中的Cofilin-1
干扰6 h后,观察FAM荧光图,效果达90%以上,见图4A。沉默Cofilin-1的Huh-7-EGFRvⅢ细胞(siCofilin-1Huh-7-EGFRvⅢ)中Cofilin-1的mRNA量显著低于阴性对照组(加入无干扰小RNA转染液的Huh-7-EGFRvⅢ细胞)(P<0.05)和空白组(未加任何试剂的Huh-7-EGFRvⅢ细胞)(P<0.05);而阴性对照组与空白组Huh-7-EGFRvⅢ细胞中 Cofilin-1的mRNA量无明显差异,见图4B:siCofilin-1Huh-7-EGFRvⅢ中Cofilin-1的蛋白量显著低于阴性对照组(P<0.05)和空白组(P<0.05),而阴性对照组与空白组Huh-7-EGFRvⅢ细胞中 Cofilin-1的蛋白量无明显差异,见图4C。
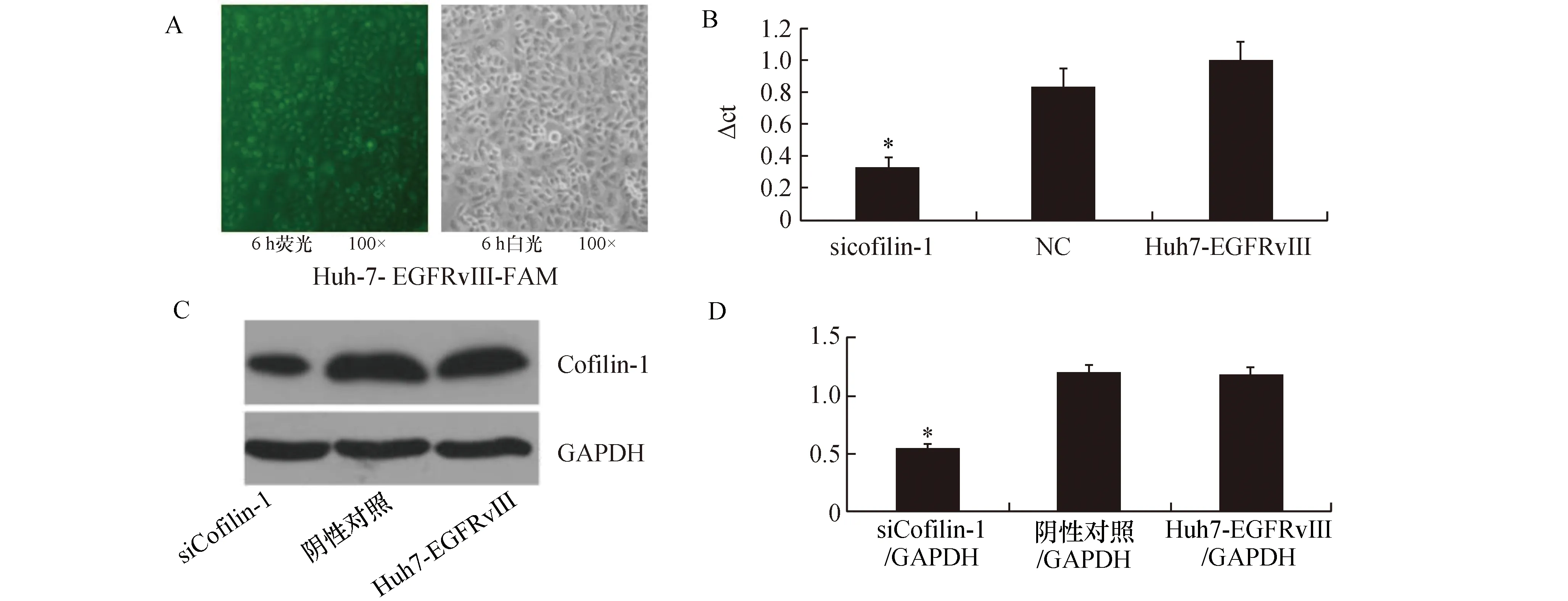
图4 干扰Huh-7-EGFRvⅢ细胞中的Cofilin-1的验证A:进行干扰6 h后的FAM的荧光图与白光图的对照;B:通过Real-time quantitative PCR检测siCofilin-1Huh-7-EGFRvⅢ中Cofilin-1的mRNA的表达.与NC和Huh-7-EGFRvⅢ比较,*P<0.05;C:Western-blot检测siCofilin-1Huh-7-EGFRvⅢ中 Cofilin-1的蛋白的表达情况 ;D:为C图的统计图.与阴性对照组和Huh-7-EGFRvⅢ比较,*P<0.05
2.5 干扰Cofilin-1后Huh-7-EGFRvⅢ细胞的迁移与侵袭能力检测
为了反向证实Cofilin-1可以促进肝癌细胞的迁移与侵袭,运用Transwell/Matrigel实验检测siCofilin-1 Huh-7-EGFRvⅢ细胞、阴性对照组(NC组)和空白对照组的迁移与侵袭能力,结果如图5A,5B所示:siCofilin-1Huh-7-EGFRvⅢ组的细胞侵袭能力明显低于阴性对照组(NC组)(P=0.011)和空白对照组(P=0.010),差异具有统计学意义(P<0.05),空白对照组与阴性对照组之间无差异(P=0.396);siCofilin-1Huh-7-EGFRvⅢ组的细胞迁移能力明显低于阴性对照组(NC组)(P=0.000)和空白对照组(P= 0.000),差异具有统计学意义(P<0.05),空白对照组与阴性对照组之间无差异(P=0.421)。
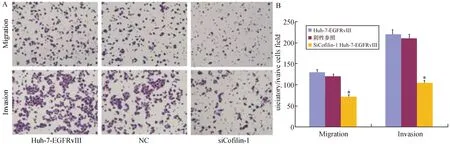
图5 SiCofilin-1 Huh-7-EGFRvⅢ细胞的迁移与侵袭能力检测结果图A:镜下观察并拍摄的干扰Cofilin-1后Huh-7-EGFRvⅢ细胞迁移、侵袭能力与阴性对照组及空白组的对比图,穿膜细胞数代表相对迁移、侵袭力;B:为A图的统计图.与阴性对照组和Huh-7-EGFRvⅢ比较,*P<0.05
3 讨 论
Cofilin-1是一种细胞骨架蛋白,基因定位于11q13,分子量为19 kDa,属于肌动蛋白解聚因子家族,可维持成熟的细胞结构。Cofilin-1可以结合和解聚F-actin,也可以抑制G-actin的聚合,还能增强肌动蛋白丝的转换,进而对细胞运动起重要的调控作用。Cofilin-1在肺腺癌[7],胰腺癌[8],卵巢癌[9],膀胱癌[10],恶性黑色素瘤[11],子宫内膜癌[12]等组织中存在高表达,且与肿瘤细胞的生长,迁移侵袭及耐药密切相关,下调Cofilin-1的表达水平可以抑制细胞增生,迁移,粘附以及克隆形成能力等[13]。在晚期的肺癌患者的血浆中,它被发现是一个很好的肿瘤生物标志物[7]。肺癌患者痰液中Cofilin-1水平显著提高,可能成为肺癌诊断的潜在生物标志物[7]。cofilin-1作为转化生长因子的效应器,它在癌症恶化过程中提高了其迁移侵袭能力,与不同程度的恶性肿瘤细胞的迁移侵袭能力存在相关性。Cofilin-1被包含在各种人类恶性细胞中,并与恶性肿瘤的形成、迁移、侵袭、转移和对化疗药物的耐药性等方面有关联[14]。
课题组前期研究,将EGFR和EGFRvⅢ分别转染至Huh-7细胞中,构建了Huh-7-EGFR细胞与Huh-7-EGFRvⅢ细胞。研究证明Huh-7-EGFRⅢ细胞的迁移、侵袭的能力强于Huh-7细胞和Huh-7-EGFR细胞。本文结果显示在迁移、侵袭能力较强的Huh-7-EGFRvⅢ细胞中Cofilin-1的表达显著高于Huh-7和Huh-7-EGFR细胞中的表达,提示Cofilin-1与肝癌细胞的迁移和侵袭性能之间可能存在相关性。为了证实Cofilin-1与肝癌细胞的迁移和侵袭性能之间的关系,将Cofilin-1导入迁移和侵袭能力最弱的Huh-7细胞后,检测到Huh-7-Cofilin-1的侵袭、迁移能力强于阴性对照组和空白对照组。因此从正面证明Cofilin-1可以增强肝癌细胞的迁移和侵袭能力。而沉默掉迁移和侵袭能力较强的Huh-7-EGFRvⅢ细胞中的Cofilin-1后,细胞的迁移,侵袭能力明显减弱,进而从反面证实了Cofilin-1可以促肝癌细胞的迁移与侵袭。此研究为进一步研究肝癌细胞迁移、侵袭的分子机制提供新的标志物,但其Cofilin-1促肝癌细胞的迁移与侵袭的分子机制还有待研究。
