大鼠触须毛囊上段再生的体外培养
2019-12-05周玲聪杨2廖俊琳
周玲聪,邓 杨2#,陈 碾*,廖俊琳,曾 丽
(1.南华大学附属第一医院美容整形外科,湖南 衡阳 421001;2.常德湘雅医院整形美容科,湖南 常德 415000)
近年来,随着工作压力、环境改变和遗传等因素的变化,脱发特别是雄激素性脱发的患者日渐增多。目前,对于脱发的治疗有很多种方法,临床上常用一些外用药物和口服药物治疗脱发,但是其临床效果欠佳,特别是对已脱发区域不能长出新的毛囊及毛发,且药物的长期使用具有一定副作用。而对于治疗毛发缺损的区域的主要方法是自体毛发移植术。毛发移植技术都是涉及重新分配病人现有的头发。因为自体毛发数量是有限的,毛发移植过程中总数量并没有发生变化,所以毛囊再生及其机制的研究成为目前迫切需要解决的问题。本实验拟通过构建毛囊上段体外再生模型,为毛囊切割后再生研究提供一个良好的实验平台。通过对毛囊上段再生的深入研究,揭示毛囊上段再生的机制,提高毛囊上段移植成活率,从而达到“毛囊数量倍增”,对于解决临床毛发移植术中毛囊供体不足或其他器官移植问题都有非常大的意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周SD雄性大鼠20只由长沙天勤公司提供,体重250~400 g,昼夜节律规律,室温为(22 ± 2)℃,自由进食和取水。适应环境1周。
1.1.2 主要试剂与仪器 MEM培养液(minimum Eagle’s medium)、Williams E培养液(wilLiam’s medium)、胎牛血清(fetal calf serum,FCS)(Gibco,美国),表皮生长因子(Epidermal growth factor,EGF)、胰岛素生长因子1(insulin-like growth factor 1,IGF-1)、双氢睾酮(Dihydrotestosterone,DHT)(甄准生物,上海),青链霉素(碧云天生物,上海),一抗α-SMA兔抗小鼠多克隆抗体(alpha smooth muscle actin,α-SMA)(Abcam 公司),超净工作台,CO2培养箱,倒置荧光显微镜(Nikon,日本)。
1.2 方法
1.2.1 培养液配置(总量50 mL)Ⅰ号培养液:无血清Williams E培养液50 mL;Ⅱ号培养液:MEM培养液47.50 mL+2.50 mL胎牛血清;Ⅲ号培养液:无血清Williams E培养液49.85 mL+100 μL EGF+50 μL IGF-1;Ⅳ号培养液:MEM培养液47.35 mL+2.50 mL胎牛血清+100 μL EGF+50 μL IGF-1;Ⅴ号培养液:无血清Williams E培养液35.33 mL+100 μL EGF+50 μL IGF-1+14.52 mL DHT;Ⅵ号培养液:MEM培养液32.83 mL+2.50 mL胎牛血清+100 μL EGF+50 μL IGF-1+14.52 mL DHT。50 mLⅠ号~Ⅵ号培养液中均加入0.5 mL青/链霉素混合液,封口膜包裹,标记,4 ℃冰箱冷冻保存。
1.2.2 毛囊上段组织模型构建 SD大鼠予以水合氯醛腹腔麻醉满意后,断颈处死。将大鼠放入装有75%酒精的烧杯中消毒,移至超净工作台上的托盘中,沿着毛囊平行走向将大鼠的触须部嘴唇组织切成细条状,用显微器械分离得到单个生长期毛囊组织,去除毛囊周围组织(包括脂肪组织及其他真皮组织),注意避免损伤到毛囊。紧贴毛球部上方用刀片将其横向切除,并拔除毛囊的毛发,最终得到大鼠触须毛囊上段标本。取6个培养皿,分别加入6种不同培养液,将得到的大鼠触须毛囊上段随机分成6组放入其中;装入96孔培养板中,标记,再每孔分别加入Ⅰ号~Ⅵ号培养液2 mL,放入37 ℃,5%CO2细胞培养箱进行培养,隔天换液,培养2周并观察。
1.2.3 主要检测指标 在光学显微镜下观察其生长情况,并统计毛囊再生个数。相关标本制备石蜡切片,HE染色,显微镜下观察。标本酶标免疫组化检测,观察α-SMA在毛囊新生组织中的表达情况。
1.3 统计分析
采用SPSS20.0统计软件进行统计学分析。统计学方法采用多个样本率的卡方检验及各实验组与同一个对照组的比较,分析各实验组与对照组的再生率差异是否有统计学意义。由于样本量不足,即期望计数小于5,采取Fisher精确检验,以检验水准P′<0.005为差异具有统计学意义。
2 结 果
2.1 毛囊上段大体形态结构
将生长期的单个毛囊组织去除周围脂肪组织及其他真皮组织,镊子轻轻夹住毛囊上端并挤压,可见红色的含毛乳头的毛球部突出于胶原外壳(图1A),紧贴毛球部上方用刀片将其横向切除,下端的切缘平整光滑(图1B)。拔除毛囊上段的毛发后,可见毛囊含有两根毛发,粗长的是杵状毛,细短的为毛干(图1C)。观察得到的毛囊上段组织,可见其组织稍微软化,但形态完好,下端切缘平整。
2.2 再生毛囊上段倒置显微镜下形态结构
6组不同培养液中的大鼠触须毛囊上段组织在37 ℃,5%CO2培养箱中连续培养,隔日换液,并在倒置显微镜下观察毛囊上段大体结构,未再生的毛囊上段组织下端在倒置显微镜下观察可见切缘光滑平整(图2A-B),具有再生状态的毛囊上段组织可见切缘不再平整,并向外凸出,切断痕迹并不明显(图2C-D)。
2.3 毛囊上段与再生毛囊上段组织HE染色
毛囊上段组织底部的切缘平整,虚线所示的为毛囊底部切除的部位,该部位紧贴毛球部上方(图3A),毛囊中间形成空腔间隙(图3B)。毛囊上段组织体外培养后第4天,外根鞘细胞增殖并填充拔除毛发后留下的空腔,部分外根鞘细胞突出到玻璃膜底部切缘之外(图3C)。培养第9天,外根鞘细胞和真皮鞘细胞继续增殖,部分真皮鞘细胞移动到底部外根鞘中,毛囊断端被新生的结缔组织包裹形成鞘状,结缔组织鞘基本规则,但新生成的结缔组织鞘细胞数较少,没有形成新的毛乳头(图3D)。
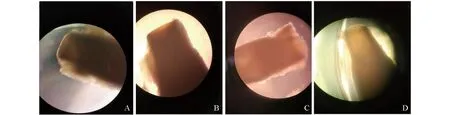
图2 毛囊上段组织在倒置显微镜下形态结构观察A-B:未再生组织;C-D:再生组织
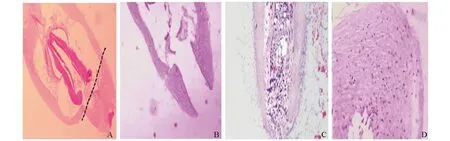
图3 再生毛囊上段组织HE染色A:完整毛囊组织;B:毛囊上段组织;C:第4天毛囊上段组织;D:第9天毛囊上段组织
2.4 α-SMA在再生毛囊上段中的表达模式
α-SMA一般表达在毛囊底部临近玻璃膜的真皮鞘细胞和小部分毛乳头细胞中。体外培养后的毛囊上段组织,再生增殖的部分由真皮鞘细胞移动到底部外根鞘中,α-SMA在毛囊下段的再生的真皮鞘细胞中有表达,阳性颗粒分布于胞浆中,呈棕黄色,如图中箭头所示(图4)。
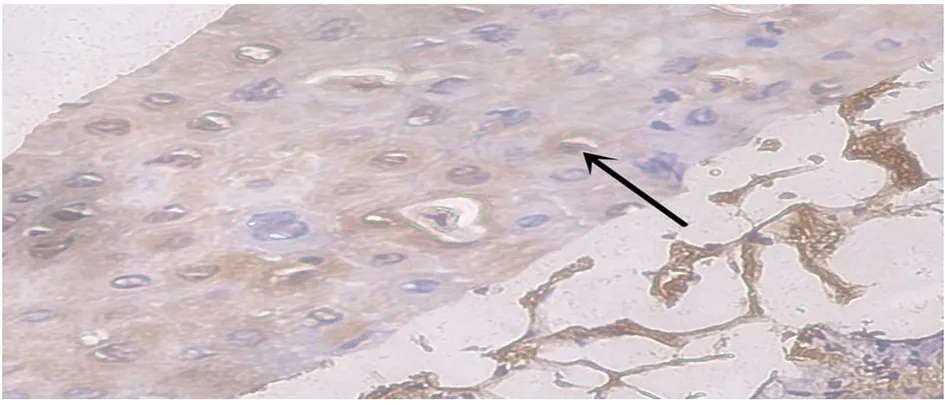
图4 α-SMA在再生毛囊上段中的表达模式
2.5 大鼠触须毛囊上段再生情况统计
将6组不同培养液中的大鼠触须毛囊上段在37 ℃,5%CO2培养箱中连续培养4天后,在普通光学显微镜下观察并统计具有再生状态的毛囊上段个数。每组16个毛囊上段组织,共重复实验6次。以第Ⅵ组为对照组,第Ⅰ组~第Ⅴ组为室验组,采用统计软件进行统计学分析,第Ⅰ组~第Ⅴ组与第Ⅵ组相比差异具有统计学意义。即在37 ℃,5%CO2培养箱中培养后的毛囊上段组织显微观察发现,在6种不同培养液中,5%FCS MEM+10-7mmol/LDHT+10 ng/mL IGF-1+20 ng/mL EGF的培养液条件下毛囊上段的再生率最高。因此,5%FCS MEM+10-7mmol/LDHT+10 ng/mL IGF-1+20 ng/mL EGF培养液为本研究中最适合大鼠触须毛囊上段再生的体外培养液。
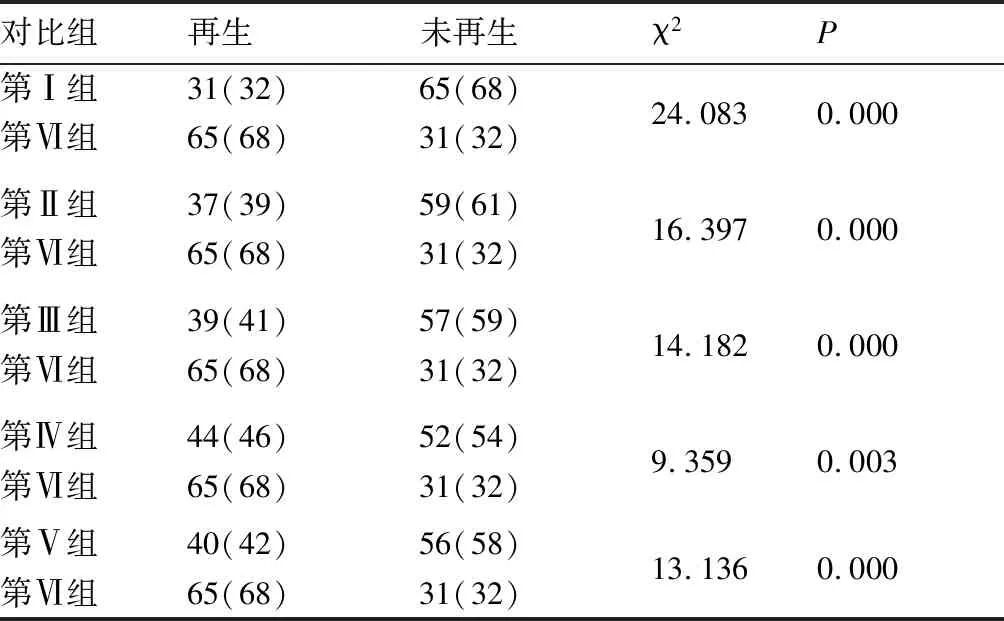
表1 各实验组与对照组毛囊上段体外培养再生比率的比较 (个,%)
按P′=0.005(P′=P/2(k-1),k为样本率的个数)检验水准,第Ⅰ组~第Ⅴ组P′<0.005与第Ⅵ组相比
3 讨 论
毛囊是哺乳动物的特有结构,是重要的皮肤附属器官,主要的作用是维持毛发的生长,其次对动物的外形及热量的维持也具有重要作用。目前关于毛囊生长变化的调控机理尚不十分明确,但已明确某些细胞因子参与了毛发的生长调控[1],其中包括EGF和IGF-1。相关研究表明,IGF-1能够刺激毛囊的生长,可通过反转录-聚合酶链式反应发现真皮乳头细胞有IGF-1mRNA的表达[2]。IGF-1对毛囊生长的调节主要体现在它能调控不同生长周期上皮角化细胞的增殖和分化,从而减少毛囊细胞的凋亡,延长毛囊体外生长时间[3]。EGF是细胞生长周期的外源性调节因子,可诱导体外培养的毛囊的生长发生变化,从而促进外根鞘细胞增殖[4],国内研究发现,利用毛囊体外培养技术,分析不同浓度IGF-1、EGF及二者合用对毛囊体外生长的影响,结果表明基础培养液中联合添加10 ng/mL IGF-1和20 ng/mL EGF与基础培养液及其它浓度梯度相比更能刺激体外毛囊培养的生长。EGF还可诱导IGF-1的表达,从而使IGF-1在正常细胞和转化细胞中表达增加[5-6]。
毛发的生长及更新受到多种激素的调节,雄激素在其中扮演了一个非常重要的角色。雄激素主要包括睾酮、雄烯二酮和脱氢表雄酮,睾酮是雄激素最主要的形式,毛囊主要通过5α还原酶将睾酮转化为DHT来参与毛发的生长调节[7]。根据人体不同部位,雄激素对人类毛囊生长发育有不同的影响,雄激素能刺激胡须、腋窝和阴毛等部位的毛发生长,抑制人体前额头发的生长[8]。雄激素受体在胡须、腋窝和额叶头皮中均有表达,而在枕部头皮毛囊中未检测到雄激素受体[9],不同部位的毛囊可能通过改变雄激素的活性水平从而调控毛发的生长。相关研究表明,雄激素性脱发患者血DHT浓度高于正常对照组,通过降低血DHT浓度后,脱发现象得到改善。但在2型5α还原酶缺失的男性假两性畸形患者中,因无法产生有活性的雄激素,这些患者虽不会产生雄激素性脱发改变,但也仅有极少量的胡须生长[10]。这说明了一定水平有活性的雄激素对于维持正常的毛囊周期和毛发生长是十分必要的[11]。相关实验通过体外毛囊培养探究不同浓度DHT对毛发生长的影响,最终得出DHT浓度降低到10-7mol/L时可促进毛囊生长,毛囊毛母质细胞增殖活性强,毛囊生长期延长[12]。
α-SMA是毛囊真皮结构的标志性分子,主要表达在毛乳头及真皮鞘。作为毛乳头及真皮鞘细胞的特异性标志分子,一般表达在毛囊底部靠近玻璃膜的真皮鞘细胞和小部分毛乳头细胞中[13]。当毛囊由休止期进入到生长期时,毛乳头细胞并不进行分裂,而是由与之相邻的真皮鞘细胞运动到毛乳头中对其进行补充[14]。在毛乳头和真皮鞘中均可检测到α-SMA,表明这两者之间有一定的同源性。
目前很多研究者关于毛囊的体外保存培养液的选择及温度的设定做了相当多的研究[15]。他们通过对比在0 ℃、4 ℃以及26 ℃的温度下,林格氏液、DMEM等培养液保存离体毛囊不同时间后的毛囊活性,结果得出,0 ℃为体外保存毛囊的合适温度,且林格氏液优于DMEM培养液,但体外保存时间最迟不能超过48 h,最好是在24 h之内,毛囊活性在24 h后随着时间的延长不断降低。国外学者Thajeb等[16]通过实验证明了离体的器官组织发生细胞凋亡的原因主要是生长因子的缺乏以及氧自由基的产生。吴磊等[17]通过实验证明了体外培养毛囊Williams E培养液优于林格氏液。唐建兵等[18]通过比较毛囊体外保存培养液Williams E培养液及含血清的DMEM培养液,结果表明Williams E培养液优于含血清的DMEM培养液。所以,无血清Williams E培养液是适合离体毛囊体外培养的培养液。唐瑶等[19]通过实验来比较不含血清、含5%FCS以及含10%FCS的DMEM、MEM培养液中最适合小鼠触须毛囊外根鞘体外再生的培养液,结果表明,含5%FCS的MEM培养液是最适合小鼠触须毛囊外根鞘体外再生的培养液。基于上述实验,本研究将无血清Williams E培养液及含5%FCS的MEM培养液作为基础培养液。
一般来说,切除毛囊球部后的毛囊上段再生过程可以分为四个时期:(1)急性损伤反应期;(2)细胞内和细胞外结构的重组和改建;(3)毛囊新结构的再生;(4)新的毛发纤维的生长。在本次实验中,毛囊上段组织体外培养后第4天,外根鞘细胞增殖并填充拔除毛发后留下的空腔,部分外根鞘细胞突出到玻璃膜底部切缘之外。培养第9天,外根鞘细胞和真皮鞘细胞继续增殖,部分真皮鞘细胞移动到底部外根鞘中,毛囊断端被结缔组织包裹,结缔组织鞘基本规则,毛囊组织切缘痕迹并不明显。培养第12天,部分细胞开始出现萎缩或者开始死亡,没有新的毛乳头形成。本课题的缺陷在于毛囊上段体外培养最终无完整的毛乳头形成,但是能够收获大量单个再生毛囊上段体外培养的标本,对课题组下一步深入研究毛乳头再生的机制至关重要。
本次实验选择大鼠触须毛囊作为研究对象,是因为:(1)大鼠触须毛囊的取材便捷,毛囊分离等操作相对简单,容易上手;(2)大鼠触须毛囊体积大,不同周期的毛囊容易辨别;(3)大鼠触须毛囊上段组织的形态结构明显,形态结构变化容易观察。影响大鼠触须毛囊生长的因素有很多,除了培养基种类、生长因子(IGF-1、EGF等)、双氢睾酮,还包括血管生成素、富含血小板血浆[20]、雌激素等等。本实验成功构建了毛囊上段体外再生模型,为毛囊切割后再生研究提供一个良好的实验平台。课题组相信对毛囊上段的深入研究有助于揭示毛囊再生的真正秘密,为毛发再生和移植的研究奠定基础。
