肥胖儿童非酒精性脂肪性肝病的危险因素分析
2019-12-04林先强符清宇沙丹
林先强 符清宇 沙丹
非酒精性脂肪性肝病(Non-alcoholic fatty liver disease,NAFLD)是一种由肝内脂质积聚而造成的常见慢性肝病,全球NAFLD患者共计1 000万,其中肥胖患儿高达25%[1]。尽管国内外有关肥胖儿童伴发NAFLD的报道较多,但研究结果不尽相同[2]。Félix等[3]回顾性研究发现,年龄、肥胖持续时间、高ALT水平需警惕儿童肥胖NAFLD的发生。国外研究[4]显示,过度肥胖、肥胖持续时间和高尿酸血症被认为是NAFLD的重要影响因素。本研究回顾性分析NAFLD肥胖患儿的病历资料,旨在探讨影响肥胖儿童NAFLD的危险因素。
资料与方法
一、一般资料
选取2016年1月至2018年1月于我院体检的1 047例单纯性肥胖儿童作为研究对象,根据是否患有NAFLD分为NAFLD组和非NAFLD组,NAFLD组患儿共476例,男性309例,女性167例,年龄8~14岁,平均年龄为(11.6±2.8)岁。非NAFLD组患儿共571例,男性258例,女性313例,年龄3~14岁,平均年龄为(10.9±3.1)岁。所选对象均符合《非酒精性脂肪性肝病诊疗指南》[5]。单纯性肥胖的诊断标准:7~18岁采用中国学龄儿童少年超重、肥胖筛查体质量指数(BMI)分类标准:超重BMI ≥ 24 kg/m2、肥胖筛查BMI ≥ 28 kg/m2。7岁以下采用0~7岁中国儿童BMI肥胖筛查体质量指数(BMI)分类标准:超重BMI ≥ 17 kg/m2、肥胖筛查BMI ≥ 19 kg/m2。排除标准:由遗传、内分泌等导致的继发性肥胖症者。肝脏B超检查结果作为NAFLD影像学诊断依据,检查方法为入选者经8~12 h的空腹后,应用超声诊断仪(GE公司,LOGIC500型,探头频率3.5~5.0 mHz)进行确诊。
二、观察指标与方法
纳入所入选患儿的一般资料:年龄、性别、家族史、肥胖持续时间。身高、体质量。腰围、臀围及血生化指标。血生化指标检查:应用全自动生化分析仪(西门子医疗系统有限公司,ADV1A 2 400型),生化试剂盒(上海透景生命科技股份有限公司),包括胆固醇(TC)、空腹胰岛素(FINS)、空腹血糖(FBG)、血清三酰甘油(TG)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)等。脲酸酶紫外法检测血清尿酸(UA)。稳态模型胰岛素抵抗指数(HOMA-IR)=(FINSFBG)/22.5。
三、统计学分析
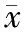
结 果
一、NAFLD在肥胖儿童中的流行现状
1 047例肥胖儿童中,共检出476例(45.5%)NAFLD,其中男性309例(29.5%),女性167例(16.0%)。
二、 肥胖儿童NAFLD的单因素分析
单因素分析结果显示,两组患儿在性别、肥胖持续时间、臂围、TC、LDL-C、HDL-C和FBG比较,差异无统计学意义(P均>0.05)。NAFLD组患儿年龄、体质量、腰围、BMI、TG、AST、ALT、FINS、HOMA-IR和UA显著高于非NAFLD组(P<0.05,表1)。
三、肥胖儿童NAFLD的多因素分析
将单因素分析发现的有统计学意义的指标(年龄、体质量、腰围、BMI、TG、AST升高、ALT升高、FINS、HOMA-IR和UA)作为自变量,将NAFLD作为因变量纳入回归分析,结果显示BMI、HOMA-IR和UA是肥胖儿童伴发NAFLD的独立影响因素(表2)。
表1 两组基线资料[n(%),±s]比较
表2 肥胖儿童NAFLD影响因素的logistic 回归分析
四、BMI、HOMA-IR和UA在儿童肥胖NAFLD诊断的效能
效能分析结果显示,BMI、HOMA-IR和UA联合检测诊断儿童肥胖NAFLD的AUC为0.947,95%CI为0.906~0.973,敏感度和特异性分别为88.2%、99.4%,三指标联合诊断NAFLD的截断点为0.876。

图1 BMI、HOMA-IR和UA联合检测诊断儿童肥胖NAFLD的ROC曲线
讨 论
近年来,随着肥胖儿童数量急剧上升及其相关代谢综合征(Metabolic syndrome,MS)的发病率升高,儿童NAFLD现已成为欧美等发达国家及国内较发达城市慢性肝病的主要病因,且患病率高达11%~29%,其中9%~21%为NASH,后者10年内肝硬化发生率高达24%[6-7]。
本研究分析了2016年1月至2018年1月于我院体检的1 047例单纯性肥胖患儿的病历资料,调查显示肥胖儿童中NAFLD的检出率为45.5%,与2017年肥胖儿童NAFLD 44.7%的检出率相似。单因素及多因素logistic回归分析结果显示,BMI、HOMA-IR和UA是肥胖儿童伴有NAFLD的独立影响因素。研究表明,肥胖儿童伴有NAFLD与患儿腰围、BMI及血清胰岛素水平有关[8]。相关实验显示,年龄、肥胖持续时间、高ALT水平为肥胖儿童NAFLD发生的独立危险因素。亦有实验证实,过度肥胖、肥胖持续时间和高尿酸血症被认为是NAFLD的重要影响因素。本次研究结果与上述文献结果存在一定差异,其可能由于样本量少、个体差异及地域等原因所致。研究表明,高BMI为肥胖儿童伴有NAFLD的独立影响因素,一项有关NAFLD患者体质相关性研究表明,肥胖体质合并高BMI与脂肪肝及其严重程度有关。本研究结果显示,高BMI易导致肥胖儿童NAFLD的发生,与上述研究结果一致,提示高BMI肥胖儿童为诱发NAFLD的高危人群,其原因可能为BMI愈高,罹患代谢性疾病的可能性增加,进而NAFLD患病率亦会随之增高。相关研究[9]结果均表明,高HOMA-IR与肥胖儿童NAFLD的发生及发展密切相关。本次实验结果显示,高HOMA-IR为肥胖儿童伴有NAFLD的又一独立影响因素,与上述研究结果一致,提示胰岛素抵抗(Insulin resistance,IR)与诱发脂肪肝有着密切的联系,可能原因为NAFLD患儿体内脂肪细胞增生肥大,致使组织细胞中的胰岛素受体活动受阻,削弱其对胰岛素的敏感性,进而引发IR。IR引起的肝细胞内脂肪过度积聚及肝细胞对损害因子的敏感性增加是肝内脂肪积聚的关键机制,进而引发肝细胞损伤、炎症及纤维化形成。相关研究[10]表明,UA增高可能是诱发NAFLD发病的诱因之一,且NAFLD患者中UA水平越高,疾病越严重,肝脏纤维化指数越高,肝小叶炎症愈发严重,以及炎症分级愈高。本研究结果显示,高UA水平为肥胖儿童伴发NAFLD的诱因,提示高UA水平的肥胖儿童易于发生NAFLD,可能原因为高UA影响了肝细胞中脂肪的代谢,脂肪肝发病是由肝细胞中脂肪的氧化利用和转运障碍所致,UA升高可促进胰岛素受体底物1的磷酸化,进而致使下游蛋白激酶B的磷酸化,阻止受体信号传递,致使胰岛素抵抗的发生,进而诱发NAFLD。本研究同时分析BMI、HOMA-IR和UA联合诊断儿童肥胖NAFLD的效能,结果显示,三者联合检测诊断儿童肥胖NAFLD的AUC为0.947,具有较高的效能、灵敏度及特异性提示,三指标联合检测可综合考虑最大限度避免误诊及漏诊,而且对儿童肥胖NAFLD的临床早期诊断有实用价值。
综上所述,BMI、HOMA-IR和UA是肥胖儿童伴有NAFLD的独立影响因素。对于高BMI、HOMA-IR和UA水平的肥胖儿童,临床应警惕其NAFLD的发生。因此,应对肥胖儿童进行肝脏B超的常规检查,同时对肥胖儿童进行BMI、HOMA-IR和UA联合诊断,找出高危因素,并采取积极有效的干预措施,以达到监督、预防及治疗肥胖儿童NAFLD的目的。本研究为单中心研究,后续将进行多中心研究,并扩大样本量,以完善实验结果。
