妊娠期肝内胆汁淤积症JNK信号通路的动物实验研究
2019-12-04郁平姬小凡王敏徐晓艳
郁平 姬小凡 王敏 徐晓艳
妊娠期肝内胆汁淤积症(ICP)是妊娠期常见病,也是诱发胎儿窘迫、早产的重要原因,部分孕妇可能造成死胎等严重后果。ICP发生后肝脏正常代谢功能紊乱,近年来报道显示,信号通路作用失调是ICP后引起肝功能异常的重要环节[1]。c-Jun氨基末端激酶(JNK)是丝裂原蛋白激酶家族的重要成员,可介导肝内多种细胞的生长代谢。覃春美等[2]认为JNK异常激活可诱导肝细胞损伤,并影响肝内胆汁代谢。本研究建立ICP动物模型,分析JNK与ICP的关系,旨在进一步探讨ICP发病机制,为临床干预提供借鉴。
资料与方法
一、一般资料
实验大鼠均由上海斯莱克实验动物有限责任公司提供,纳入40只清洁级SD雌性大鼠和10只雄性大鼠作为实验动物,体质量(220.78±14.92)g,鼠龄(165.15±20.39)d;以充足饲料和清水常规喂养,在发情期将雌性和雄性大鼠按4∶1比例同笼喂养。观察阴栓脱落情况,以阴栓脱落为妊娠成功。至妊娠第15 d,随机将40只雌性大鼠分为观察组和对照组,每组20只。观察组体质量(225.76±18.23)g;鼠龄(174.47±16.79)d。对照组体质量(227.05±17.70)g;鼠龄(176.98±15.56)d。两组大鼠体质量、鼠龄比较差异无统计学意义(P > 0.05)。
二、ICP建模
观察组大鼠在常规喂养基础上,自妊娠第15 d开始,自大鼠后肢皮下注射孕酮(国药准字H31021265,上海通用药业股份有限公司,规格1 mL∶0.25 g已酸羟孕酮,5 mg戊酸雌二醇),75 mg/(kg·d),同时注射α乙炔雌二醇(美国Sijma公司提供,货号:1260001,以1 mL精油配伍0.2 mg α乙炔雌二醇比例备制待用),1.25 mg/(kg·d),连续给药干预5 d。对照组大鼠继续常规喂养。两组大鼠均在妊娠后第3周取眶静脉取血1 mL,处死大鼠,取肝组织标本。
三、实验室检测
(一)血清总胆红素(TBil)检测 将眶静脉血1 mL,3 000 r/min离心10min,取上清液,采用全自动血液生化分析仪检测血清TBil水平。HD-F2600型生化分析仪由济南汉方医疗器械有限公司提供。
(二)免疫印迹法 检测磷酸化JNK:取50 mg大鼠肝组织,研磨后置入EP管中进行裂解,离心15 min后取上清液备用,取10 μL冷冻,室温下解冻,PBS液溶解稀释20倍,余上清液与5倍样品缓冲液混合,按40 mL/管分装,加热变性5 min后冷却备用。每孔加入200 μL工作液,混匀后37 ℃下孵育30 min,取微孔板,在550 nm下测量吸光度,计算蛋白浓度。
(三)免疫组化法 检测大鼠肝组织JNK阳性细胞数:取大鼠肝脏石蜡标本,一次进行脱蜡、梯度水化及抗原修复处理,完成后漂洗,用5%BSA封闭液室温封存标本1 h,去封闭液,以1∶50稀释一抗抗体,滴入标本组织,4 ℃孵育过夜。去一抗液,漂洗,取切片,甩尽TBST液,滴加显色液DAB工作液50 μL,室温孵育15 min,观察标本颜色,结果以阳性细胞数所占百分比和染色结果计分乘积评估结果,以得分≥4分为结果阳性[3]。具体评分标准为:阳性细胞数,无(0分)、<50%(1分)、50%~75%(2分)及>75%(3分);染色结果,无(0分)、浅黄色(1分)、黄色(2分)及棕黄色(3分)。
四、观察指标
记录两组大鼠TBil、JNK信号通路蛋白表达量及JNK阳性细胞数,比较两组大鼠TBil水平、JNK信号通路及JNK阳性细胞数。
五、 统计学方法

结 果
一、两组TBil和JNK
观察组大鼠血清TBil和肝组织中JNK蛋白表达量分别为(8.94±2.58)μmol/L和1.57±0.48,对照组分别为(6.19±2.14)μmol/L和1.16±0.63,两组间比较差异有统计学意义(t值分别为3.669和2.315;P值分别为0.001和0.026)。40只雌性大鼠TBil与JNK蛋白表达量呈显著正相关(r=0.455,P=0.000)。见图1。

图1 TBil与JNK蛋白表达量线性关系分析
二、两组免疫组化结果比较
观察组大鼠JNK阳性者15只,占75%,对照组JNK阳性者7只,占35%。两组小鼠JNK细胞阳性率比较,差异有统计学意义(χ2=6.465,P=0.011)。
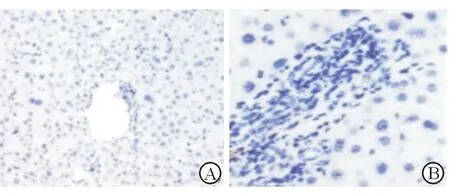
A:JNK阴性;B:JNK阳性
图2大鼠肝组织JNK免疫组化染色结果(DAB200)
讨 论
JNK属促分裂原活化蛋白激酶(MAPK)家族成员,既往报道显示,JNK存在3个不同编码基因,其中JNK1和JNK2在各种组织中广泛存在,并通过c-Jun、ATF2及p53等下游底物发挥生物学效应。JNK信号通路的调节主要依赖于MAPK激酶的识别和支架蛋白组合信号复合物[4],从而介导细胞生长因子的代谢凋亡。傅应亚等[5]研究发现,JNK信号通路可直接调控胞质内Bim和Bcl-2等靶蛋白的活性,是肝脏损伤重要的调控因子。ICP患者以肝细胞和胆小管的色素沉着为主要病理表现,随着胆汁淤积的加重,逐渐发生肝组织损伤。胆汁淤积是JNK信号通路磷酸化重要的刺激因素,目前认为信号通路激活与功能蛋白表达相关[6],本研究分析ICP大鼠模型TBil与JNK蛋白表达量的关系,发现二者具有正相关性,提示JNK的异常激活可能增加TBil水平,进而影响胆汁淤积症患者肝功能状态。另外,本研究还对比了两组大鼠模型肝组织中JNK表达量,结果发现差异有统计学意义,而陈秋玲等[7]的实验结果也显示,JNK抑制剂有助于调节胆汁酸转运蛋白水平,进而改善胆汁淤积程度,说明JNK参与ICP过程,纠正JNK信号通路异常可能有助于改善临床症状。
目前,临床对JNK信号通路与ICP的关系尚未完全阐明,Vucur 等[8]一项报道认为,JKN异常可能是肝组织代偿性增殖作用障碍的原因之一,影响肝脏自我修复功能,使肝功能持续降低,进而导致TBil异常升高,胆汁淤积。同时胆汁酸可激活TGR5胆汁酸受体,抑制JNK和Caspase复合物的形成,并上调死亡受体5表达水平,诱导肝细胞损伤和肝纤维化进程,因而推测JNK信号通路异常与胆汁酸可能存在相互作用关系,使ICP持续进展。ICP孕妇胎盘微绒毛数量减少,部分内质网相互融合而成束状,滋养细胞发生固缩,这些变化使胎盘物质交换效能降低,成为胆汁淤积的诱因。而JNK不仅参与肝细胞增殖分化,而且对细胞形态和骨架的维持具有调控作用,Dada等[9]认为JNK同源重组基因敲除会使其上游调节分子缺失,并加快病程进展,这也说明JNK信号通路在疾病发生、发展过程中发挥重要作用。因而,对于ICP患者,JNK信号通路的正常调控有助于改善胆汁酸代谢,缓解胆汁淤积状态。另外,JNK还可能与Smad、ERK等其他信号通路相互作用,形成复杂的调控网络,起到加强调控的作用,这有待于今后进一步深入研究。
