肝硬化并发急性肾损伤患者门静脉主干内径特征观察
2019-12-04王伟
王伟
急性肾损伤(AKI)是肝病患者比较常见的一种并发症,发病机制尚未彻底明确,可能与肝脏疾病或外源性致病因素存在关联。研究表明AKI可引起多个脏器的病理损害,包括肾脏、肝脏等,并导致机体循环改变,对机体影响非常大[1]。门静脉高压的监测对评估肝硬化患者病情具有重要意义,它能在一定程度上反映血流动力学的变化,而血流动力学紊乱是诱发AKI的一个因素[2]。本研究旨在进一步观察肝硬化并AKI患者门静脉主干内径(PVD)特征,便于增强对PVD的认识,针对这类患者提出针对性治疗策略,提高疗效,现报道如下。
资料与方法
一、一般资料
选取湖北省十堰市东风总医院急诊科2015年4月—2018年4月收治的肝硬化并AKI患者62例,作为AKI组,选取同期收治的肝硬化患者62例,作为肝硬化组。AKI组男32例,女30例,年龄33~75岁,平均(48.94±12.56)岁;Child-Pugh分级:A级18例、B级30例、C级14例;合并症:肝性脑病10例、高血压18例、糖尿病13例、消化道出血17例。肝硬化组男34例,女28例,年龄34~77岁,平均(49.78±11.37)岁;Child-Pugh分级:A级16例、B级31例、C级15例;合并症:肝性脑病12例、高血压17例、糖尿病15例、消化道出血14例。本次方案获得伦理委员会批准,两组性别、年龄等资料比较无明显差异(P>0.05)。
二、诊断标准
(一)肝硬化 ①具有肝硬化诱因,如肝炎病毒、寄生虫感染、胆汁淤积、化学因素、药物因素、酒精因素等;②早期症状为腹水、血管瘤、腹泻、食欲不振等,中晚期时伴出血倾向,脾明显肿大,有肝掌、腹水、黄疸等表现;③实验室检查提示肝功能异常,有肝硬化征象;④影像学检查证实肝硬化[3]。
(二)AKI[4]①48 h内基线肌酐值增高≥50%;②血肌酐上升超过26.5 μmol/L。
三、纳入与排除标准
(一)纳入标准 ①临床诊断明确;②成年患者;③入院后接受PVD检测与常规实验室指标检测;④精神状态、认知功能无异常;⑤知情同意。
(二)排除标准 ①恶性肿瘤;②既往有肾脏替代治疗史;③既往有脏器移植史;④3~5期慢性肾病;⑤临床资料不全。
四、检测方法
(一)PVD测定 患者均于入院当日测定,仪器为彩色多普勒超声诊断仪(美国GE 730),探头频率、取样容积分别为3.5~5.0 MHz、2~6 mm。选择腹部血流模式进行测定,在测定过程中,将门静脉长轴、超声波束交角控制在60°以下,受检者处于屏气状态,门静脉测定长度>3 cm,于下腔静脉前方予以测定。
(二)实验室指标测定 于患者入院当日采集3 mL空腹静脉血,经全自动血液分析仪(迈瑞BC-5000)测定外周血白细胞计数(WBC)、血小板(PLT)总数、血红蛋白(Hb),经全自动生化分析仪(北京YSI 2900)测定血肌酐(Cr)。
五、统计学方法
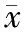
结 果
一、两组PVD比较
AKI组、肝硬化组的PVD分别为(10~16)mm、(8~13)mm,均值分别为(13.27±2.07)mm、(11.19±1.38)mm。AKI组PVD显著高于肝硬化组(t=6.583,P=0.000)。
二、PVD对肝硬化并AKI的预测价值
PVD预测肝硬化并AKI的曲线下面积为0.683(标准误=0.048,P=0.000,95%CI=0.589~0.776),最佳截断值为12.517 mm,敏感度为70.00%,特异度为65.20%。ROC曲线见图1。
三、两组实验室指标比较
AKI组PLT总数显著低于肝硬化组,血Cr较肝硬化组显著增高(P<0.05),两组WBC、Hb比较无显著差异(P>0.05),见表1。
四、肝硬化并AKI患者的PVD与实验室指标相关性
经Pearson线性相关分析提示肝硬化并AKI患者的PVD与PLT总数呈负相关(P<0.05),其与Cr呈正相关(P<0.05),其与WBC、Hb无明显相关性(P>0.05),见表2。线性相关图见图2~图5。

图1 PVD预测肝硬化并AKI的ROC曲线
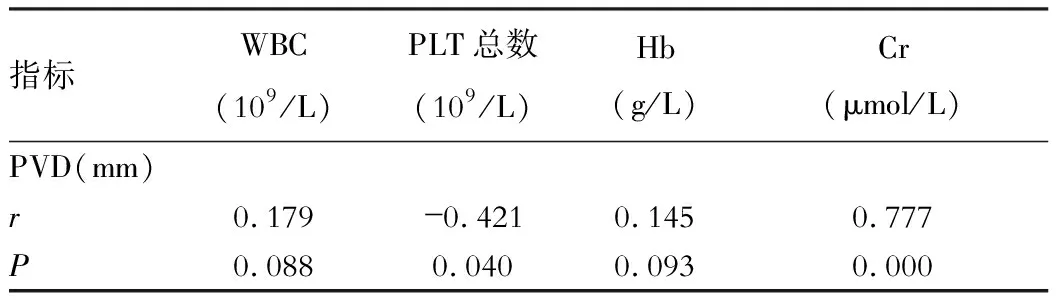
指标WBC(109/L)PLT总数(109/L)Hb(g/L)Cr(μmol/L)PVD(mm)r0.179-0.4210.1450.777P0.0880.0400.0930.000
表1 两组实验室指标比较(±s)
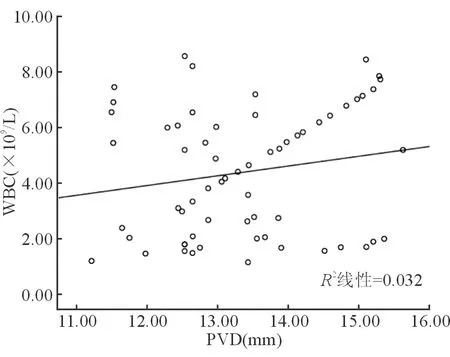
图2 PVD与WBC的线性相关图
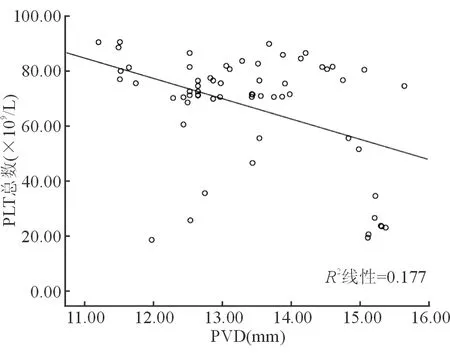
图3 PVD与PLT总数的线性相关图
图4 PVD与Hb的线性相关图
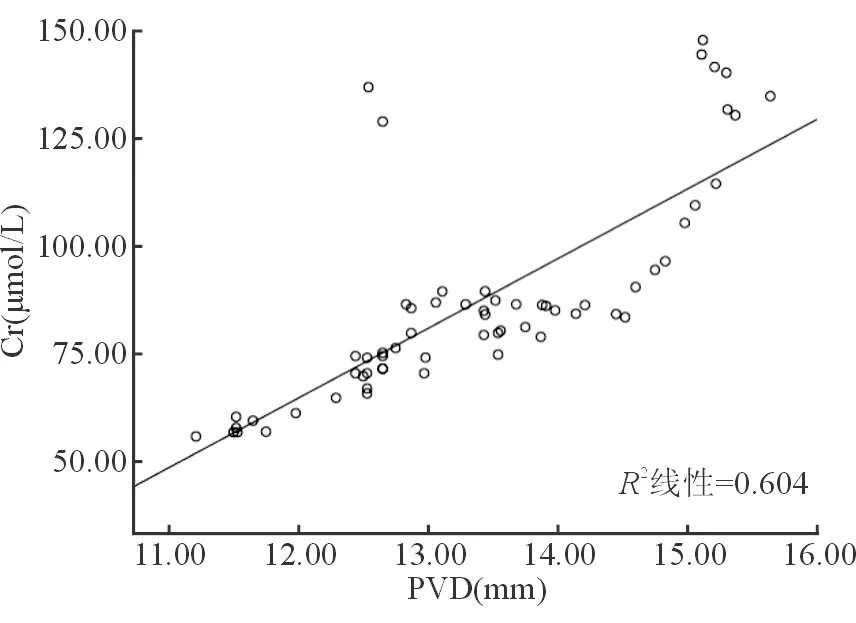
图5 PVD与Cr的线性相关图
讨 论
本研究结果提示肝硬化患者合并AKI后,PVD较未合并AKI者明显增高,经ROC曲线进一步证实PVD对肝硬化并AKI有一定预测价值,提示PVD的监测对评估患者病情至关重要。既往有研究发现肝硬化后AKI的发生主要与门静脉高压存在关联,而PVD增宽是引起AKI的重要原因[5]。从病理学角度而言,门静脉是肝脏的主要血供来源,肝动脉也会提供少量血供,门静脉、肝动脉均经过肝窦,于下腔经脉汇合,在这种情况下,肝窦阻力上升,从而导致门静脉高压。当发生肝硬化后,多种因素(如药物、病毒等)会激活肝星状细胞,导致胶原释放量增加,并于Disse腔内沉积,促使肝窦变窄,增加PVD宽度,诱发门静脉高压,促进AKI发生[6]。因此,与未合并AKI的肝硬化患者相比,合并AKI者的PVD明显变宽,且临床可将其作为预测肝硬化并AKI的依据。
本研究发现与单纯肝硬化者相比,合并AKI者的PLT总数下降,而血Cr增高。PLT下调的原因主要在于AKI患者可能存在多个脏器功能损害,机体血细胞合成、造血功能减弱,与此同时,PLT功能也明显削弱。研究表明PLT下降可能会促进肾衰竭,增加死亡风险,引起不良预后[7]。血Cr是评估肾损害的常用指标,当发生肾损害后,血Cr增高,它可反映肾实质受损程度。张裕生等[8]发现血Cr水平与血胱抑素C有相关性,二者可联合用于AKI的诊断,且最终证实血Cr增高是导致AKI的危险因素之一。由此可见,PLT总数、Cr均与AKI发生存在关联,其中PLT总数下调、Cr上调可能是促进AKI发病、进展的机制。
本研究的创新之处在于证实肝硬化并AKI患者的PVD与PLT总数、血Cr有相关性,进一步提示PLT总数、Cr检测对评估患者病情的重要性。有学者发现血Cr的变化与患者预后密切相关,随着血Cr水平越高,AKI越可能呈进行性发展,1个月内生存率较低[9]。另有研究发现PLT总数也与AKI患者的预后相关,这主要因其PLT功能削弱所致[10]。因此,临床需着重监测患者PLT总数、血Cr水平的变化,并观察二者与PVD的关系,及时发现高危AKI病例,为疾病治疗提供合理依据。
综上,肝硬化并AKI患者的PVD高于单纯肝硬化患者,PVD与PLT总数、血Cr存在明显相关性,临床需对此引起重视。然而,本研究也存在局限性,如两组仅各选取62例样本量,病例数少,在未来的研究中,笔者将扩大样本量,对此进行深化分析。
