聚乙烯亚胺非病毒基因载体结构修饰研究进展
2019-12-04林浩何东升涂家生
林浩,何东升,涂家生
(中国药科大学药学院,江苏 南京 210009)
基因治疗(gene therapy)是指利用外源基因定向地纠正或补偿有缺陷的功能基因,从而恢复细胞的正常功能,达到治愈疾病的目的。近年来,随着众多用于治疗恶性肿瘤的病毒和非病毒载体以及靶向递送策略的不断涌现,基因治疗迅速成为基础及临床癌症研究领域中人们关注的热点[1-2]。2003年,我国首先批准了重组人p53腺病毒注射液(商品名:今又生);欧洲药品管理局(European Medicines Agency,EMA)于2012年批准Glybera,用于治疗脂蛋白脂酶缺乏遗传病;2018年,人类历史上首款RNAi疗法Patisiran诞生。迄今为止,已经有超过2 500项基因治疗临床试验在世界各地开展[3]。
由于基因药物自身带负电荷很难穿过生物膜,并且易被核酸酶降解,难以准确到达作用部位发挥治疗作用。因此,寻找安全有效的基因递送载体是基因治疗的关键。基因递送载体包括病毒载体和非病毒载体。其中,病毒载体具有较高的转染能力,但存在免疫原性和潜在的安全性问题,且病毒载体容量有限,这一系列问题阻碍了其在临床基因治疗中的应用[4-5]。非病毒载体主要包括阳离子脂质体、阳离子聚合物等,相比于病毒载体,非病毒载体具有成本低、制备简单、便于大规模生产、安全性高和化学结构可控等优点,越来越受到研究者的关注。
为了实现基因的高效胞内递送,非病毒基因载体需要具有多重功能以克服递送过程中的诸多挑战,如图1所示。载体首先需要能够有效包载被递送的基因,形成稳定的复合物。所形成的复合物应具有合适的粒径和电位,在体内能循环较长时间,以实现在靶组织的富集。再进一步通过受体介导或是非特异性的内吞进入细胞后,复合物必须从胞内体中逃逸,并根据治疗的需要,转运至作用部位,释放出所携带的基因以发挥作用[6-7]。
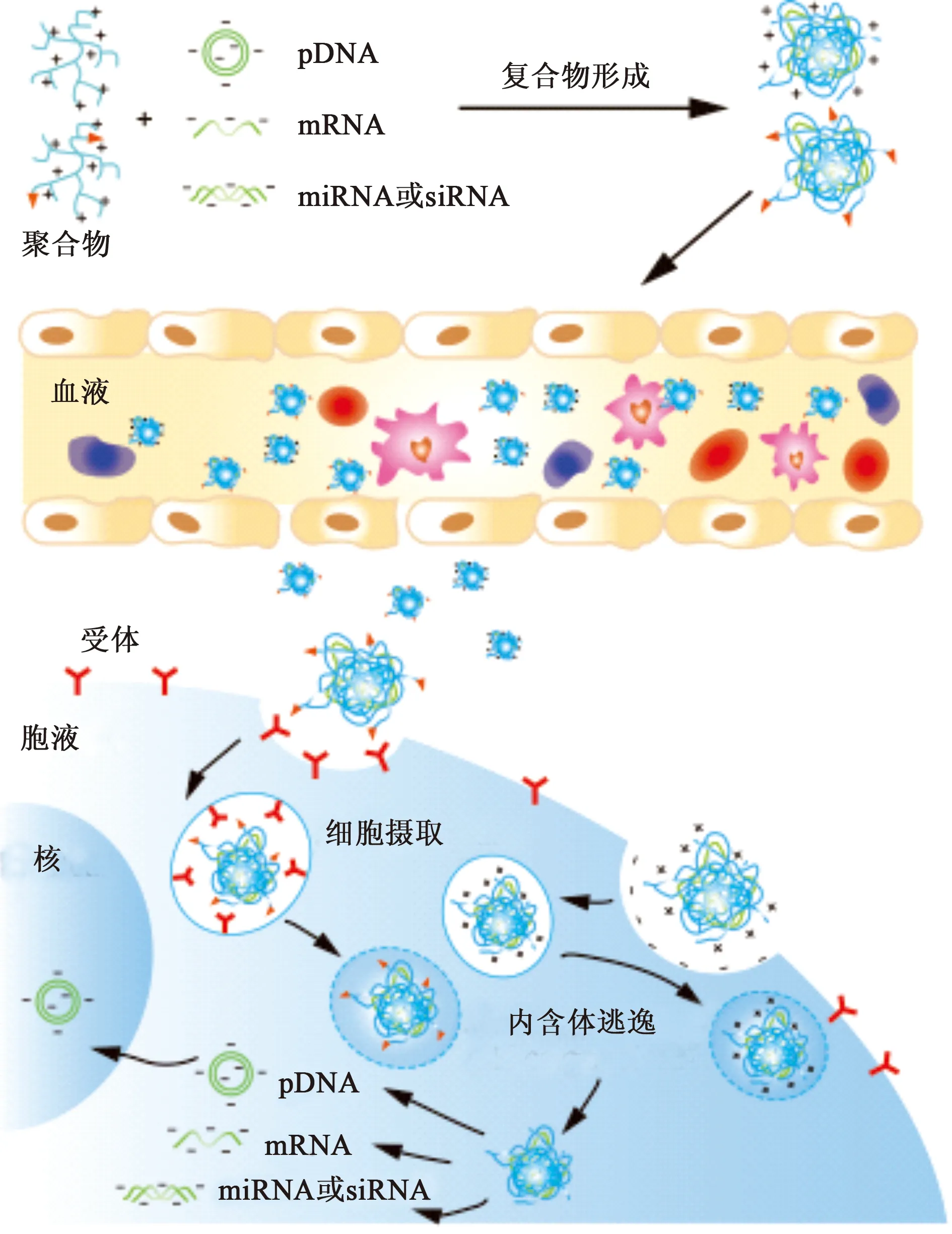
图1 核酸复合物递送过程及其障碍
非病毒基因载体中,阳离子聚合物聚乙烯亚胺(polyethylenimine,PEI)大致分为两种类型,即线性PEI(linear polyethyleneimine,LPEI)和支化PEI(branched polyethyleneimine,BPEI),结构式如图2所示,由于其拥有与DNA分子较强的组装能力而备受关注,其中25 kDa支化PEI(25 kDa BPEI)和22 kDa线性PEI(22 kDa LPEI)在目前的基因载体领域被称作“黄金标准”[8-9]。PEI于1995年由Boussif等[10]首次报道能够将DNA转移到新生小鼠的脑中,证明其在体内的应用。PEI的仲胺叔胺基团能在中性环境中质子化,高电荷密度在其体内外基因转染过程中起到重要作用,此外,由于PEI具有良好的pH缓冲能力,使其成为最经典有效的非病毒聚合物基因载体之一。 “质子海绵效应”假设给出,PEI复合物通过内吞作用进入细胞,随后其在酸性囊泡中积累,晚期形成溶酶体,载体缓冲溶酶体pH值的降低,吸收H+,同时为了达到电荷平衡和浓度平衡,引起Cl-和水内流,导致溶酶体渗透性肿胀破裂,复合物从中逃逸出来进入细胞质(见图3)。PEI通过这种独特的方式保护了核酸免于溶酶体降解而提高其转染效率[11]。PEI作为基因载体具有独特的优势,但其仍然存在一些缺点,如随着PEI分子量增加,其基因转染效率得到提高,但其毒性也随之增加。高分子量PEI表面带有较高的电荷密度,可以较好地压缩、保护DNA/RNA,同时,其良好的质子缓冲能力可促进复合物的溶酶体逃逸,但很难平衡细胞毒性问题,这在一定程度上限制了其应用。低分子量 PEI 细胞毒性虽然较低,但其转染效率也随之降低,不能起到很好的转染效果。为了克服这些限制,研究者对PEI进行了不同类型的结构改造并取得了诸多进展,本文对其研究进展做如下综述。
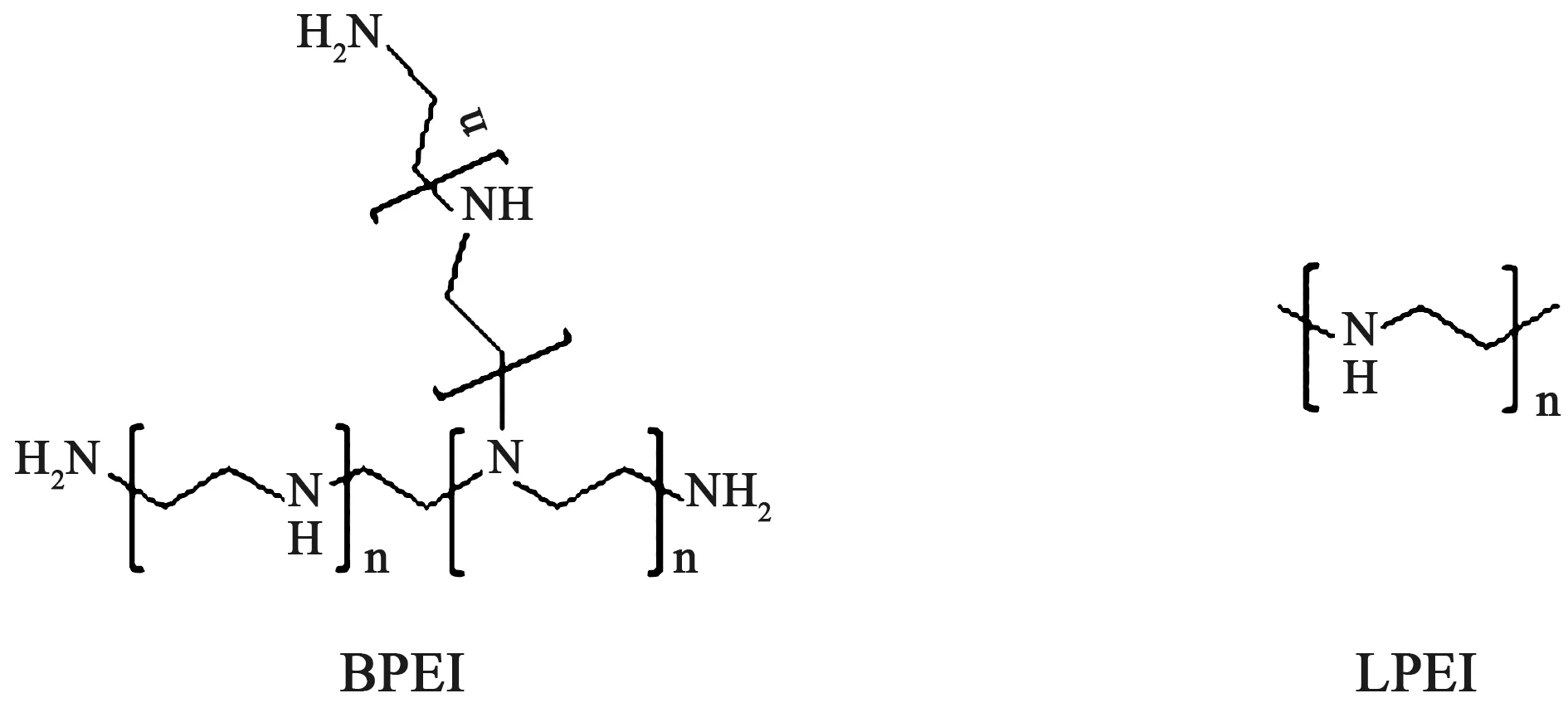
图2 支化PEI (BPEI)和线性PEI (LPEI) 结构式
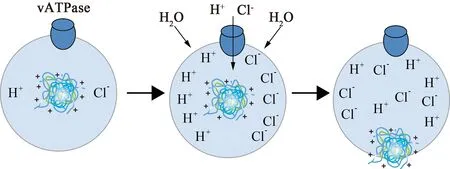
图3 PEI凭借质子海绵效应躲避溶酶体降解的机制示意图
1 多糖修饰的PEI
天然多糖,如壳聚糖、环糊精、甘露糖和普鲁兰糖等,可通过PEI上的寡胺残基连接得到一系列可生物降解的聚合物,实现高效转染、靶向递送和降低毒性等目的。
壳聚糖(chitosan,CS)具有低毒性、生物降解性和生物相容性等优点,然而壳聚糖的低转染能力限制了其应用,通过将壳聚糖接枝PEI,可以有效地实现基因转染。Liu等[12]先通过壳聚糖(CS)碱化和羧甲基化反应制备羧甲基壳聚糖(CMCS),再将PEI通过酰胺化反应接枝到CMCS的骨架上。结果表明与25 kDa PEI相比,CMCS-PEI共聚物与DNA形成的复合物在293T和3T3细胞中具有更低的细胞毒性和更高的转染效率。
环糊精(cyclodextrin,CD)是一种环状低聚糖,生物相容性好,在水溶液中可通过其特有的疏水腔与多种药物结合,广泛用于纳米药物载体的构建。Jung等[13]将低分子量PEI(low molecular weight PEI,LMWPEI)与甲基β-环糊精(MβCD)交联形成MβCD-LMWPEI(MLP),在无血清环境中,MLP可有效转染脑胶质瘤、黑色素瘤和肝癌细胞,且在血清存在下维持高转染效率。体外实验表明MLP具有可忽略的细胞毒性。 Pin等[14]分别合成ε-聚赖氨酸接枝-琥珀酸-接枝的β环糊精-PEI(epsilon-polylysine-grafted-succinic acid-grafted-β-cyclodextrin-LMW PEI,PPC)和金刚烷官能化的聚乙二醇衍生物[adamantane-functionalized poly-(ethylene glycol) derivative,PEG-AD],PEG-AD被包裹在PPC中以形成复合物。该复合物能够与pDNA形成粒径小于200 nm的纳米颗粒,而且在不降低转染效率的情况下,复合物的细胞毒性低于支链PEI。
用甘露糖修饰PEI,如直接甘露糖化的PEI[15]、甘露糖化PEI偶联介孔二氧化硅纳米粒[16]和甘露糖基化壳聚糖接枝PEI[17]等,通过靶向甘露糖受体,可增强转染效率和免疫原性。Ke等[18]报道了一种氨基甲酸酯-甘露糖修饰的PEI(carbamate-mannose modified PEI,CMP)作为基因载体,该载体可将NF-κB(nuclear factor kappa-B)shRNA递送至目标肿瘤干细胞。结果显示CMP/对照shRNA纳米复合物在4T1鼠乳腺癌细胞中比未修饰的PEI/对照shRNA纳米复合物具有更低的细胞毒性和更高的转染效率。甘露糖修饰后的载体还被应用于光动力疗法和基因治疗的联合治疗中,以靶向癌细胞和肿瘤相关的巨噬细胞(tumor-associated macrophages,TAM),Chitgupi等[19]将PEI与光敏剂焦脱镁叶绿酸-α连接,并对其磺化以靶向凝集素表达细胞和甘露糖基化以靶向TAM,在凝集素和甘露糖受体表达细胞系中,表现出靶向性和治疗作用,经过这种修饰改性后的聚合物不仅提高了基因转染效率,还降低了细胞毒性。
普鲁兰糖因其良好的生物相容性被广泛应用于靶向药物和基因递送等领域。Wang等[20]通过将低分子量支链PEI接枝到琥珀酰化普鲁兰糖上合成非靶向基因载体P-PEI(Pullulan-PEI),进一步将叶酸(folic acid,FA)的羧基与PEI的氨基偶联来合成靶向基因载体P-PEI-FA,与PEI/pDNA相比,P-PEI/pDNA和P-PEI-FA/pDNA对不同细胞均有较低的细胞毒性;在含血清条件下,与Lipofamine 2000/pDNA和Lipofamine 2000/siRNA相比,P/PEI-FA/DNA在N/P比为6.25时显示出更高的基因转染效率,而P-PEI-FA/siRNA在N/P比12.5时表现出更好的基因沉默效果。
多糖直接修饰PEI得到的聚合物不但改善了PEI的生物相容性,而且在一定程度上提高其转染效率。此外,还可连接一些靶向基团,提高其靶向性和转染效率,增强治疗效果。
2 PEG修饰的PEI
用聚乙二醇(polyethylene glycol,PEG)修饰PEI后,可以屏蔽多余正电荷,减小PEI毒性。由于亲水性PEG链段的空间排斥效应,还可以提高复合物的稳定性,防止聚结,延长载体/基因复合物在血液中的循环时间,从而有利于复合物到达靶组织靶细胞,使载体具有更好的生物相容性和更高的转染效率[21-24]。研究发现[25],PEG化程度和PEG的分子量显著影响PEG-PEI的性质,25 kDa PEI经高PEG化程度和低PEG链长度修饰后可降低在肺细胞中的细胞毒性以及氧化应激反应。此外,通过PEG连接靶向配体,如叶酸、RGD肽、转铁蛋白、抗体、适体和多糖如半乳糖[26],可实现主动靶向递送。
Saqafi等[27]将PEI和PEG3500连接,然后将抗HER2的纳米抗体(Nbs)共价连接得到PEI-PEG-Nb免疫偶联物。结果显示,PEI聚合物与pDNA形成的复合物具有合适的粒径(123.4±7.4)nm和zeta电位(+4.2±1.8) mV。使用Nb-修饰的复合物在HER2阳性细胞系中转染效率高于未修饰的复合物,且与传统PEI聚合物相比,在两种HER2阳性细胞系中,PEI-PEG-Nb/pGL4.50的转染效率分别提高了1.6倍和4.8倍。
载有DNA纳米颗粒的多孔水凝胶也经常被用于基因递送领域。然而,在水凝胶内,载有DNA的高浓度复合物会聚集而影响其有效释放。为了减少多孔凝胶中DNA复合物聚集,Siegman等[28]利用PEG修饰PEI制备sPEG-PEI以减轻胶凝期间聚合物和骨架之间的电荷-电荷相互作用,与线性PEI(LPEI)聚合物相比,sPEG-PEI聚合物形成的复合物毒性更小且更稳定,其在透明质酸(hyaluronic acid,HA)凝胶内表现出更少的聚集。此外,sPEG-PEI复合物保留了与LPEI相当的转染能力。以上结果表明以PEG修饰PEI可以显著改善基于水凝胶支架介导的基因递送,并且在多基因递送系统的应用中显示出极好的前景。
3 低分子PEI衍生物
低分子PEI尽管毒性较小,但其较低的基因转染效率限制了其作为基因载体的应用。因此,通过对低分子量PEI的修饰,提高基因转染效率同时保持较低的细胞毒性也是目前研究的热点。
Fatemeh等[29]通过琥珀酸交联低分子量PEI,在保持其低毒性的同时提高转染效率。改性修饰的PEI能够压缩编码CD200(一种膜糖蛋白)的质粒DNA形成大小约为130 nm的复合物,在载体与质粒的比例为8时,CD200的表达水平最高,在体外神经退行性疾病模型SH-SY5Y细胞系中的表达增加了1.5倍。此外,体内成像结果显示纳米粒能穿过血脑屏障并进入脑室周围区域。
Pan等[30]合成了低分子量聚乙烯亚胺和聚噻吩的阳离子共聚物作为siRNA递送载体,聚噻吩的疏水性和刚性可以增强siRNA跨细胞膜和内体膜的转运,共聚物和siRNA之间形成的纳米复合物即使在摩尔比为1∶2时也能保持稳定,A549-luc细胞(稳转荧光素酶的人肺癌细胞)中的体外荧光素酶沉默实验证明,疏水性更强的共聚物/siRNA复合物实现了高效沉默且没有显著细胞毒性。
Johnson等[31]报道了氟化碳修饰的聚乙烯亚胺(PEI)用于siRNA递送,用不同长度的氟碳环氧化物官能化低分子量PEI,氟化碳修饰的化合物均能在体外诱导有效的基因沉默;与烃类似物相比,氟化碳修饰的载体除了具有极强的疏水性之外,还表现出疏脂性,结果显示其具有更高的细胞摄取和沉默能力。
此外,在PEI的基础上,为了实现高效安全的基因递送,Wagner E课题组创新的提出了一系列含有PEI片段序列的人工氨基酸片段[glutaryltriethylene tetramine(Gtt),glutaryl-tetraethylene pentamine(Gtp),succinoyltetraethylene pentamine(Stp)和succinoyl-pentaethylene hexamine(Sph)],这些人工氨基酸片段能以固相多肽合成的方法来构建系列多肽类似化合物。与PEI相比,保留了可质子化的序列提供正电荷和带负电的核酸发生静电吸附形成复合物,并促进胞内体逃逸过程。同时,这类化合物具有多肽的特性,各片段间通过酰胺键连接,在体内可降解,具有较好的生物相容性。此外,固相合成方便易行,他们不仅具有精确的结构,易于研究其构效关系,可为进一步结构优化提供信息,还能在特定位置引入特定的官能团,满足基因载体需要克服的重重障碍。经过不断地探索优化,目前该课题组已经合成了上千个多功能的化合物,通过改变空间结构和多种不同官能团的引入,系统性地考察了他们作为基因载体的应用,获得了一系列安全有效的基因载体,并建立了初步的构效关系[32-36],为基因递送系统的研究提供了新思路。
4 结语
PEI作为核酸递送领域中最经典的非病毒基因载体之一,一直是基因递送领域的研究热点,常被认为是DNA递送载体的黄金标准。PEI可诱导细胞自噬和破坏质膜的稳定,这可能与其细胞毒性密切相关,一定程度上限制了其在基因递送中的应用。针对PEI的化学结构修饰的主要利用PEI上的氨基与其他化合物的羧基形成酰胺键来实现。研究表明,采用多糖、小分子以及生物可降解片段对PEI进行结构修饰后,显示出优良的生物相容性,同时,可增强基因转染效率并降低毒性。此外,通过PEG和配体的修饰,除了减少PEI毒性,还赋予其靶向特定作用部位的能力。目前针对PEI的结构修饰仍处于基础研究阶段,目的在于提高转染效率、降低毒性,在其临床和产业化的应用上,还需要解决产率、稳定性、重现性和安全性等问题。基因递送载体的开发充满了机遇与挑战,开发高效低毒的基因载体是实现基因治疗的关键,也是基因载体领域的发展方向,基于PEI的非病毒基因递送系统的研究,为基因载体的开发提供了依据,也为基因治疗的研究奠定了基础。
