金磁微粒模拟酶检测食品中的葡萄糖
2019-12-04韩博林关桦楠龚德状遇世友刘晓飞
韩博林,关桦楠*,龚德状,遇世友,刘晓飞,张 娜
(哈尔滨商业大学食品工程学院,黑龙江 哈尔滨 150076)
天然活性酶由于其催化效率高和特异性强已被广泛应用于诸多领域。但因其在过酸、过碱条件下容易失活、不易保存、价格较昂贵等诸多限制因素,寻找既具有天然酶的催化活性又能克服天然酶不足的模拟酶成为研究热点。随着纳米技术的高速发展,许多纳米材料已被证实具有固有的过氧化物酶活性,同时一些复合纳米材料展现出更优良的模拟酶活性在诸多领域应用广泛[1-6]。其中Fe3O4磁性纳米粒子具有内在的过氧化物酶活性,它结合了磁性分离、合成简单、成本低的优点。但是,暴露的纳米颗粒容易被氧化,在Fe3O4表面官能化具有过氧化物酶活性的其他纳米颗粒可以解决这个问题,并且提高复合纳米颗粒的过氧化物酶样活性。金磁微粒是一种表面包含金纳米粒子,内核为磁性材料的复合纳米微粒[7-8]。在快速富集分离的基础上,还具有良好的单分散性、稳定性、生物适应性和光学性能,因此被广泛应用于生物催化、生物医学、食品安全检验等诸多领域[9-13]。单金属Fe3O4纳米粒子和金纳米粒子(AuNPs)均表现出优异的过氧化物酶活性[14-15]。因此,将AuNPs负载到Fe3O4纳米粒子表面合成复合微粒,不仅可以提升其过氧化物酶活性,而且增强了稳定性和生物相容性,有利于纳米粒子的分离和回收。与天然酶相比纳米材料模拟酶具有稳定、低成本、易保存的优点使其在食品分析与检测方面具有广泛的应用。葡萄糖是一种多羟基醛,其在生命科学及食品领域具有非常重要意义与地位。葡萄糖检测方法主要有色谱法、光谱法和电化学法等[16-18]。但是,这些方法都有着各自对于仪器、操作人员、成本等的限制因素。因此构建一种高灵敏、高选择性、快速简便的检测新方法有着重要的应用价值[19-21]。本实验采用水热法制备Fe3O4纳米粒子,并通过表面氨基化与金纳米粒子自组装方法构建金磁微粒(Fe3O4@Au),利用其模拟过氧化物酶活性构建葡萄糖检测体系。体系中葡萄糖氧化酶(glucose oxidase,GOx)作用于葡萄糖反应产生H2O2,Fe3O4@Au模拟酶催化反应产物H2O2与过氧化物酶底物二按盐2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)产生显色反应。体系以此原理建立了高灵敏、高选择性、可视化检测葡萄糖含量的简便方法,相关结果将为拓宽纳米材料模拟酶在食品检测中的应用提供一定的参考。
1 材料与方法
1.1 材料与试剂
新鲜苹果 哈尔滨市家乐福超市。
GOx(TypeX-SG7141-50KU, from Aspergillus niger)美国Sigma-Aldrich公司;FeCl3·6H2O、NaAc·3H2O、PEG-4000、葡萄糖、ABTS 天津市科密欧化学试剂有限公司;3-氨丙基三乙氧基硅烷((3-aminopropyl)triethoxysilane,APTES) 淮安和元化工有限公司;氯金酸 国药集团化学试剂有限公司;本实验所用试剂均为分析纯。
1.2 仪器与设备
水热反应釜 西安洪辰仪器厂;恒温振荡摇床金坛市精工仪器设备有限公司;MAGNA-IR560E.S.P型傅里叶变换红外光谱仪 美国Nicolet公司;phi-5000Versaprobe型X射线光电子能谱仪 美国ULVCAPHI公司;UV2250型紫外-可见光分光光度计 北京桑翌科技发展有限公司;H-7500型透射电子显微镜 日本电子株式会社;BT-9300H型激光粒度分布仪 美国麦克仪器公司;9600型振动磁强计 美国LDJ Electronics公司。
1.3 方法
1.3.1 Fe3O4纳米粒子的制备
将1.35 g的FeCl3·6H2O溶于40 mL乙二醇中,依次加入3.6 g的NaAc·3H2O与1.0 g的PEG-4000,形成均匀溶液后再搅拌30 min。然后将溶液倒入50 mL水热反应釜中,200 ℃保持8 h,反应结束后冷却至室温,所得黑色的产物分别用乙醇和水各洗涤3 次[22]。
1.3.2 金纳米粒子的绿色制备
取200 mL的蒸馏水加热至80 ℃,加入100 g葡萄皮浸泡30 min。将浸泡液于4 000 r/min离心3 min,取上清液,以此上清液作为母液。使用去离子水稀释母液获得母液体积分数为20%的葡萄皮工作液200 mL,于冰箱4 ℃保存。取4 ℃预冷的氯金酸溶液20 mL置于烧杯中,伴随磁力搅拌器温和搅动2 min后,迅速加入20%的葡萄皮工作液5 mL,随即观察颜色的变化,即由黄色变为紫色再变为酒红色,当体系颜色出现酒红色时,搅拌速率提升,20 min后结束反应,将反应液置于冰箱4 ℃条件下保存[23-24]。
1.3.3 Fe3O4@Au的制备
参考文献[25-26]方法并进行改良。取2 g制备的Fe3O4纳米粒子加入50 mL乙醇溶液(体积分数为20%),超声1 min,逐滴加入1 mL APTES,在恒温振荡摇床中以120 r/min反应8 h后得到浅棕色的悬浊液,产物即为氨基化修饰后的Fe3O4纳米微粒。产物用20%乙醇溶液磁分离清洗3 次,60 ℃烘干备用。取上述制备的氨基修饰的Fe3O4纳米微粒2 g边搅拌边加入20 mL所制备的金纳米粒子溶液,混合溶液由棕色逐渐变淡,低速搅拌反应12 h后,获得Fe3O4@Au。
1.3.4 表征
将制备的磁性材料粉末用适量的蒸馏水稀释,置于超声波清洗器上超声振荡使其均匀分散。Fe3O4@Au的磁学性能通过振动磁强计室温下测量。利用X射线光电子能谱对合成的复合微粒进行分析。利用傅里叶变换红外光谱仪进行分析,将合成的干燥纳米粒子粉末与KBr混合,充分研磨后压片,在红外光谱仪下进行表征,根据得到的红外光谱图对此纳米粒子产品进行分析。
1.3.5 单因素试验优化Fe3O4@Au检测葡萄糖的体系
1.3.5.1 Fe3O4@Au悬浮液质量浓度对葡萄糖检测体系的影响
将100 μL葡萄糖氧化酶(1 mg/mL)和300 μL(10 mmol/L)的葡萄糖标准液加入到600 μL磷酸缓冲盐溶液(phosphate buffer saline,PBS)(10 mmol/L、pH 7.0)中,37 ℃水浴孵育30 min[18]。反应结束后向上述反应液中加入100 μL不同质量浓度的Fe3O4@Au悬浮液(0.01、0.05、0.1、0.15 g/mL和0.2 g/mL),200 μL ABTS(25 mmol/L)溶液和3 mL HAc-NaAc缓冲溶液(0.1 mol/L、pH 4.4),将混合溶液在50 ℃水浴锅中反应30 min后(水浴过程中每过1 min温和倒转1 次,下同)取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm波长处吸光度,重复实验3 次。
1.3.5.2 反应温度对检测体系的影响
将100 μL(1 mg/mL)GOx和300 μL(10 mmol/L)的葡萄糖标准液加入到600 μL PBS(10 mmol/L、pH 7.0)中,37 ℃水浴孵育30 min。反应结束后向上述反应液中加入100 μL的Fe3O4@Au悬浮液(0.05 g/mL),200 μL ABTS(25 mmol/L)溶液和3 mL HAc-NaAc缓冲溶液(0.1 mol/L、pH 4.4),将反应体系放置于30、40、50、60 ℃和70 ℃水浴锅中反应30 min后取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm波长处吸光度,重复实验3 次。
1.3.5.3 反应时间对检测体系的影响
将100 μL(1 mg/mL)GOx和300 μL(10 mmol/L)的葡萄糖标准液加入到600 μL PBS(10 mmol/L、pH 7.0)中,37 ℃水浴孵育30 min。反应结束后向上述反应液中加入100 μL的Fe3O4@Au悬浮液(0.05 g/mL),200 μL的ABTS(25 mmol/L)溶液和3 mL HAc-NaAc缓冲溶液(0.1 mol/L、pH 4.4),将反应体系放置于50 ℃水浴锅中反应(10、20、30、40 min和50 min)后取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm波长处吸光度,重复实验3 次。
1.3.6 正交试验设计优化检测体系
将100 μL(1 mg/mL)GOx和300 μL(10 mmol/L)的葡萄糖标准液加入到600 μL PBS(10 mmol/L、pH 7.0)中,37 ℃水浴孵育30 min。反应结束后向上述反应液中加入100 μL不同质量浓度的Fe3O4@Au悬浮液,200 μL ABTS(25 mmol/L)溶液和3 mL HAc-NaAc缓冲溶液(0.1 mol/L、pH 4.4),将混合溶液在不同温度水浴锅中反应不同时间后(水浴过程中每过1 min温和倒转一次)取出,采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm波长处吸光度,重复实验3 次。确定因素影响的主次顺序及优选方案。
1.3.7 葡萄糖检测体系工作曲线、检出限、回收率和选择性的测定
在最适质量浓度、最适时间、温度体系下将100 μL(1 mg/mL)GOx和300 μL(1、2.5、5、7.5、10、15、20 mmol/L)的葡萄糖标准液加入到600 μL PBS(10 mmol/L、pH 7.0)中,37 ℃水浴孵育30 min。反应结束后向上述反应液中加入100 μL的Fe3O4@Au悬浮液,200 μL ABTS(25 mmol/L)溶液和3 mL HAc-NaAc缓冲溶液(0.1 mol/L、pH 4.4),水浴一段时间后采用磁铁将纳米Fe3O4@Au固定在离心管底部,静置1 min,吸取上清液3 mL,以蒸馏水为空白,测定420 nm处吸光度,重复实验3 次。根据不同质量浓度葡萄糖与吸光度绘制标准曲线,计算最低检出限。选择10、20 mmol/L的葡萄糖标准液加入到上述检测体系,测定其吸光度,重复实验6 次,测定其回收率及精密度。在正交试验优化的条件下向检测体系中分别加入1 mol/L乳糖、蔗糖和麦芽糖,水浴一段时间后,观察体系中颜色变化,确定检测体系的选择性。
1.3.8 实际样品检测
样品的预处理苹果:果蔬切碎,研磨成均匀糊状,用干净的烧杯称取约1 g,加入约20 mL去离子水溶解,并超声30 min,然后用布氏漏斗过滤两次,再转移至100 mL容量瓶定容,混匀后用0.45 μm的滤膜过滤一次,最后转移至100 mL容量瓶中待用。加入不同浓度的葡萄糖标准液,重复测定5 次,考察检测体系的加标回收率,并评价检测体系的精确度和重复性。
1.4 数据处理
每组数据均重复5 次,利用Origin 8.0软件处理数据作图。采用DPS 7.05软件对数据进行分析。
2 结果与分析
2.1 Fe3O4@Au的表征

图1 Fe3O4@Au合成示意图Fig. 1 Schematic diagram of the preparation of Fe3O4@Au
本实验采用水热法制备Fe3O4纳米粒子,并通过对其表面氨基化与金纳米粒子自组装方法构建Fe3O4@Au,合成示意图如图1所示。采用硅烷偶联剂APTES对Fe3O4纳米粒子进行表面氨基化改性,APTES改性的目的是在磁性粒子的表面形成一层分子结合剂,并通过在介孔孔道中引入带正电荷的氨基,利用中和反应的机制并通过静电力、氢键等相互作用可以提高对表面带有负电荷的金纳米粒子的吸附结合效率,以此原理构建组装型Fe3O4@Au。

图2 氨基化Fe3O4纳米粒子傅里叶红外光谱图Fig. 2 Infrared spectrum of aminated Fe3O4 nanoparticles
对合成的氨基化Fe3O4纳米粒子进行傅里叶红外光谱分析,从图2可知,在1 610、1 659 cm-1和2 938 cm-1波数处分别为C=C、C=O和C—H的特征峰。与此同时,在1 835 cm-1和1 483 cm-1处有吸收波长,这是氨基的特征吸收波长,因而证明了氨基的存在,同时在3 508 cm-1左右的地方有亚甲基的吸收峰,这是APTES基团特征峰,该结果表明,APTES已成功地被接枝到Fe3O4纳米粒子的表面上,使得其表面发生氨基化改性,并带有适量的正电荷。
根据Fe3O4纳米粒子和氨基化Fe3O4纳米粒子磁学性质结果可知,在300 K的磁滞回线(Oe=79.578 A/m),纳米Fe3O4和氨基化Fe3O4纳米粒子的磁饱和强度值(M)分别为78 emu/g和59 emu/g,Fe3O4纳米粒子和功能化Fe3O4纳米粒子均表现出了很好的超顺磁性和磁场感应性,说明氨基化作用不会显著影响磁球的超顺磁性特点。与纳米Fe3O4比较,氨基化Fe3O4纳米粒子的磁饱和,可有效防止纳米磁球聚合,使得纳米磁球能够稳定地分散在水溶液中。

图3 金纳米粒子的粒径分布Fig. 3 Particle size distribution of gold nanoparticles
由图3可知,金纳米粒子粒径呈正态分布,主要分布在7~9 nm范围内,占整个分布体系的79%,平均粒径达到(7.8±0.4)nm。实验结果说明利用绿色还原法制备的金纳米粒子平均尺寸较小,其催化活性更高,在负载到氨基化Fe3O4纳米粒子表面合成复合微粒后,可以产生协同作用进一步提升纳米微粒的过氧化物酶活性。
基于静电自组装法,采用氨基化的Fe3O4纳米粒子构建Fe3O4@Au。见图4,X射线光电子能谱分析结果表明,所构建的Fe3O4@Au分别在4f位点和2p位点呈现出了Au和Fe的能谱特征峰,其中,Fe(2p3/2)和Fe(2p1/2)结合能分别为711.08 eV和724.48 eV,表明Fe的来源是Fe3O4;Au(4f7/2)和Au(4f5/2)结合能分别为83.78 eV和87.48 eV,表明Au的来源为零价态的单质Au。结果表明,基于自组装法,金纳米粒子已成功结合在氨基化的Fe3O4纳米粒子表面。

图4 Fe3O4@Au的XPS谱图Fe(2p)(A)和Au(4f)(B)Fig. 4 XPS spectra in the regions of Fe (2p) (A) and Au (4f) (B) for Fe3O4@Au
如图5所示,Fe3O4纳米粒子的表面吸附有密集的金纳米粒子,结果表明氨基化的磁性材料可以固载金纳米粒子。综上所述,实验结果表明,基于自组装法,已成功构建出Fe3O4@Au。利用振动样品磁强计测量Fe3O4@Au的磁滞回线,磁学性质分析结果表明,其依然具有超顺磁性,磁饱和强度值为43 emu/g。说明包覆Au的含量升高会导致复合微粒磁化强度的轻微降低,这一结论和其他同类磁性纳米复合微粒的磁学性质一致[26]。

图5 Fe3O4@Au透射电子显微镜图片(×40 000)Fig. 5 TEM image of Fe3O4@Au (× 40 000)
2.2 模拟酶体系检测葡萄糖单因素试验
2.2.1 Fe3O4@Au悬浮液质量浓度对检测体系的影响
体系中Fe3O4@Au表现出过氧化物模拟酶催化活性,能够有效催化H2O2氧化ABTS发生显色反应,基于此,结合GOx与葡萄糖反应生成H2O2的原理,考察紫外-可见光吸收光谱于420 nm波长处(ABTS的特征峰)的吸光度,间接检测体系中的葡萄糖。基于纳米材料模拟酶检测葡萄糖原理如图6所示。孵育反应中葡萄糖在葡萄糖氧化酶的作用下生成H2O2,在Fe3O4@Au模拟过氧化物酶活性的催化下,过氧化物酶显色底物ABTS颜色由无色变成绿色,以此原理检测体系中的葡萄糖。
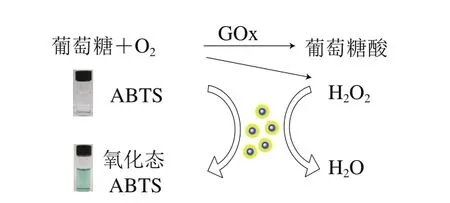
图6 检测葡萄糖原理图Fig. 6 Schematic diagram of glucose detection
首先,考察Fe3O4@Au混悬液质量浓度对检测体系的影响。由图7A可知,质量浓度在0.01~0.1 g/mL范围内时,随质量浓度的增加吸光度呈平稳上升趋势。添加量在0.1~0.15 g/mL时,反应速率变大。添加量在0.15~0.2 g/mL范围内时,吸光度缓慢平稳下降。由此可知,Fe3O4@Au混悬液质量浓度为0.15 g/mL时反应体系检测效果最好。结果表明,在以下正交试验优化中,Fe3O4@Au混悬液的质量浓度取0.1、0.15 g/mL和0.2 g/mL较为适合。

图7 单因素试验条件对检测体系的影响Fig. 7 Effect of various factors on the detection system investigated by one-factor-at-a-time method
2.2.2 催化温度对检测体系的影响
由图7B可知,当温度在30~40 ℃范围内时,吸光度稳定上升,40~50 ℃范围内,反应速率变大,当温度在50~70 ℃范围内时反应速率明显下降。结果表明,吸光度随温度的提高呈上升趋势,温度越高检测体系效果越好。考虑到传感系统其实用性,反应温度过高不利于其即时检测,同时在50~70 ℃范围内,体系反应速率变缓,基本已经达到最优的反应效果。为此选择实验设计中吸光度最好的3 个水平参与正交试验设计优化。同时随着反应温度的升高,模拟酶的相对活性逐渐增加,表明在较宽的温度范围内,Fe3O4@Au模拟过氧化物酶具有较好的催化效果。
2.2.3 催化时间对检测体系的影响
如图7C所示,随着反应时间的不断延长,吸光度呈不断上升的趋势。时间在10~20 min时,吸光度缓慢上升,在20~30 min时,反应速率轻微下降,在30~40 min时,吸光度开始平稳上升。在40~50 min时,反应速率明显下降,反应进程变慢。结果表明,在一定的时间内,质量浓度和温度相同时,检测葡萄糖的效果随反应时间的延长而增加。在40~50 min范围内反应速率变慢,检测体系反应效果基本达到最优,过长的反应时间不利于其快速即时检测,因此选择50 min为其最优的反应时间,其检测响应效果良好,并在正交试验优化时选择反应时间为30、40 min和50 min。
2.3 正交试验结果

表1 正交试验设计及结果Table 1 Orthogonal array design with experimental results for optimization of detection conditions
由表1可知,各因素对检测葡萄糖体系影响主次顺序为:D>B>A,即催化时间>催化温度>Fe3O4@Au混悬液质量浓度。通过极差分析确定的最优方案组合为:A2B3D3,即Fe3O4@Au混悬液质量浓度0.15 g/mL、催化温度70 ℃、催化时间50 min。综合上述分析,可以说明反应时间是影响检测体系的主要因素,反应温度和Fe3O4@Au混悬液浓度对反应体系也有相应的影响。以正交试验结果最优方案进行葡萄糖检测,重复实验5 次,吸光度平均值为0.352,相对标准偏差为2.16%。
2.4 葡萄糖检测体系的响应效果
2.4.1 最低检出限
在正交优化检测条件下进行实验,配制不同浓度的葡萄糖溶液,在Fe3O4@Au模拟过氧化物酶活性的基础上结合葡萄糖在GOx作用下产生H2O2,并与ABTS产生显色反应的原理,扫描体系的紫外-可见光吸收光谱,通过光谱的变化评价体系反应的进程。如图8A所示,在420 nm波长出现ABTS的最大吸收峰,葡萄糖浓度为1 mmol/L时,吸光度最小,吸光度与体系中葡萄糖浓度呈正比。结果显示,检测体系对葡萄糖响应效果良好。对不同浓度的葡萄糖做标准曲线,结果如图8B所示,葡萄糖在1~20 mmol/L范围内具有良好的线性关系,标准曲线回归方程为y=28.423x+0.098 2,相关系数R2值为0.992 5,根据方程计算(3s/b)检出限为2.45 μmol/L。根据本研究中所获得的检出限,与其他基于纳米材料的检测葡萄糖方法进行比较,结果见表2。由表2可知,本研究的最低检出限为2.45 μmol/L,与其他研究中检测葡萄糖相比具有相对较低的检出限,说明此基于Fe3O4@Au模拟酶性质检测葡萄糖的检测方法具有良好的灵敏度。

图8 葡萄糖检测体系响应效果Fig. 8 Response curves of glucose detection system
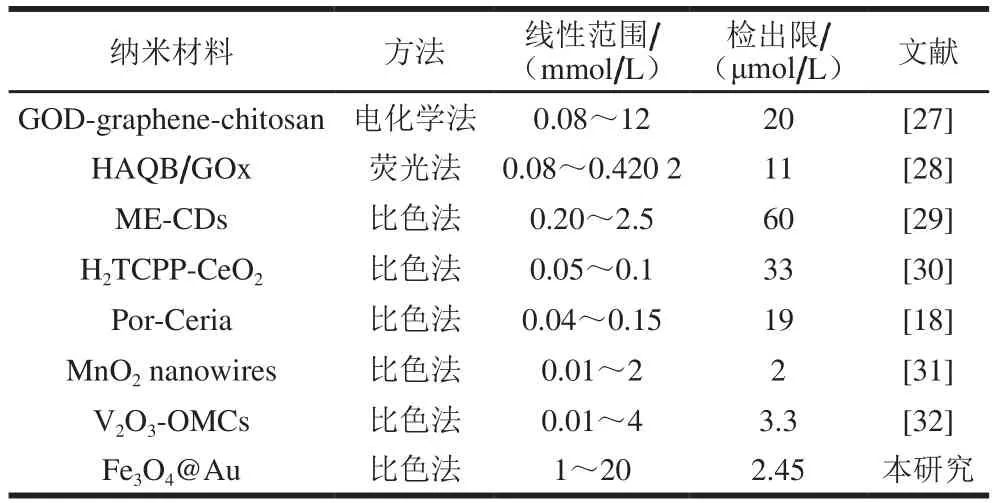
表2 基于纳米材料的葡萄糖测定方法的比较Table 2 Comparison of nanomaterial-based methods for determination of glucose content
2.4.2 检测体系选择性

图9 葡萄糖检测体系的选择性Fig. 9 Selectivity of glucose detection system
比色检测体系的一个重要指标就是检测其选择性,本研究选择含有0.01 mol/L葡萄糖的体系作为参照,与3 种食品中常见的糖类(乳糖、蔗糖和麦芽糖)做对比研究,评估模拟酶检测葡萄糖体系的特异性。每种糖类的浓度为葡萄糖浓度的100 倍,即1 mol/L。如图9所示,葡萄糖测定具有的特异性和选择性,相对于0.01 mol/L葡萄糖、1 mol/L蔗糖、1 mol/L的乳糖和1 mol/L麦芽糖不干扰测定。因此,本比色检测方法对于葡萄糖检测具有高的选择性。葡萄糖吸光度和之前对应浓度的实验基本一致,也说明了此体系具有一定的重复性,响应效果较好,可望实现实际食品样品中葡萄糖的测定。
2.4.3 实际样品检测结果
在相同反应体系下测定0.01 mol/L和0.02 mol/L葡萄糖标准溶液的吸光度,带入标准曲线回归方程,对检测体系进行回收率评价,回收率分别为105%和94.5%。重复测定5 次,相对标准偏差为2.29%和2.15%,说明该模拟酶检测体系具有良好的精密度。在苹果样品的浸提液中加入葡萄糖标准液,以确定此检测体系对样品中不同浓度葡萄糖的加标回收率和精密度,每组实验重复测定5 次,结果见表3。结果表明,加标回收率在96%~104%之间,且组内相对标准偏差皆在5%以下,说明该模拟酶检测体系具有良好的加标回收率和精密度,并且具有良好的重复性,可望实现更多实际样品中葡萄糖的检测。

表3 检测实际样品中不同浓度葡萄糖的回收率和精密度Table 3 Recoveries and precision for real samples spiked at different concentrations of glucose
3 结 论
本实验利用纳米模拟酶活性建立高选择、灵敏、快速检测食品中葡萄糖含量的比色检测体系。采用水热法制备Fe3O4纳米粒子,并绿色还原法制备金纳米粒子,再利用氨基化法制备出了Fe3O4@Au微粒。利用其模拟过氧化物酶特性建立了葡萄糖检测体系,优化体系并对其葡萄糖的检测性能进行评估。研究结果表明,所制备的Fe3O4@Au微粒具有良好的过氧化物模拟酶活性,检测方法具有较高的灵敏度、精确度、选择性并且操作简便。相关结果将为食品中葡萄糖检测方法的改良积累基础资料。本研究将为拓宽纳米材料模拟酶在食品检测中的应用提供参考。
