沙门氏菌中与萘啶酮酸和环丙沙星抗性相关基因及突变的检测分析
2019-12-04黄巾凌王嘉炜牛沁雅廉鲁昕尹明远杨保伟
黄巾凌,王嘉炜,牛沁雅,廉鲁昕,尹明远,武 运,杨保伟,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
沙门氏菌(Salmonella)是一种非常重要的人畜共患病病原菌,该菌宿主谱较广,不仅可以导致人患病,家畜、野生哺乳动物、爬行类动物、鸟类甚至昆虫等均可感染发病。沙门氏菌病的发生也容易激发其他病原和并发症,导致病情加重,甚至死亡[1]。据报道,在日本和美国等发达国家由沙门氏菌引起的食物中毒占到各类细菌性食物中毒的40%~80%,我国这一比例则高达90%[2-3]。在我国,每年约3亿 人因感染沙门氏菌而患病,达病原菌食源性疾病总数的70%~80%[4]。因此,沙门氏菌一直是人们关注的焦点。随着抗生素的广泛使用,沙门氏菌的耐药问题日趋严重,其耐药水平也越来越高,给人类和动物健康带来极大的危害[5-7]。
氟喹诺酮类抗生素是沙门氏菌预防和临床治疗的最主要药物之一,而qnrA、qnrB、qnrS和aac(6’)-Ib等基因的编码产物则是导致沙门氏菌对喹诺酮和氟喹诺酮类抗生素产生抗性的重要原因[8-10]。目前,国外对畜、禽及其肉制品和食品源沙门氏菌耐药性研究较多,对其耐药性分子机理研究较为深入[8-9]。 在我国,虽然马国柱等[10]研究了陕西地区食源性沙门氏菌,王嘉炜等[11]研究了陕西等4 省市鸡肉源沙门氏菌对(氟)喹诺酮类抗生素的耐药性及其相关耐药基因,但这些研究涉及的菌株数量和调查范围均相对较小。
本研究检测分析了2007、2008、2010、2011、2013年和2014年分离于我国陕西、新疆和广东等9 省(市)食源性沙门氏菌中与萘啶酮酸和环丙沙星耐药相关的部分基因,探讨了基因的检出和耐药性的关联性,可为保障食品安全提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
814 株沙门氏菌分别于2007、2008、2010、2011、2013年和2014年分离于采集自新疆、广东、广西、福建、上海、陕西、北京、河南和四川农贸市场和超市的零售鸡肉、猪肉、牛肉、羊肉、鸭肉、鱼肉和奶粉样品以及医院的临床生物样品(人粪)。菌株的分离和鉴定按照Cui Shenghui等[12]方法进行。鼠伤寒沙门氏菌(S. typhimurium)LT2,药敏性测定用标准质控菌株Escherichia coli ATCC25922、E. coli ATCC35218和Enterococcus faecalis ATCC29212为中国药品生物制品检定研究院惠赠。
1.1.2 培养基
Luria-Bertani(LB)营养琼脂、Mueller Hinton(MH)琼脂和半固体琼脂培养基购于北京陆桥技术股份有限公司。
1.1.3 抗生素与试剂
2 种(氟)喹诺酮类抗生素(萘啶酮酸和环丙沙星)美国Sigma公司;TaqDNA聚合酶、dNTPmix、10×PCR Buffer、MgCl2、DL 2000 DNA Ladder 宝生物工程(大连)有限公司。
1.1.4 聚合酶链式反应(polymerase chain reaction,PCR)扩增用引物
qnrA、qnrB、qnrS、aac(6’)-Ib、gyrA、parC、qepA、oqxA和oqxB基因扩增用引物由北京奥科鼎盛生物科技有限公司合成(表1)。

表1 PCR扩增和测序用引物Table 1 Sequences of primers used for PCR amplification and sequencing
1.2 仪器与设备
超净工作台 苏州苏洁净化设备有限公司;高压灭菌锅 日本Tomy公司;超纯水处理器 美国Millipor公司;-40 ℃低温冰箱、-80 ℃低温冰箱 日本Sanyo公司;恒温摇床 上海智成分析仪器制造有限公司;移液器、高速离心机 德国Eppendorf公司;Mycycler PCR仪、DNA电泳、凝胶成像系统 美国Bio-Rad公司;恒温水浴仪 宁波赛福实验仪器厂。
1.3 方法
1.3.1 沙门氏菌血清型鉴定
沙门氏菌血清型鉴定在河南省疾病预防控制中心进行。使用泰国S&A公司生产的沙门氏菌诊断血清,采用玻片凝集法,按照操作说明书分别确定沙门氏菌的O抗原和H抗原类型,得到抗原式后查阅White-Kauffmann抗原表,确定沙门氏菌的血清型。
1.3.2 药敏性测定
采用临床实验室标准化委员会(Clinical and Laboratory Standards Institute,CLSI)[19]推荐的琼脂稀释法测定供试抗生素对沙门氏菌的最小抑菌浓度,按照CLSI标准判读药敏结果并确定耐药表型。药敏测定中使用E. coliATCC25922和ATCC35218、E. faecalisATCC29212作为标准质控菌株。
1.3.3 PCR扩增和基因序列测定分析
采用煮沸法制备PCR用DNA模板[20]。PCR条件:94 ℃、10 min预变性;94 ℃、1 min变性,72 ℃、1 min延伸,35 个循环;72 ℃、10 min。不同基因扩增时退火温度的选择由相应引物序列而定。2 μL PCR产物经琼脂糖凝胶电泳分离检测后,在凝胶成像系统拍照留存。gyrA和parC基因PCR粗产物在低温条件下送至上海桑尼生物科技有限公司测序,测定得到的DNA序列使用Primer premier 5软件翻译成氨基酸后提交基因库,采用在线比对软件BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)进行比对,确定标准菌株鼠伤寒沙门氏菌LT2的gyrA和parC序列和基因库序列完全吻合后,分析比对供试菌相应的氨基酸序列,确定突变点和氨基酸突变类型。
1.4 数据统计分析
利用Microsoft Office Excel 2010对数据进行基本处理和作图,使用IBM SPSS Statistics 20.0进行多因素方差分析(Duncan法,差异显著,P<0.05和多元回归分析。
2 结果与分析
2.1 沙门氏菌的血清型
814 株沙门氏菌共涵盖83 个血清型,其中鼠伤寒沙门氏菌、肠炎沙门氏菌、印第安纳沙门氏菌和德比沙门氏菌等血清型检出率较高。阿贡纳沙门氏菌、哈达尔沙门氏菌、汤普森沙门氏菌和伦敦沙门氏菌等19 种血清型检出率在0.5%~5%之间。埃森沙门氏菌和奥尔巴尼沙门氏菌等60 种血清型检出率在0.1%~0.5%之间(表2)。

表2 沙门氏菌血清型分布(n=814)Table 2 Distribution of Salmonella serovar (n= 814)
2.2 沙门氏菌对萘啶酮酸和环丙沙星的药敏性
814 株沙门氏菌中,553 株(67.94%)对萘啶酮酸产生抗性,219 株(26.90%)对环丙沙星耐药。其中,耐萘啶酮酸但环丙沙星敏感(NAL+CIP-)型菌株检出率最高(41.03%),显著(P<0.05)高于对萘啶酮酸和环丙沙星均敏感(NAL-CIP-)型菌株的检出率(32.06%)以及同时耐受萘啶酮酸和环丙沙星(NALCIP-)菌株的检出率(26.90%)(图1)。

图1 耐(氟)喹诺酮类抗生素沙门氏菌检出率(n=814)Fig. 1 Prevalence of different fluoroquinolones resistance phenotypes in Salmonella (n = 814)
2.3 沙门氏菌中与(氟)喹诺酮类抗生素耐药相关基因的检出率

图2 7 种基因在沙门氏菌中的检出率(n=814)Fig. 2 Prevalence of seven fluoroquinolones resistance genes in Salmonella (n = 814)
如图2所示,814 株沙门氏菌中,oqxB检出率(31.82%)最高,显著大于qnrA(24.94%)、oqxA(24.57%)、qnrB(24.45%)、qnrS(10.32%)和qepA(3.07%)阳性菌株的检出率(P<0.05),与aac(6’)-Ib阳性菌株的检出率(27.52%)间无显著差异。

图3 7 种基因在不同耐药表型沙门氏菌中的检出率Fig. 3 Prevalence of seven fluoroquinolones resistance genes in Salmonella with different fluoroquinolones resistance phenotypes
如图3所示,219 株NAL+CIP+型沙门氏菌中,aac(6’)-Ib阳性菌株的检出率(48.40%)与oqxB阳性菌检出率(43.83%)间无显著性差异,但其2者均显著大于oqxA(24.66%)、qnrB(15.98%)、qnrA(13.24%)、qnrS(8.68%)和qepA(0.91%)阳性菌株的检出率(P<0.05)。334 株NAL+CIP-型菌株中,oqxB(26.35%)检出率最高;其次为qnrB和qnrA,检出率均为22.75%;aac(6’)-Ib阳性菌检出率为20.36%;该4 种基因阳性菌株的检出率间无显著性差异。261 株NAL-CIP-型菌株中,qnrA(37.93%)检出率最高,但与qnrB(34.48%)和oqxA(31.42%)阳性菌检出率间无显著性差异;该3 种基因阳性菌株的检出率均显著高于aac(6’)-Ib(19.16%)、qnrS(9.20%)和qepA(7.66%)阳性菌检出率(P<0.05)。
2.3.1 5 种检出率较高血清型沙门氏菌中相关耐药基因检出情况
oqxA在德比沙门氏菌中的检出率(45.24%)最高,其次为阿贡纳沙门氏菌(37.50%)、鼠伤寒沙门氏菌(28.57%)、肠炎沙门氏菌(27.22%)和印第安纳沙门氏菌(24.07%),5 种血清型沙门氏菌中oqxA阳性菌的检出率间无显著性差异;图4A中,oqxA在NAL+CIP+型鼠伤寒沙门氏菌中的检出率(53.57%)显著高于在NAL-CIP-型(28.77%)和NAL+CIP-型(21.05%)中的检出率(P<0.05),在不同耐药表型的德比沙门氏菌、印第安纳沙门氏菌和阿贡纳沙门氏菌中的检出率间均无显著性差异。oqxB在印第安纳沙门氏菌中的检出率(45.37%)显著高于在阿贡纳沙门氏菌(31.35%)和鼠伤寒沙门氏菌(27.04%)中的检出率(P<0.05),与德比沙门氏菌(45.24%)和肠炎沙门氏菌(41.77%)中的检出间无显著性差异;图4B显示在具不同氟喹诺酮类抗生素耐药表型鼠伤寒沙门氏菌和肠炎沙门氏菌中的检出率间存在显著性差异,在其他血清型不同耐药表型菌株中的检出率间无显著性差异。qepA在肠炎沙门氏菌中检出率(5.70%)最高,其次为德比沙门氏菌(4.76%)、阿贡纳沙门氏菌(3.13%)和鼠伤寒沙门氏菌(2.55%)。aac(6’)-Ib在印第安纳沙门氏菌中的检出率(50.93%)显著高于在肠炎沙门氏菌(21.52%)、阿贡纳沙门氏菌(15.63%)和德比沙门氏菌(14.29%)中的检出率(P<0.05),与鼠伤寒沙门氏菌中的检出率(39.80%)则无显著性差异。qnrA在阿贡纳沙门氏菌中的检出率(43.75%)显著(P<0.05)高于在德比沙门氏菌(21.43%)、鼠伤寒沙门氏菌(14.80%)和印第安纳沙门氏菌(12.96%)中的检出率,与肠炎沙门氏菌(33.54%)中的检出率间无显著性差异。qnrB在阿贡纳沙门氏菌中的检出率(25.00%)最高,其次为肠炎沙门氏菌(24.68%)、德比沙门氏菌(23.81%)、鼠伤寒沙门氏菌(15.31%)和印第安纳沙门氏菌(12.96%),在5 种血清型菌株中的检出率间无显著性差异。qnrS在德比沙门氏菌中的检出率(11.90%)最高,其次为鼠伤寒沙门氏菌(8.67%)、肠炎沙门氏菌(6.96%)和印第安纳沙门氏菌(6.48%)。图4C~G也可看出不同种血清型不同耐药性之间的具体差异性。
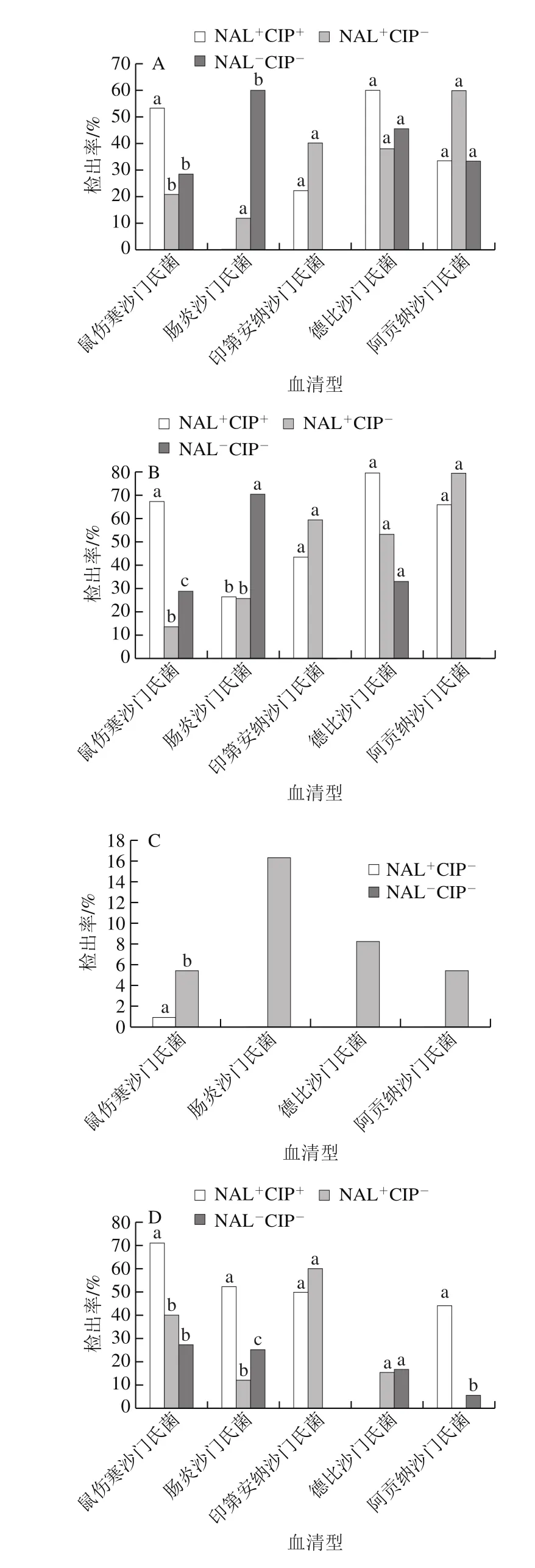
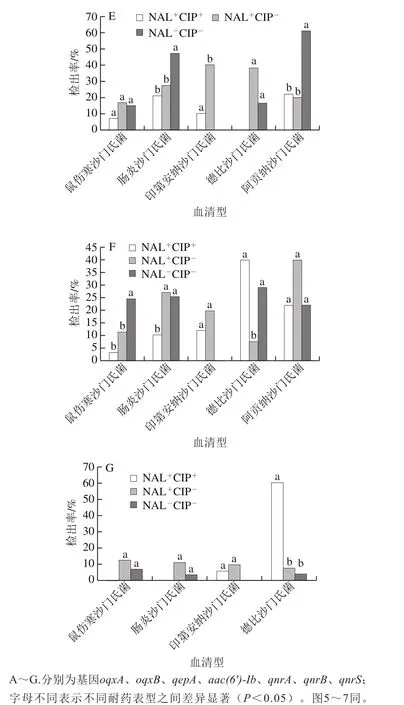
图4 5 种常见血清型不同耐药表型沙门氏菌中耐药基因检出率Fig. 4 Prevalence of seven fluoroquinolones resistance genes in five common Salmonella serotypes with different rresistance phenotypes
相对而言,7 种基因在印第安纳沙门氏菌(oqxB,45.37%;aac(6’)-Ib,50.93%)、德比沙门氏菌(oqxA,45.24%;qnrS,11.90%)和阿贡纳沙门氏菌(qnrA,43.75%;qnrB,25.00%)中检出率较高。
2.3.2 源于不同采样地点的沙门氏菌中7 种耐药基因检出情况
oqxA在源于医院的菌株中检出率(28.57%)最高,其次为超市(27.52%)和农贸市场(20.81%),但检出率间无显著性差异;在源于医院的NAL+CIP+型菌株中的检出率(72.73%)显著高于其在NAL+CIP-型(22.50%)和NAL-CIP-型(19.23%)菌株中的检出率(P<0.05)(图5A)。oqxB在源于超市菌株中的检出率(39.24%)显著高于其在源于农贸市场(27.30%)和医院(18.18%)的菌株;在源于超市的菌株中,NAL+CIP+型(47.69%)和NAL+CIP-型(41.60%)菌株中的检出率间无显著差异,但显著高于NAL-CIP-型(26.79%)(P<0.05)(图5B)。qepA在源于农贸市场(3.24%)和超市(3.54%)的菌株中的平均检出率间无显著差异;而在不同耐药表型的菌株中检出率间均有显著差异(P<0.05)(图5C)。aac(6’)-Ib在源于医院的菌株中的检出率(37.66%)显著高于在超市(23.71%)和农贸市场(21.08%)(P<0.05);在源于医院的NAL+CIP+型菌株中的检出率(90.91%)显著高于NAL-CIP-型(30.77%)和NAL+CIP-型(27.50%)(P<0.05)(图5D)。qnrA在源于农贸市场(24.59%)和超市(29.43%)的菌株种检出率间无显著差异,但显著高于医院(5.17%)菌株检出率;源于超市的菌株中不同耐药表型之间差异显著(P<0.05)(图5E)。qnrB在源于农贸市场(28.11%)和超市(24.52%)的菌株中的检出率间无显著差异,但显著高于医院(5.19%)菌株中的检出率(P<0.05);源于超市的NAL-CIP-型(45.54%)菌株中的检出率显著高于NAL+CIP+型(13.08%)和NAL+CIP-型(17.60%)菌株(P<0.05)(图5F)。qnrS在源于农贸市场(10.00%)、超市(10.90%)和医院(9.09%)的菌株中的检出率及在源于该3 类样点具不同表型的菌株中的检出率间均无显著性差异(图5G)。
总体而言,7 种基因在源于超市(qnrA,29.43%;qnrB,24.52%;qnrS,10.90%;qepA,3.54%;oqxB,39.24%)和医院(aac(6’)-Ib,37.66%;oqxA,28.57%)的菌株中的检出率较高。


图5 不同采样地点具不同耐药表型的沙门氏菌中7 种耐药基因的检出率Fig. 5 Prevalence of seven fluoroquinolones resistance genes in Salmonella with different resistance phenotypes from different sampling places
2.3.3 不同样品来源沙门氏菌中7 种基因的检出情况
oqxA在来源于猪肉的菌株中的检出率(31.25%)最高,其次为人粪(28.57%)和鸡肉(24.82%),但其检出率间无显著性差异;猪肉源沙门氏菌中NAL+CIP+型(60.00%)和NAL-CIP-型(50.00%)菌株中oqxA的检出率显著高于NAL+CIP-型(6.90%)菌株(P<0.05)(图6A)。oqxB在鸡肉源菌株中的检出率(39.72%)显著高于人粪(18.18%)和猪肉(18.75%)源菌株(P<0.05);在人粪源NAL+CIP+型(63.64%)菌株中的检出率显著高于NAL-CIP-型(11.54%)和NAL+CIP-型(10.00%)菌株(P<0.05)(图6B)。qepA在鸡肉源NAL-CIP-型(9.40%)菌株中的检出率显著高于NAL+CIP+型(1.06%)(P<0.05)(图6C)。aac(6’)-Ib在人粪源菌株中的检出率(37.66%)最高,其次为猪肉(31.25%)和鸡肉(25.185%)源菌株,但3者间无显著差异;人粪源NAL+CIP+型(90.91%)菌株中的检出率显著高于NAL-CIP-型(30.77%)和NAL+CIP-型(27.50%)菌株(P<0.05)(图6D)。qnrA在鸡肉(21.28%)和猪肉(29.69%)源菌株中的检出率间无显著差异,但显著高于人粪源菌株中的检出率(5.17%)(P<0.05);鸡肉源菌株中不同耐药表型间差异显著(P<0.05)(图6E)。qnrB在鸡肉(23.76%)和猪肉(31.25%)源菌株中的检出率间无显著性差异,但显著(P<0.05)高于人粪源菌株中的检出率(6.49%);鸡肉源菌株中不同耐药表型间差异显著(P<0.05)(图6F)。qnrS在人粪源菌株中的检出率(23.38%)显著高于鸡肉(7.98%)和猪肉(7.81%)源菌株(P<0.05);来源于人粪中的NAL+CIP+型菌株中的检出率(100.00%)显著高于NAL-CIP-型(3.85%)和NAL+CIP-型(15.00%)菌株(P<0.05)(图6G)。
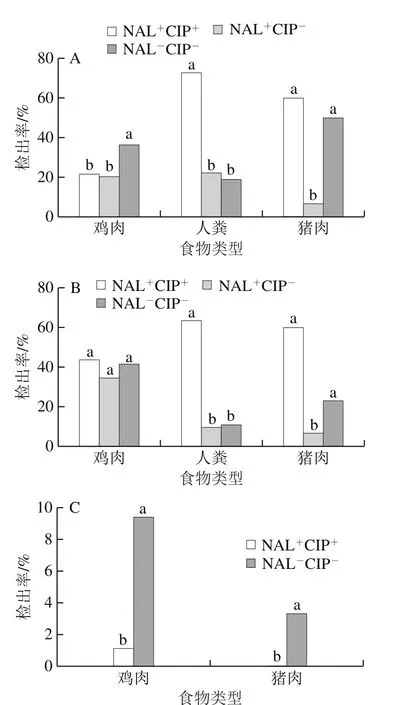
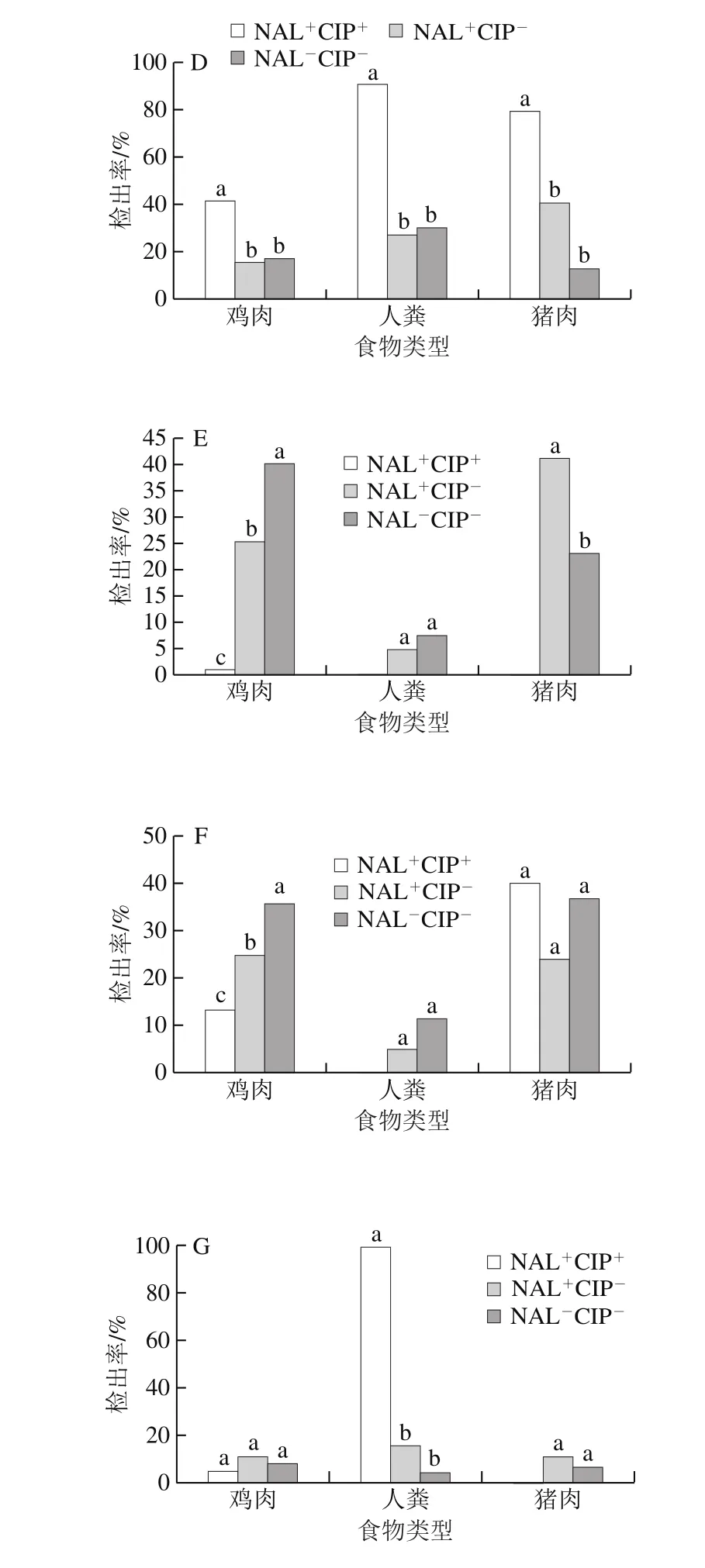
图6 不同样品来源且具不同耐药表型的沙门氏菌中7 种耐药基因的检出率Fig. 6 Prevalence of seven fluoroquinolones resistance genes in Salmonella with different resistance phenotypes from different samples
2.3.4 不同地域来源沙门氏菌中7 种基因的检出情况

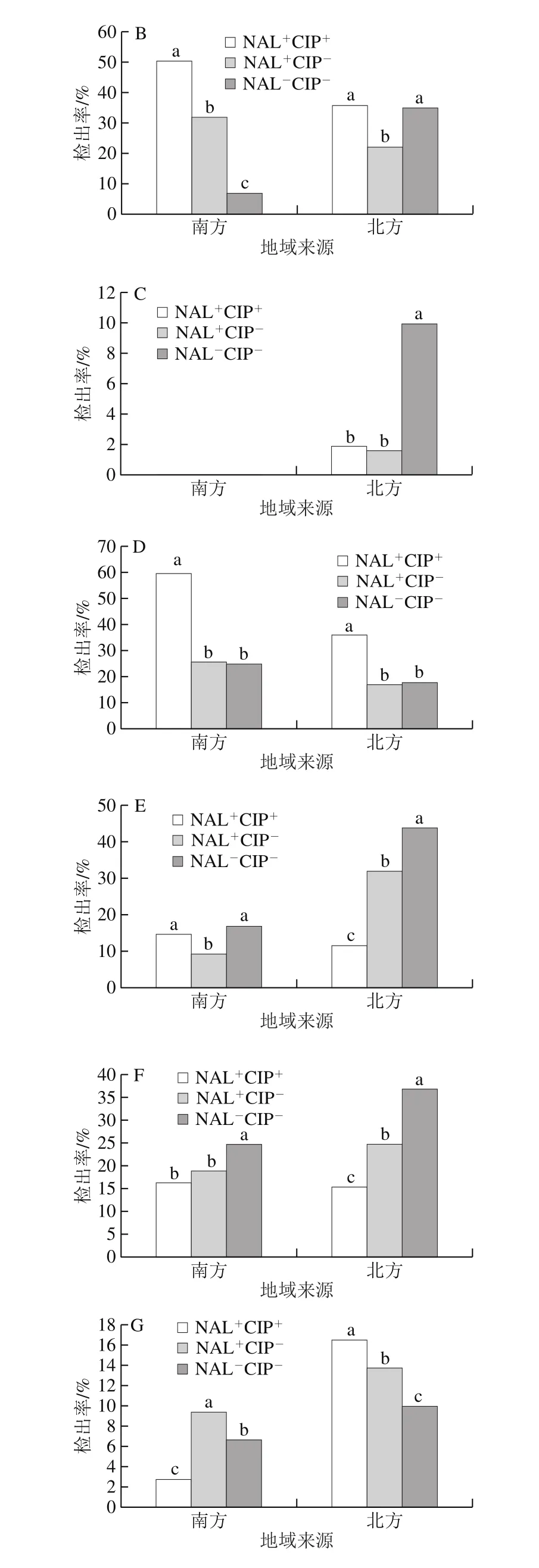
图7 不同地域来源且具不同耐药表型的沙门氏菌中7 种耐药基因的检出率Fig. 7 Prevalence of seven genes in Salmonella with different resistance phenotypes from different geographical regions
以秦岭-淮河为界,把9 省市分为南北方两个区域,陕西、新疆、河南和北京为北方,广东、广西、四川、福建和上海为南方。oqxA在南方的菌株中的检出率(25.24%)略高于北方(24.16%),但其检出率间无显著性差异;在南方3 种耐药表型菌株中的检出率间均有显著差异(P<0.05)(图7A)。oqxB在南方菌株中的检出率(34.19%)略高于北方(30.34%),二者无显著差异;在南方3 种不同耐药表型的菌株中的检出率间存在显著差异(P<0.05)(图7B)。qepA在北方菌株中的检出率(4.99%)显著高于南方;北方NAL-CIP-型菌株中的检出率显著较高(P<0.05)(图7C)。aac(6’)-Ib在南方菌株中的检出率(32.53%)显著(P<0.05)高于北方(20.96%);无论在南方还是北方,NAL+CIP+型菌株中的检出率均显著高于NAL+CIP-型和NALCIP-型菌株中的检出率(P<0.05)(图7D)。qnrA在北方菌株中的检出率(32.53%)显著高于南方菌株中的检出率(12.78%)(P<0.05);在北方3 种耐药表型菌株中的检出率间均有显著性差异,南方NAL+CIP+型(14.00%)和NAL-CIP-型(16.67%)菌株中的检出率则显著高于NAL+CIP-型(9.49%)(P<0.05)(图7E)。qnrB在北方菌株中的检出率(27.74%)显著高于南方菌株中的检出率(19.17%)(P<0.05);在北方和南方3 种耐药表型的菌株中的检出率间均存在一定的差异(P<0.05)(图7F)。qnrS在北方菌株中的检出率(12.77%)显著(P<0.05)高于南方(6.39%);无论在南方还是北方,在3 种耐药表型菌株中的检出率间均有显著性差异(图7G)。
2.4 沙门氏菌中与(氟)喹诺酮类抗生素耐药相关基因突变
gyrA中检出221 个氨基酸突变点,以Ser83Phe/Asp87Gly(21.27%)最为常见,其次分别为Ser83Phe(16.29%)、Asp87Gly(13.57%)、Ser83Tyr(12.22%)、Asp87Tyr(11.31%)、Asp87Asn(10.41%)、Ser83Phe/Asp87Asn(9.95%)、Ser83Tyr/Asp87Gly(2.71%)、Asp87Val(0.90%)、Gly75Phe(0.45%)、Asp87Asn/Ile89Val(0.45%)和Asp87Asn/Val90Gly(0.45%)。parC中检出214 个突变点,以Ser80Arg(64.49%)最为常见,其次分别为Thr57Ser(35.05%)和Ser80Arg/Gly72Phe(0.47%)。
沙门氏菌对(氟)喹诺酮类抗生素的耐药表型与gyrA和parC氨基酸突变检出率之间存在着一定的相关性。如表3所示,219 株同时耐萘啶酮酸和环丙沙星的沙门氏菌中共检出265 个点突变,占全部点突变的60.50%。对2 种抗生素同时产生抗性的沙门氏菌中,gyrA和parC中氨基酸突变点的检出率显著高于在其他几种耐药表型菌株中突变的检出率(P<0.05),表明沙门氏菌和(氟)喹诺酮类抗生素抗性有关的gyrA和parC中氨基酸突变越多,菌株对(氟)喹诺酮类抗生素的耐药性就越强。突变的发生与环丙沙星的耐药性关联性更高。
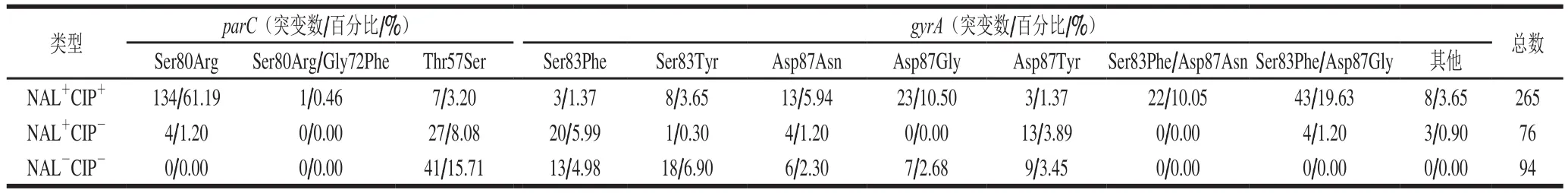
表3 (氟)喹诺酮抗生素抗性沙门氏菌gyrA和parC氨基酸突变Table 3 Mutations in gyrA and parC in fluoroquinolones resistant Salmonella
3 讨论与结论
沙门氏菌血清型种类繁多、菌株复杂,且其菌型分布具有很强的区域特点。世界各国流行的沙门氏菌虽有所差异,但大多以肠炎沙门氏菌、鼠伤寒沙门氏菌、印第安纳沙门氏菌和德尔卑沙门氏菌等为主[21-23]。
本研究结果显示,存在于我国食品和部分临床生物样品中的沙门氏菌主要为鼠伤寒沙门氏菌(24.08%)、肠炎沙门氏菌(1 9.4 1%)和印第安纳沙门氏菌(13.27%),与施开创[24]、张秀丽[25]等和刘谢[26]的血清分型结果一致,表明鼠伤寒沙门氏菌、肠炎沙门氏菌和印第安纳沙门氏菌在我国肉类食品中流行广泛,要严格预防控制。814 株沙门氏菌涵盖了83 种血清型,表明市售食物中沙门氏菌的血清型具有较高的多样性。
各种抗生素药物的广泛使用已经导致沙门氏菌及其他细菌对抗菌药物的耐药状况十分严重[27-28]。刘渠等[29]对69 株分离于720 份生肉类样品中沙门氏菌药敏性测定发现,88.6%、34.77%和5.80%的分离株分别对1、5 种和11 种以上抗生素产生抗性。吴云凤等[30]对分离于204 份肉鸡胴体的71 株沙门氏菌的药敏性检测结果表明沙门氏菌至少对3 种以上抗生素耐药,耐3~7 种药物的菌株比例达33.8%,耐8~12 种药物的达26.8%,耐13~16 种药物的达36.6%。本研究结果与上述结果以及与潘志明[31]、代娟娟[32]、谢一俊[33]、孙璐[34]等报道的沙门氏菌对(氟)喹诺酮类抗生素的耐药性结果比较相似,表明沙门氏菌耐药性的产生已成为当前食品安全和公共安全卫生领域的核心问题之一。
本研究814 株沙门氏菌中,67.94%的菌株对萘啶酮酸产生抗性,对环丙沙星耐药的菌株比例为26.90%。郝宏姗等[35]的研究表明63.59%的鸡肉源沙门氏菌对萘啶酮酸产生抗性,21.28%菌株对环丙沙星产生抗性,与本研究结果比较相似。由于萘啶酮酸在动物养殖过程使用较多,而环丙沙星则是沙门氏菌病临床治疗常用药物,沙门氏菌对2 种抗生素耐药率的升高很可能导致临床治疗失败,加强抗生素的监督和监管已迫在眉睫。
导致沙门氏菌耐药性出现的原因很多,质粒介导的(氟)喹诺酮抗生素抗性是沙门氏菌耐药性产生的一个重要机制[36]。质粒携带的与(氟)喹诺酮类药物耐药相关的基因既可纵向传播,也可横向传播(主要通过接合转移方式传递给其他细菌)。除携带(氟)喹诺酮类抗生素耐药基因外,这些质粒通常还携带可引起其他抗生素耐药的附加基因[37]。国内外对沙门氏菌质粒介导氟喹诺酮类耐药相关基因检测结果显示,aac(6’)-Ib检出率为0.05 ~37.1%[38-39],qnrA检出率为0qnrB检出率为0.026 % ~11.34%[38,40-42],qnrS检出率为0.57 ~10.29%[38,40-42],oqxA检出率为20.2%~51.3%[43],oqxB检出率为20.2%~51.3%[43],大部分报道中未见有qepA检出[43-46]。
本研究中,oqxB检出率(31.82%)最高,aac(6’)-Ib、qnrA、oqxA、qnrB、qnrS和qepA的平均检出率分别为27.52%、24.94%、24.57%、24.45%、10.32%和3.07%。与同类研究结果相比,本研究aac(6’)-Ib的检出率远高于其他国家[38,40,42],但低于我国医学临床菌株中该基因的检出率(37.1%)[39]。研究中qnrB的检出率同样高于一些欧洲国家[42],且远高于美国和我国医学临床菌株中的检出率[38,40-41]。qnrA检出率也明显高于欧洲[42]。这可能由于qnrA和qnrB主要存在于可转移质粒或其他可移动基因元件,经接合或转导作用在不同的细菌之间进行传递的结果。qnrS的检出率也高于欧洲一些国家[42]。7 种常被质粒上携带的基因的检出率在沙门氏菌中频被检出可能是导致沙门氏菌对常用(氟)喹诺酮类抗生素耐药的原因之一。
抗生素靶位编码基因突变导致表达产物的空间构型与理化性质发生变化,进而致使药物的结合作用下降或消失是耐药性产生的另一重要原因。DNA解旋酶亚单位GyrA和拓扑异构酶IV亚单位ParC中的氨基酸突变在沙门氏菌对(氟)喹诺酮类抗生素药敏性降低及多重耐药性形成过程中起重要的作用[47]。DNA解旋酶亚单位GyrA氨基酸在83或/和87位点处发生点突变,parC基因57和80位点发生突变是细菌耐萘碇酮酸和环丙沙星等(氟)喹诺酮类抗生素的主要耐药机制,也是本研究中沙门氏菌对萘啶酮酸和环丙沙星呈现出高耐药率的原因之一。本研究在gyrA中检出221 个氨基酸突变点,以Ser83Phe-Asp87Gly双突变(21.27%)最为常见;parC中检出214 个突变点,以Ser80Arg(64.49%)突变最为常见,这些突变的发生在很大程度影响了(氟)喹诺酮类抗生素对沙门氏菌的作用,导致耐药性的产生,这可能也是本研究中沙门氏菌对萘啶酮酸和环丙沙星呈现出高耐药率的原因之一。
细菌耐药已成为当前食品安全和公共安全卫生领域的核心问题之一。质粒介导的(氟)喹诺酮类抗生素耐药、DNA解旋酶和拓扑异构酶IV氨基酸突变,特别是质粒携带介导与耐药性相关基因的水平传递和转移是导致细菌耐药的主要原因[48-49]。研究不同食物类型、不同采样地点和不同血清型的沙门氏菌的药敏情况及耐药性产生相关基因,将有助于设计干预措施减少耐药的发生。同时,也有助于人们在食用动物用药上作出慎重的选择,控制耐药菌株的传播,减少和防止沙门氏菌耐药性的产生,对保障食品安全和保证人类健康具有重要意义。
